cAMP/PKA-pCREB信号通路介导康复训练促进脑缺血大鼠运动功能恢复的探讨
2014-05-10牛陵川张燕虹李长清刘彬蒋莹李隆龄
牛陵川,张燕虹,李长清,刘彬,蒋莹,李隆龄
(重庆医科大学附属第二医院,1.康复科;2.神经内科,重庆 400010)
研究报告
cAMP/PKA-pCREB信号通路介导康复训练促进脑缺血大鼠运动功能恢复的探讨
牛陵川1,张燕虹2,李长清2,刘彬2,蒋莹2,李隆龄2
(重庆医科大学附属第二医院,1.康复科;2.神经内科,重庆 400010)
目的探讨cAMP/PKA-pCREB信号通路是否在康复训练促进的缺血性脑卒中大鼠运动功能的恢复方面发挥作用。方法采用Longa改良线栓法制备大鼠大脑中动脉缺血再灌注模型(middle cerebral artery ischemia-reperfusion model,MCAO),造模成功的大鼠随机分为自然恢复组(n=24)、自然恢复+Rp-cAMP组(n=24)、康复训练组(n=18)和康复训练+Rp-cAMP组(n=18)。同时设立假手术组(n=12)。于侧脑室注射RpcAMP后立即进行MCAO模型的制备。训练组大鼠于术后48 h开始每天给予平衡木、转棒及滚筒训练。采用平衡木试验评定大鼠的运动功能。酶联免疫法(ELISA)检测缺血灶周围的脑组织内PKA表达,蛋白免疫印迹法(Western blot)检测pCREB蛋白表达,同时采用免疫组化法对pCREB进行定位检测。结果(1)运动功能评分结果揭示,自然恢复+Rp-cAMP组大鼠的运动功能低于自然恢复组,提示Rp-cAMP可抑制脑缺血大鼠运动神经功能的恢复;康复训练组大鼠的运动功能明显高于自然恢复组,也高于康复训练+Rp-cAMP组,提示Rp-cAMP明显减弱康复训练促进脑缺血大鼠运动神经功能的恢复;(2)于术后2 d、7 d、14 d、21 d检测缺血灶周围的脑组织PKA、pCREB的蛋白表达结果显示:康复训练组明显高于自然恢复组,同时高于康复训练+Rp-cAMP组,提示康复训练促进脑缺血大鼠的PKA、pCREB蛋白的表达,且Rp-cAMP明显抑制了康复训练促进脑缺血大鼠的PKA、pCREB蛋白的表达。结论cAMP/PKA-pCREB信号通路可能介导康复训练促进的脑缺血大鼠运动功能的恢复。
脑缺血;康复训练;运动功能;外源性环腺苷酸;蛋白激酶A
康复训练促进脑卒中患者功能恢复已被证实,但其具体分子机制尚未完全清晰。我们前期研究发现给予外源性环腺苷酸(cyclic adenosine monophosphate,cAMP)类似物db-cAMP提高脑组织内cAMP的浓度后,可促进脑缺血后大鼠的神经功能恢复,并通过进一步实验研究[1-3]发现,cAMP-蛋白激酶A (protein kinase A,PKA)信号通路的激活可能是康复训练促进脑缺血大鼠运动功能恢复的机制之一,但是对于cAMP-PKA信号通路下游因子的表达及调控尚需进一步实验阐明。本研究继续采用线栓法制作大鼠大脑中动脉缺血再灌注模型,利用侧脑室注射PKA拮抗剂Rp-cAMP,检测缺血灶周边脑组织PKA和磷酸化cAMP反应元件结合蛋白(phosphorylated cAMP-response element binding protein, pCREB)表达的变化,观察cAMP/PKA-pCREB信号通路在康复训练促进脑缺血大鼠神经功能恢复过程中的作用。
1 材料和方法
1.1 实验动物与分组
清洁级成年SD雄性大鼠96只,体重(250± 20)g,由重庆医科大学实验动物中心[SCXK(渝) 2012-0002]提供,参照Longa[4]改良线栓法制备大鼠右侧大脑中动脉缺血再灌注模型(MCAO),术后2 h后进行缺血再灌注。大鼠手术麻醉清醒后出现左侧肢体瘫痪为模型成功的判断标准,无瘫痪和死亡的动物剔除。造模成功的84只大鼠纳入本研究,随机分为:自然恢复组(n=24)、自然恢复+RpcAMP组(n=24)、康复训练组(n=18)和康复训练+Rp-cAMP组(n=18),同时设立假手术组(n= 12)。实验操作平台由重庆医科大学第一附属医院实验研究中心[SYXK(渝)2010-0002]提供。
1.2 试剂
大鼠脑组织PKA蛋白浓度测定的酶联免疫(ELISA)Kit96T试剂盒购买于美国R&D公司,RpcAMP试剂购买于Sigma公司,兔来源的pCREB单克隆抗体购买于Cell Signaling Technology公司。
1.3 大鼠模型制备
1.3.1 大鼠MACO模型制备
参照Longa改良线栓法制备大鼠右侧大脑中动脉缺血再灌注(MACO)模型。用10%的水合氯醛0.33mL/100 g腹腔注射麻醉大鼠后,将其仰卧位固定于手术台,颈正中切口长约2 cm,分离右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)及颈外动脉(external carotid artery,ECA),结扎ECA远端,将ECA残端下拉与ICA成直线,微血管夹暂时夹闭ICA和CCA,在ECA残端近分叉处剪一小口,使用直径(0.28± 0.02)mm的前端均匀包裹有机硅胶的鱼线作为线栓,经ECA插入ICA,放松夹闭ICA的微血管夹,继续插入至18~20 mm阻断大脑中动脉血供,结扎ECA切口并固定栓子在ICA内,放松夹闭CCA的微血管夹,缝合切口。缺血2 h后拔出线栓使其再灌注。模型成功标准为大鼠手术麻醉清醒后出现左侧肢体瘫痪,无瘫痪和死亡的动物剔除。假手术组手术过程同上,只是暴露、分离血管与神经,仅插入线栓12 mm后立刻拔出,不以线栓阻断大脑中动脉血流,其后缝合切口置于普通笼内饲养,作为正常对照。自然恢复+Rp-cAMP和康复训练+Rp-cAMP两组则是在侧脑室注射5μL 40 nmol/L Rp-cAMP后立即进行MCAO模型的制备。
1.3.2 侧脑室注射
参照 Yoo等[5]的文献进行侧脑室注射 RpcAMP。用10%的水合氯醛0.33 mL/100 g腹腔注射麻醉大鼠后,将其固定于立体定位仪上,头顶部矢状正中切口1~1.5 cm,双氧水擦拭切口,充分清楚地暴露前囟,立体定位仪定位,前囟向后1.5 mm,向右旁移1.1 mm处进针约4.5 mm,利用5μL的微量注射器注入5μL的Rp-cAMP,以1μL/5 min的速度缓慢的注入,注射完药物后留针5 min,再缓慢拔出注射器,骨蜡封闭针眼后,消毒缝合切口后,立即进行MCAO模型的制备。
1.4 康复训练
康复训练组和康复训练+Rp-cAMP组大鼠于造模术后48 h开始进行下列康复训练:(1)平衡木训练:用长1.7 m、宽2.0 cm的方木棒,平放于距地面7 cm高的支架上,使大鼠在上面爬行,主要训练大鼠的行走平衡及协调功能;(2)转棒训练:用长1.5m、直径4.5 cm的圆木棒,按3 r/min的速度顺、逆时针交替转动,使大鼠在上面爬行,主要训练大鼠动态平衡能力;(3)自制滚筒训练:用训练器长65 cm、直径60.0 cm,中间分成4格,可同时训练4只大鼠,两侧有固定架,一段有手摇柄,按5 r/min的速度进行转动训练,主要训练大鼠的抓握、旋转等运动功能。
上述各项训练每日2次,每次10 min,每周6 d,训练前3 d强度减半(大鼠肢体瘫痪明显,可给予必要辅助)。自然恢复组的大鼠不予以上述针对性强化训练,可在笼内饮水、进食及自由活动。各组大鼠手术后分别置于普通笼内饲养(5只/笼),笼内环境和饲养条件相同。
1.5 大鼠运动功能评分
康复训练前进行平衡木试验评定大鼠的抓握及平衡等运动功能。评分时间点分为:术后2 d、14 d和21 d,每次评定3次,取其平均值。
平衡木试验(balance beam test)评分标准[6]:1分,能保持平衡且四肢均置于木条表面;2分,有一侧爪子握住木条或在木条上摇晃;3分,有一或两个肢体滑下木条;4分,三个肢体滑下木条;5分,在平衡木上试图保持平衡但滑下;6分,试图保持平衡失败悬吊在木条上然后跌落;7分,直接从木条上跌落而无试图保持平衡的过程。
1.6 组织提取及指标的检测
1.6.1 组织提取
(1)Western blot法的取材方法
分别于术后2 d、7 d、14 d和21 d进行各组大鼠的组织提取。手术器械提前高温处理后,10%水合氯醛腹腔麻醉大鼠后断头取脑,置于4℃的冰上迅速分离右侧大脑中动脉供血区域皮层,置于1.5 mL的灭酶EP管中,-80℃低温冰箱保存。
(2)免疫组化法的取材方法
分别于规定时间取材,10%水合氯醛麻醉大鼠后,固定于手术板上,于剑突处剪开胸腔,充分暴露心脏,将灌注针由左心室插入到主动脉后,用止血钳固定灌注针,剪开右心耳,将准备好的PBS 150 mL、4%多聚甲醛150 mL先后经心脏灌注固定后,安乐死后取脑,并将大脑置于4%多聚甲醛中,固定24 h换70%酒精中保存,待全部标本取齐后统一常规脱水、透明、浸蜡、包埋和切片,每张切片厚4 mm。
1.6.2 指标的检测
采用酶联免疫(ELISA)法检测脑组织PKA蛋白表达,蛋白印迹(Western blot)法检测脑组织pCREB蛋白表达,免疫组化法检测pCREB的分布。
(1)酶联免疫法
将组织由-80℃冰箱中取出后,称重并置于预冷的2 mL匀浆管中,按照100mg∶900μL的比例加入预冷的PBS液,制成10%的匀浆液,以上步骤均在4℃的冰上操作。匀浆液经反复冻融两次后, 2000 r/min离心15 min,提取上清作为待测样品,之后严格按照试剂盒说明书进行检测。
(2)蛋白印迹法
将组织由-80℃冰箱取出后,按照康为世纪公司提供的说明书提取脑组织全蛋白,BCA法测定蛋白浓度,用12%分离胶进行SDS-PAGE。实验结果重复5次,Quantity One软件分析各组蛋白及内参的灰度值,以目的蛋白与其内参条带灰度值的比值表示目的蛋白的相对表达量。
(3)免疫组化法
将石蜡切片依次进行脱蜡、脱水、枸橼酸缓冲液抗原修复、3%H2O2去除内源性过氧化酶活性、0.4%triton孵育、山羊血清封闭、1∶800的 pCREB一抗、二抗、HRP、DAB显色、苏木素复染、盐酸分化、碳酸锂泛蓝;逆浓度酒精脱水、封片前二甲苯透明、中性树脂封片,采图、Image-Pro Plus 6.0软件分析。
1.7 统计学方法
采用SPSS 17.0版统计软件对数据进行统计分析,所有计量资料用(±s)表示,多组间比较用单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠运动功能评分
平衡木试验评分结果见表1,运动功能评分越高表明大鼠运动功能越差。假手术组大鼠平衡木试验运动功能评分均为(1±0);除假手术组外,其他各组在术后清醒时评分相近;但在术后14 d和21 d,自然恢复+Rp-cAMP组明显高于自然恢复组,提示Rp-cAMP可抑制脑缺血大鼠运动神经功能的恢复;康复训练组评分明显低于自然恢复组,提示康复训练促进了脑缺血后大鼠的运动功能恢复。自然恢复+Rp-cAMP组评分明显高于自然恢复组,康复训练+Rp-cAMP组评分明显高于康复训练组,提示cAMP/PKA通路在康复训练促进脑缺血后大鼠的运动功能恢复中起着重要作用。
2.2 大鼠脑组织PKA、pCREB蛋白的表达结果
各组不同时间点PKA蛋白的表达结果见表2, pCREB蛋白的表达结果见图1和表3。康复训练组的大鼠PKA、pCREB蛋白表达明显高于自然恢复组,同时高于康复训练+Rp-cAMP组大鼠,结合运动功能评分结果可推断:康复训练促进脑缺血后大鼠运动功能的恢复与cAMP/PKA信号通路及其下游pCREB的激活密切相关。
2.3 免疫组化法检测pCREB蛋白的分布
各组大鼠脑组织pCREB表达的免疫组化检测结果见图2。pCREB蛋白是CREB蛋白的磷酸化形式,是cAMP-PKA信号通路的主要下游蛋白,正常大鼠可见少量的pCREB蛋白表达,pCREB位于细胞核内,核仁染色呈棕黄色,胞质和突触等部位未见着色。其表达的检测结果趋势与Western蛋白印迹检测结果的趋势相一致,康复训练组的大鼠pCREB蛋白的表达明显高于自然恢复组,同时高于康复训练+Rp-cAMP组大鼠,结合运动功能评分结果可推断:康复训练促进脑缺血后大鼠运动功能的恢复与cAMP/PKA信号通路的下游pCREB蛋白表达增加密切相关(图2见彩插4)。
表1 各组大鼠不同时间点的运动功能评分(±s)Tab.1 Scores ofmotor function by balance beam test in the rats at different time points
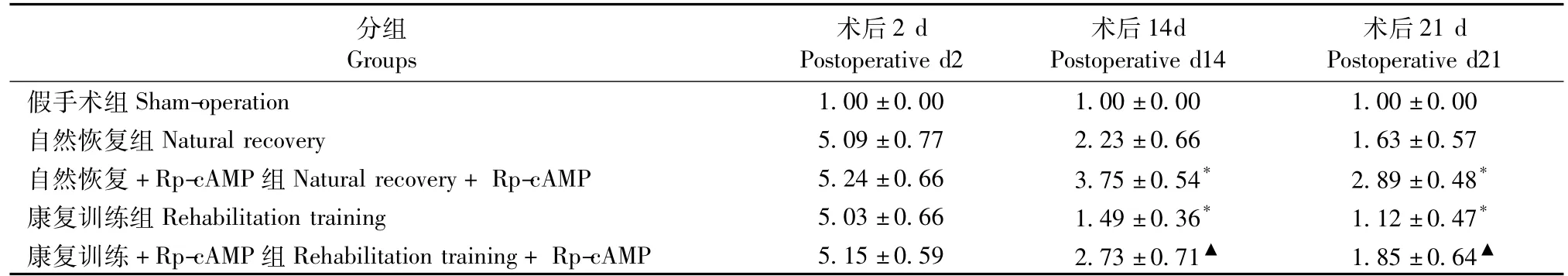
表1 各组大鼠不同时间点的运动功能评分(±s)Tab.1 Scores ofmotor function by balance beam test in the rats at different time points
注:与自然恢复组比较,*P<0.05,与康复训练组比较,▲P<0.05。Note:*P<0.05,compared with the natural recovery group;▲P<0.05,compared with the rehabilitation training group.
术后21 d Postoperative d21假手术组Sham-operation 1.00±0.00 1.00±0.00 1.00±0.00自然恢复组Natural recovery 5.09±0.77 2.23±0.66 1.63±0.57自然恢复+Rp-cAMP组Natural recovery+Rp-cAMP 5.24±0.66 3.75±0.54*2.89±0.48*康复训练组Rehabilitation training 5.03±0.66 1.49±0.36*1.12±0.47*康复训练+Rp-cAMP组Rehabilitation training+Rp-cAMP 5.15±0.59 2.73±0.71▲1.85±0.64分组Groups术后2 d Postoperative d2术后14d Postoperative d14▲
表2 各组大鼠不同时间点的PKA蛋白表达(±s)Tab.2 Expression of PKA protein in the rats at different time points
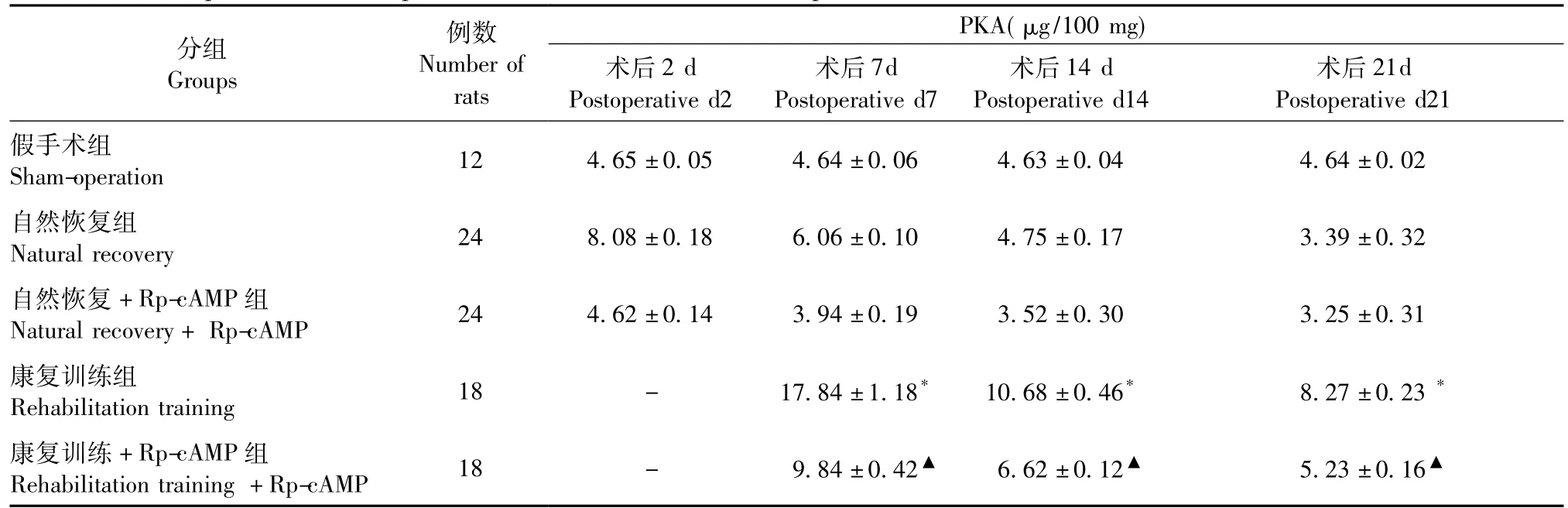
表2 各组大鼠不同时间点的PKA蛋白表达(±s)Tab.2 Expression of PKA protein in the rats at different time points
注:与自然恢复组比较,*P<0.05,与康复训练组比较,▲P<0.05。Note:*P<0.05,compared with the natural recovery group;▲P<0.05,compared with the rehabilitation training group.
分组Groups例数Number of rats PKA(μg/100 mg)术后2 d Postoperative d2术后7d Postoperative d7术后14 d Postoperative d14术后21d Postoperative d21假手术组Sham-operation 12 4.65±0.05 4.64±0.06 4.63±0.04 4.64±0.02自然恢复组Natural recovery 24 8.08±0.18 6.06±0.10 4.75±0.17 3.39±0.32自然恢复+Rp-cAMP组Natural recovery+Rp-cAMP 24 4.62±0.14 3.94±0.19 3.52±0.30 3.25±0.31康复训练组Rehabilitation training 18 - 17.84±1.18*10.68±0.46*8.27±0.23*康复训练+Rp-cAMP组Rehabilitation training+Rp-cAMP 18 - 9.84±0.42▲6.62±0.12▲5.23±0.16▲
表3 各组大鼠不同时间点的pCREB蛋白表达(±s)Tab.3 Expression of pCREB protein in the rats at different time points
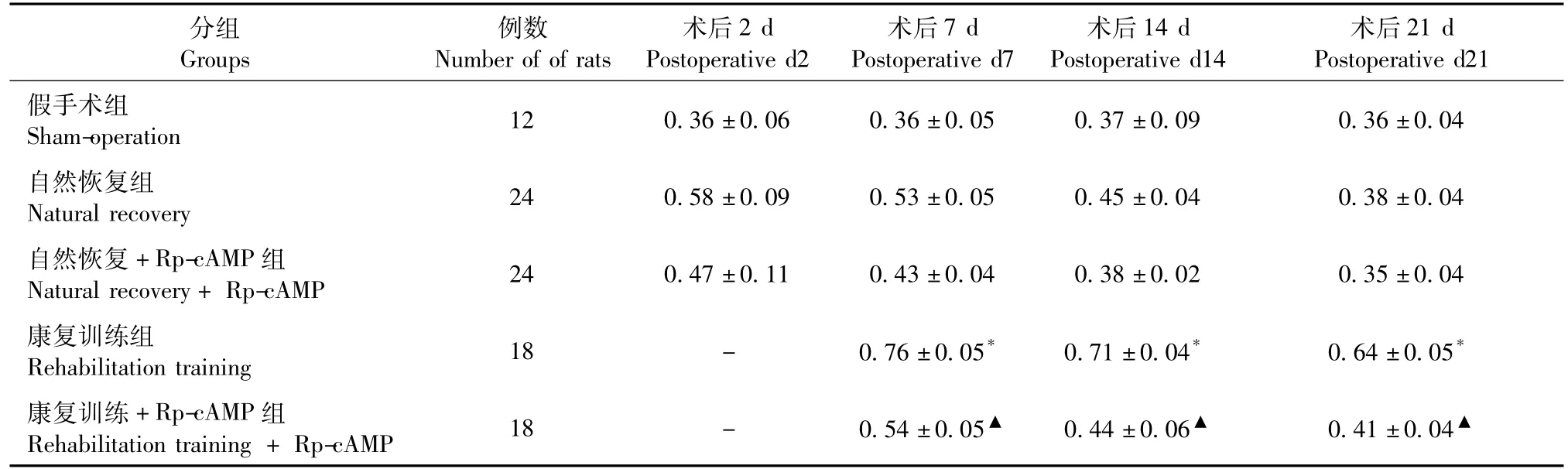
表3 各组大鼠不同时间点的pCREB蛋白表达(±s)Tab.3 Expression of pCREB protein in the rats at different time points
注:与自然恢复组比较,*P<0.05,与康复训练组比较,▲P<0.05。Note:*P<0.05,compared with the natural recovery group;▲P<0.05,compared with the rehabilitation training group
分组Groups例数Number of of rats术后2 d Postoperative d2术后7 d Postoperative d7术后14 d Postoperative d14术后21 d Postoperative d21假手术组Sham-operation 12 0.36±0.06 0.36±0.05 0.37±0.09 0.36±0.04自然恢复组Natural recovery 24 0.58±0.09 0.53±0.05 0.45±0.04 0.38±0.04自然恢复+Rp-cAMP组Natural recovery+Rp-cAMP 24 0.47±0.11 0.43±0.04 0.38±0.02 0.35±0.04康复训练组Rehabilitation training 18 - 0.76±0.05*0.71±0.04*0.64±0.05*康复训练+Rp-cAMP组Rehabilitation training+Rp-cAMP 18 - 0.54±0.05▲0.44±0.06▲0.41±0.04▲

注:(1)和(2)分别是术后7d和14d. A:假手术组,B:自然恢复组,C:自然恢复+RpcAMP组,D:康复训练组,E:康复训练+Rp-cAMP组。图1 蛋白印迹法检测各组大鼠不同时间点pCREB蛋白的表达量Note:(1),(2):pCREB protein expression in each group at7 days and 14 days after surgery. A:Sham-operated group;B:Natural recovery group;C:Natural recovery+Rp-cAMP group; D:Rehabilitation training group;E:Rehabilitation training+Rp-cAMP group.Fig.1 pCREB protein expression in the rats at different time points.
3 讨论
cAMP-PKA信号转导、gpl30/JAK/STAT3信号转导、MAPK信号转导、P13K/Akt信号转导等是已被证实与神经再生有关的信号途径[7-10]。cAMP作为细胞内最重要的第二信使之一,其作用是通过激活PKA系统来实现的。我们前期研究[2]发现:与自然恢复组相比,接受康复训练治疗的脑缺血大鼠,其脑组织内cAMP和PKA表达水平均明显增高,同时运动功能评分结果显示运动功能明显改善,表明康复训练对脑缺血大鼠运动功能的促进作用可能是通过cAMP-PKA信号转导途径介导实现的,而cAMPPKA信号通路及其下游因子的表达调控方式是我们需要进一步研究验证的。
Montminy等[11]在研究生长抑素基因的表达与调节时发现了cAMP反应元件结合蛋白(cAMP response element-binding protein,CREB),是一种位于直核生物细胞核内的蛋白质,作为一种核内调控因子,在神经元再生突触形成及学习记忆等方面具有重要的调节作用[12-14]。Gonzalez等[15]首次从大鼠脑组织中纯化出CREB,它由341个氨基酸残基构成,N末端为蛋氨酸,C末端为天冬氨酸。而CREB的调节转录功能与本身磷酸化作用的调节相反,去磷酸化使调节转录活性减弱,当cAMP-PKA作用于CREB使其自身磷酸化,磷酸化的CREB形成同源二聚体,与DNA上的cAMP应答元件(cAMP response element,CRE)结合,启动CRE调控的基因转录,与缺血状态下的神经保护密切相关[16-18]。因此我们选择了磷酸化CREB作为cAMP-PKA信号通路的下游因子纳入研究。
实验结果发现康复训练介入的脑缺血大鼠与自然恢复组相比,其缺血灶周围的脑组织 PKA、pCREB蛋白表达均明显增高,同时大鼠的运动功能亦明显提高,提示PKA及pCREB在康复训练改善大鼠的运动功能恢复起着重要的促进作用。为了进一步证实CREB是否作为cAMP-PKA信号通路的下游因子介导康复训练促进脑梗死后大鼠运动功能恢复,我们在实验中加入了PKA拮抗剂Rp-cAMP,结果发现康复训练组的大鼠运动功能恢复明显优于康复训练+Rp-cAMP组,同时其PKA、pCREB蛋白表达亦明显高于加入拮抗剂的大鼠,说明康复训练促进脑缺血大鼠运动功能的恢复与 cAMP/PKA-pCREB信号通路的激活密切相关。
研究者还发现磷酸化CREB可启动CRE调控的基因转录,从而促进多种神经相关因子的表达,包括多胺、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、神经生长因子(nerve growth factor, NGF)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)等[19-21],其中的NGF及BDNF已被广泛证实能够促进周围神经和中枢神经受损后的神经功能恢复。多胺等因子是否也在康复训练促进大鼠运动功能恢复中起着同样重要的作用,需要我们进一步的研究验证。
(本文图2见彩插4。)
[1] Niu L,Zhou J,Huang Y,etal.db-Cyclic adenosinemonophosphate promotes axon regeneration and motor function recovery in cerebral ischemia-reperfusion rats[J].Neurol India.2010,58 (2):195-200.
[2] 张燕虹,李长清,牛陵川.康复训练对脑缺血大鼠运动功能恢复和cAMP-PKA信号通路的影响[J].中国实验动物学报, 2013,21(6):46-49.
[3] 牛陵川,李长清,陈艳,等.双丁酸环腺苷酸促进脑缺血再灌注大鼠轴突再生和运动功能恢复[J].中国老年学杂志. 2009,29(7):805-808.
[4] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke. 1989,20(1):84-91.
[5] Yoo SB1,Lee S,Lee JY,etal.cAMP/PKA agonist restores the fasting-induced down-regulation of nNOS expression in the paraventricular nucleus[J].Korean J Physiol Pharmacol.2012,16 (5):333-337.
[6] MátéffyováA1,Otáhal J,Tsenov G,et al.Intrahippocampal injection of endothelin-1 in immature rats results in neuronal death, development of epilepsy and behavioral abnormalities later in life[J].Eur JNeurosci,2006,24(2):351-360.
[7] Vourc’h P,Dessay S,Mbarek O,et al.The oligodendrocytemyelin glycoprotein gene is highly expressed during the late stages ofmyelination in the rat central nervous system[J].Brain Res Dev Brain Res.2003,144(2):159-168.
[8] Neumann S,Bradke F,Tessier-Lavigne M,et al.Regeneration of sensory axons within the injured spinal cord induced by intraganglionic cAMP elevation[J].Neuron.2002,34(6):885-893.
[9] Domeniconi M,Filbin MT.Overcoming inhibitors in myelin to promote axonal regeneration[J].JNeurol Sci.2005,233(1-2):43-47.
[10] Chierzi S,Ratto GM,Verma P,etal.The ability of axons to regenerate their growth cones depends on axonal type and age,and is regulated by calcium,cAMP and ERK.[J].Eur JNeurosci. 2005,21(8):2051-2062.
[11] Montminy MR,Bilezikjian LM.Binding of a nuclear protein to the cyclic-AMP response element of the somatostatin gene[J]. Nature,1987,328(6126):175-178.
[12] Kida S.A functional role for CREB as a positive regulator of memory formatiob and LTP[J].Exp Neurobiol,2012,21(4): 136-140.
[13] Kandel ER.The molecular biology of memory:cAMP,PKA, CRE,CREB-1,CREB-2,and CPEB[J].Mol Brain,2012,5 (10):14.
[14] Barco A,Marie H.Genetic approaches to investigate the role of CREB in neuronal plasticity and memory[J].Mol Neurobiol, 2011,44(3):330-349.
[15] Gonzalez GA,Yamamoto KK,Fischer WH,et al.A cluster of phosphorylation sites on the cyclic AMP-regulated nuclear factor CREB predicted by its sequence[J].Nature,1989,337:749-752.
[16] Chang YC,Huang CC.Perinatal brain injury and regulation of transcription[J].Curr Opin Neurol,2006,19(2):141-147.
[17] Lonze BE,Ginty1 DD.Function and regulation of CREB family transcription factors in the nervous systerm[J].Neuron. 2002.35(4):605-623.
[18] Takeda H,Kitaoka Y,Hayashi Y,et al.Calcium/calmodulindependent protein kinase II regulates the phosphorylation of CREB in NMDA-induced retinal neurotoxicity[J].Brain Res, 2007,1184:306-315.
[19] Walton M1,Connor B,Lawlor P,etal.Neuronal death and survival in twomodelsof hypoxic-ischemic brain damage[J].Brain Res Brain Res Rev.1999,29(2-3):137-168.
[20] Waltereit R,Weller M.Signaling from cAMP/PKA to MAPK and synaptic plasticity[J].Mol Neurobiol,2003,27(1):99-106.
[21] Qiu J,Cai D,Dai H,et al.Spinal axon regeneration induced by elevation of cyclic AMP[J].J Neuron,2002,34(6):895-903.
cAMP/PKA-pCREB signal transduction pathway may mediate a promoting effect of rehabilitation training on motor function after ischem ic stroke in rats
NIU Ling-chuan1,ZHANG Yan-hong2,LIChang-qing2,LIU Bin2,JIANG Ying2,LILong-ling2
(1.Department of Rehabilitation,2.Department of Neurology,the Second Affiliated Hospital of Chongqing Medical University,Chongqing 400010,China)
ObjectiveTo explore whether the cAMP-PKA-pCREB signal pathway plays a role in promoting the recovery ofmotor function after rehabilitation training in cerebral ischemia-reperfusion rats.M ethodsThemiddle cerebral artery occlusion model(MCAO)was established by modified Longa nylon occlusion method in adultmale Sprague-Dawley rats.The84 MCAO ratswere selected and randomly assigned to four groups:the natural recovery group withoutany special training(group B,n=24),natural recovery group with Rp-cAMP(group C,n=24),rehabilitation training group(group D,n=18)and rehabilitation trainingwith Rp-cAMP(group E,n=18),and in addition a control group(group A,n=12).To establish ratMCAOmodels immediately after injection of Rp-cAMP into the lateral ventricle of the brain.The rats in the groups D and Ewere trained by balance beam,bar rotating and rolling exercises started at48 h after MCAO.The expression of PKA was determined by enzyme-linked immunosorbent assay(ELISA)and the pCREB protein expression was detected by Western blotassay.Motor function was assessed by balance beam test.Results(1)Themotor function score in the group Cwas significantly higher than that of group B,suggesting that Rp-cAMP inhibited the recovery ofmotor function in the cerebral ischemia-reperfusion rats.The score of group D was significantly lower than that of groups B and E,indicating that Rp-cAMP inhibited the promoting effect of rehabilitation training on motor function in the cerebral ischemiareperfusion rats.(2)The expressions of PKA and pCREB proteins detected at2nd,7th,14th,and 21th days after surgery showed that their expressions in the group D were significantly higher than those of the groups B and E,indicating that rehabilitation training promoted the expression of PKA and pCREB,and Rp-cAMP significantly inhibited the promoting effect of rehabilitation training on the expressions of PKA and pCREB proteins.ConclusioncAMP/PKA-pCREB signal transduction pathwaymaymediate a promoting effect of rehabilitation training on the recovery ofmotor function after ischemic stroke in rats.
Cerebral ischemia;Rehabilitative training;Motor function;Cyclic adenosine monophosphate;Protein kinase A
Q95-33
A
1005-4847(2014)03-0024-06
10.3969/j.issn.1005-4847.2014.03.000
2014-03-24
重庆市卫生局医学科研项目(No.2011-2-161)。
牛陵川(1977-),女,博士研究生,主治医师,E-mail:378442578@qq.com
