基于酶活性调节的酿酒酵母谷胱甘肽发酵调控研究
2014-04-24方聪明刘联杰周安盛林建国
方聪明,刘联杰,周安盛,杜 馨,林建国,蔡 俊*
(湖北工业大学 发酵工程教育部重点实验室,湖北 武汉 430068)
谷胱甘肽(glutathione,GSH)是生物体中广泛存在的非蛋白质巯基类三肽化合物,作为一种特殊的肽类,其在真核细胞中占主要地位[1]。GSH在很多的生化过程中起作用,它具有抗氧化、解毒、参与蛋白质修饰及机体内物质转运等功能,这些生理活性作用使其在医药、食品及美容等行业有着很大的应用价值及潜力[2]。在细胞内谷胱甘肽经两步酶催化反应而生成,其中第一步反应中的γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS,EC 6.3.2.2)由GSH1基因编码合成,并且γ-GCS的活性受GSH的反馈抑制[3-4]。目前生产GSH的主要方法为微生物发酵法,主要利用酿酒酵母和产朊假丝酵母来生物合成[5]。提高酵母细胞内GSH的含量及细胞的生物量是研究中两个主要的指标。生物量的提高是通过高密度发酵来实现,补料分批发酵是进行高密度发酵重要手段,而胞内的GSH含量的提高需首先选育高产GSH的菌种[6-7],再通过生理环境调节来提高。为了提高这两个指标,很多文献报道研究了发酵培养条件及培养基成分[8-11]、发酵方式[12-13]、前体物质的补加[14-15]和生理环境胁迫[16]等,但GSH产量仍不高,发酵成本较高,无法工业化大规模生产。本实验在研究了GSH合成关键酶γ-谷氨酰半胱氨酸合成酶的酶活特征的基础上,对补料分批发酵中pH控制和温度进行实验优化,来提高酿酒酵母发酵中GSH的产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
高产谷胱甘肽酿酒酵母Saccharomyces cerevisiaeCCCG:发酵工程教育部重点实验室保藏。
1.1.2γ-谷氨酰半胱氨酸合成酶
由本实验室通过含GSH1基因表达质粒的大肠杆菌工程菌诱导表达并分离纯化而制得。具体方法:将大肠杆菌工程菌E.coliBL21(pGEX-GSH1)在LB培养基中经异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)诱导培养,收集菌体,超声波破碎,离心取上清液,过GST-Resin柱,并在层析柱上切除谷胱甘肽转移酶(glutathione S-tranferase,GST)标签,最后获得GSH1重组蛋白,-20 ℃保存。
1.1.3 主要试剂
GSH(分析纯)、庚烷磺酸钠(分析纯)、三磷酸腺苷酸钠(分析纯):美国Sigma公司;三羟甲基氨基甲烷(分析纯):美国Amresco公司;预装1mL GST-Resin 重力柱:上海生工生物工程公司;其他试剂均为分析纯并购于上海国药集团。
1.1.4 培养基
大肠杆菌培养基(LB培养基):胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,固体培养基加入20 g/L 琼脂,pH 7.0 左右,121 ℃下灭菌20 min。
酿酒酵母菌种斜面活化培养基(YPD培养基):葡萄糖20 g/L,蛋白胨20 g/L,酵母提取物10 g/L,20 g/L琼脂,pH 6.0左右,115 ℃下灭菌30 min。
一级、二级种子液培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母提取物10 g/L,20 g/L琼脂,pH 6.0,115 ℃下灭菌30 min。
发酵培养基:酵母粉100 g溶于9 L水(成分A);糖蜜(含可发酵性糖28%)8 L(成分B);葡萄糖840 g 溶于3 L 水中(成分C);(NH4)2SO4264 g、NH4H2PO435 g 溶于700 mL水中(成分D),所有各成分121 ℃条件下灭菌20 min。
1.2 仪器与设备
30 L Biostat C plus发酵罐:德国贝朗(B.Braun)公司;LC-20AD HPLC系统:日本岛津(Shimadzu)公司;Inertsi ODS-SP色谱柱:岛津技迩公司(GL sciences)。
1.3 方法
1.3.1γ-谷氨酰半胱氨酸合成酶酶活的测定[17]
在1 mL体系中进行γ-谷氨酰半胱氨酸合成酶酶活的测定,缓冲液体系100 mmol/L Tris-HCl(pH=8.0),体系中含有20 mmol/L谷氨酸钠、10 mmol/L L-半胱氨酸、5 mmol/L三磷酸腺苷酸二钠、100 mmol/L NaCl、20 mmol/L MgCl2及适量的γ-谷氨酰半胱氨酸合成酶,将反应体系置于37 ℃水浴振荡处理30 min,最后加入质量分数10%三氯乙酸0.1 mL终止反应,并离心处理。取离心后的上清液利用磷钼蓝法测定反应过程中产生的无机磷量。γ-谷氨酰半胱氨酸合成酶酶活定义:在一定条件下,单位体积(mL)酶液在单位时间(h)内催化生成1 μmol无机磷的量为一个酶活单位(U)。
1.3.2γ-谷氨酰半胱氨酸合成酶酶学特性的分析
根据酶活的测定方法,改变缓冲液体系的反应pH(其变化从6.0至11.0),研究pH对γ-谷氨酰半胱氨酸合成酶活性的影响。同样改变缓冲液体系的反应温度(其变化从25 ℃到45 ℃),研究温度对γ-谷氨酰半胱氨酸合成酶活性的影响。
1.3.3 菌种活化及种子液培养条件
固体斜面试管30 ℃恒温箱中培养。一级种子液:用接种环取一环已活化好的菌种接入25 mL种子培养基250 mL三角揺瓶中,30 ℃、200 r/min恒温摇床培养18 h。二级种子液:用移液枪吸取10 mL 新鲜的一级种子培养液接入装有100 mL种子液的1 000 mL三角瓶中,30 ℃、200 r/min恒温摇床培养12 h。
1.3.4 发酵罐流加发酵的控制
发酵开始发酵罐中只有发酵培养基成分A,经过灭菌后培养基体积约为10 L,按10%的接种量接入培养好的二级种子,发酵过程中采用分阶段控制策略,发酵前期流加糖蜜(成分B),当菌体湿质量达到150 g/L左右时,开始流加葡萄糖(成分C)至菌体湿质量达到210 g/L 左右时,同时整个过程中一开始就流加氮源(成分D)至加完为止。在这个过程中通过控制转速、通气量、碳源和氮源的流加速度来控制酒精的含量(0.1%vol~0.5%vol)和溶氧量,同时通过酒精的含量来反馈调节碳源的流加速度。发酵过程中的pH用10%稀硫酸和10%的碳酸钠来调节。
1.3.5 细胞生物量测定
取一定体积发酵液5 000 r/min,离心10 min,用去离子水洗涤2次并收集菌体,置于105 ℃烘干至质量恒定,精确称质量,减去离心管干质量即得到酵母的菌体干质量(dry cell weight,DCW)。
1.3.6 发酵液中酒精含量的测定
采用马丁仪微量测定法[18]:准确移取0.05 mol/L酸性重铬酸钾溶液10.0 mL 于球形接收器中,移取10.0 mL 0.06 g/L氢氧化钠溶液倒入隔离管中并加入1.0 mL发酵液,接好仪器加热蒸馏,以沸腾时开始记时,蒸馏5 min。停止后用少量蒸馏水冲洗连接管口,取下接收器迅速冷却至室温,将接收器中的液体全部收集到250 mL三角瓶中,加入2 mL碘化钾溶液及1 mL淀粉指示液,用1.0 mol/L硫代硫酸钠标准液滴定至绿色为终点。
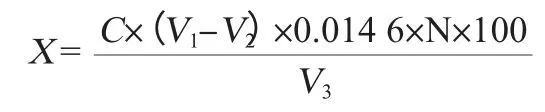
式中:X为乙醇含量,%vol;C为硫代硫酸钠标准溶液的浓度,mol/L;V1为空白试验消耗的硫代硫酸钠标准液量,mL;V2为试样消耗的硫代硫酸钠标准液量,mL;V3为加入马丁仪中的样品体积,mL;N 稀释倍数;常数0.014 6为1.00 mL 1.0 mol/L硫代硫酸钠标准液相当于乙醇的量。
1.3.7 谷胱甘肽的提取
取一定量的湿菌体于离心管中,加入适当的pH=3.0盐酸溶液,充分振荡至菌体细胞分散均匀并放置冰上处理5 min,再将其放在95~100 ℃下水浴5 min,然后迅速在冰上冷却,再取部分悬液12 000 r/min离心2 min,取离心后的上清液进行GSH的检测。
1.3.8 谷胱甘肽的液相色谱检测
采用LC-20AD液相色谱(HPLC)系统进行检测操作。色谱柱:Inertsi ODS-SP(150 mm×4.6 mm×5 μm);流动相:磷酸缓冲液与甲醇95∶5(V/V),其中磷酸盐缓冲液为50 mmol/L KH2PO4溶液,内含10 mmol/L庚烷磺酸钠,并用磷酸将缓冲液pH值调至3.0;检测波长:210 nm;UV检测器SPD-20A;流速1.0 mL/min;上样量20 μL。
2 结果与分析
2.1 pH和温度对γ-谷氨酰半胱氨酸合成酶酶活性的影响
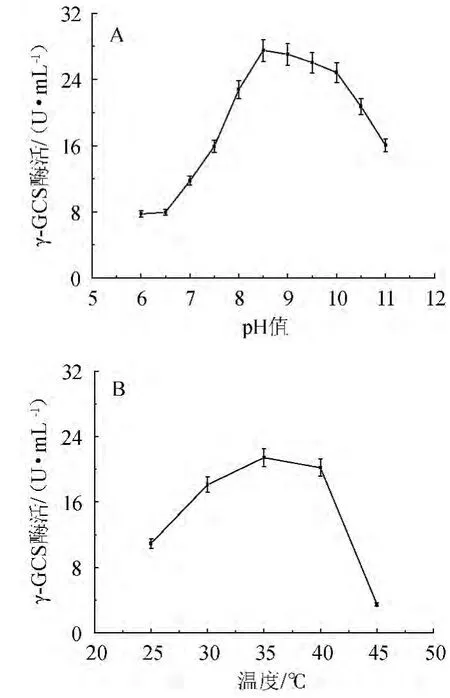
图1 pH(A)和温度(B)对γ-谷氨酰半胱氨酸合成酶酶活的影响Fig.1 Effect of pH (A) and temperature (B) on the activity of γ-GCS
对γ-GCS进行酶活分析,得到的结果如图1所示。由图1A可知,γ-GCS催化反应的最适pH为8.5左右,在pH 6.5~8.5的范围内增幅很大。由图1B可知,温度对于γ-GCS的影响是明显的,在25~35 ℃其酶活性逐渐增高,其酶活最适温度为35 ℃左右。
2.2 谷胱甘肽的液相色谱检测
GSH标准品HPLC检测结果如图2所示,酿酒酵母CCCG细胞提取的上清液HPLC检测结果如图3所示。
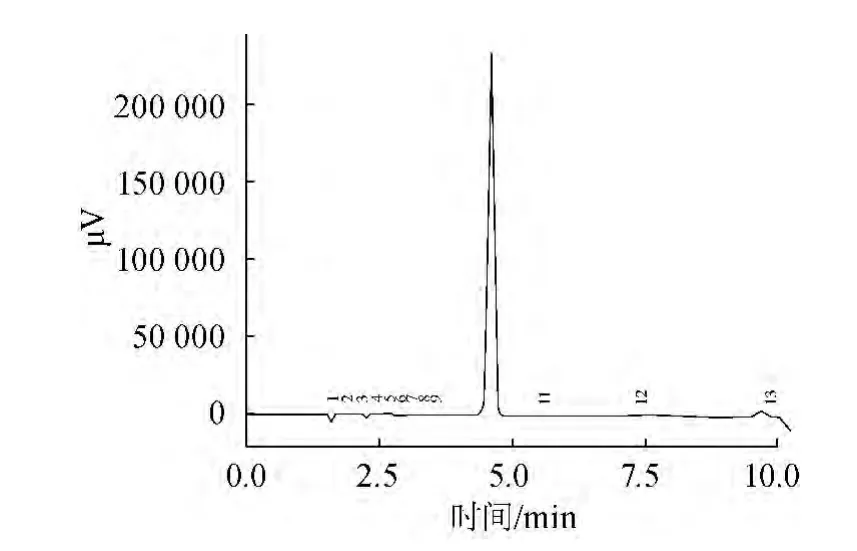
图2 GSH标准品HPLC检测结果Fig.2 HPLC result of standard GSH
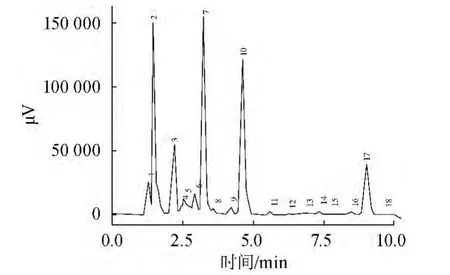
图3 酿酒酵母CCCG细胞提取的上清液HPLC检测结果Fig.3 HPLC result of the extract supernatant of Saccharomyces cerevisiae CCCG
由图2可知,标准GSH在HPLC检测下的保留时间为4.6 min。由图3可知,在4.6 min左右有明显的峰,与左右杂峰有很好的分离度,可以确定图3中10号峰为GSH特征峰,实验中所用HLPC方法可以检测出样酵母细胞抽提液中的GSH含量。
2.3 初始发酵条件下实验结果

图4 初始发酵条件下各控制参数的变化曲线Fig.4 Curve of all fermentation parameters in initial condition
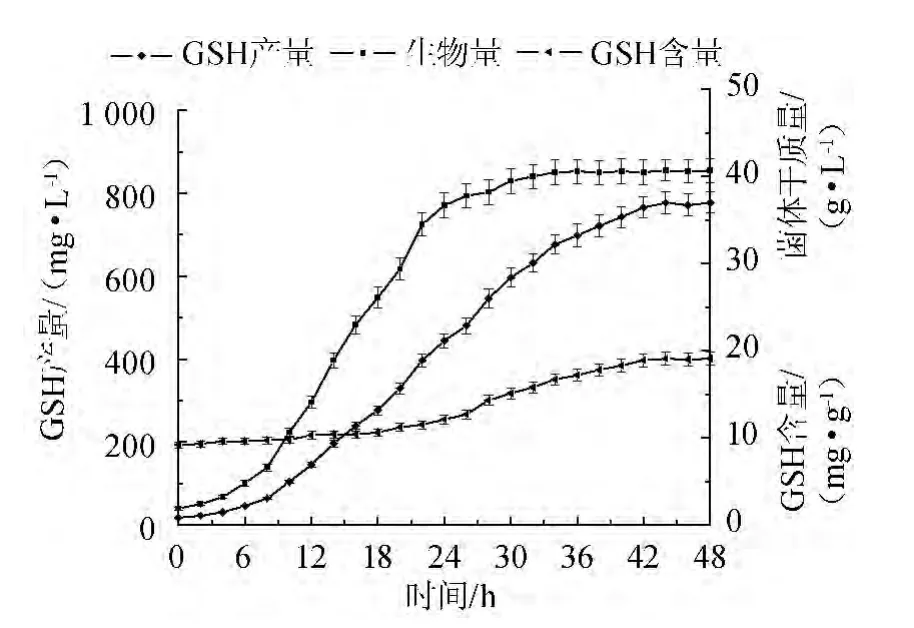
图5 初始发酵条件下菌体生物量、胞内GSH含量与GSH产量的变化曲线Fig.5 Curve of cell biomass,intracellular GSH content and GSH yield in initial condition
在初始条件下进行发酵,其过程中的各参数控制如图4所示。由图4可知,发酵温度控制在30 ℃恒定不变,其他参数可调节,发酵后期pH控制在4.5左右。整个过程中乙醇含量和溶氧量是限制性条件,控制发酵液中的乙醇含量在0.1%vol~0.5%vol范围内,溶氧量下降到最低点后调节相关参数至其在5%左右。对于碳源的流加,先流加糖蜜,再加葡萄糖。氮源的流加过程发酵一开始就进行至其加完。控制转速、通气量来调节发酵液中的乙醇含量及溶氧。结果表明,在8~24 h内是各参数变化最大的时间,这一阶段为菌体对数生长期,代谢旺盛。
图5为初始发酵条件下菌体生物量、胞内GSH含量与GSH产量的变情况。由图5可知,菌体生物量(干质量)在36 h达到最大,36~48 h内变化很小。而胞内GSH含量在42 h后才至达最大值,同时GSH产量也在这时候达到最高。发酵结束时,菌体生物量达到(40.70±1.31)g/L,胞内GSH含量为(19.10±0.36)mg/g,GSH产量为(777.37±18.57)mg/L。
2.4 在初始条件基础上进行发酵pH调节的实验结果
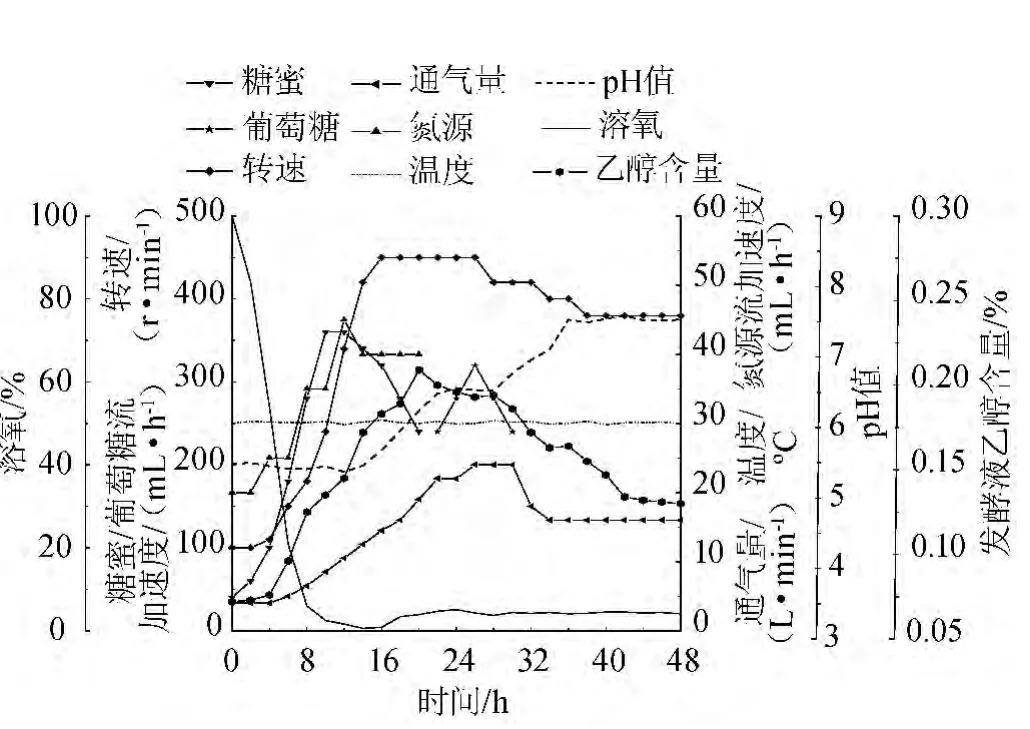
图6 pH调节下各控制参数的变化曲线Fig.6 Curve of all fermentation parameters under pH control

图7 pH调节下菌体生物量、胞内GSH含量与GSH产量的变化曲线Fig.7 Curve of cell biomass,intracellular GSH content and GSH yield under pH control
发酵过程中温度、溶氧及发酵液中的乙醇浓度维持在初始条件的范围内,进行发酵pH调节,发酵过程中各参数变化见图6所示。由图6可知,结合酶的最适pH值为8.0及其酶活在pH 6.5~8.5的范围内增幅很大,同时也考虑到酿酒酵母生长适合的pH 范围在4.0~6.0之间,发酵过程中0~24 h 内pH 维持在5.5~6.5之间,并在16~24 h逐渐调节到6.5左右,pH的调节可以通过流加碱液、碳源/氮源流加速度等来调节。图7为发酵结束后菌体生物量、胞内GSH含量与GSH产量的变情况。由图7可知,菌体生物量(干质量)在38 h达到最大,38~48 h内变化很小。而胞内GSH含量在36 h就达到最大值,同时GSH产量也在这时候达到最高。发酵结束时,菌体生物量达到(44.80±1.20)g/L,胞内GSH含量为(19.74±0.51)mg/g,GSH产量为(884.35±27.30)mg/L。与初始条件相比较,胞内GSH含量有些增高但变化不大,提高了3.35%,但GSH生物量及胞内GSH含量到达最大值的时间大大缩短,生物量增高了10.07%,最终GSH产量增高了13.76%。
2.5 在初始条件基础上进行发酵温度调节的实验结果
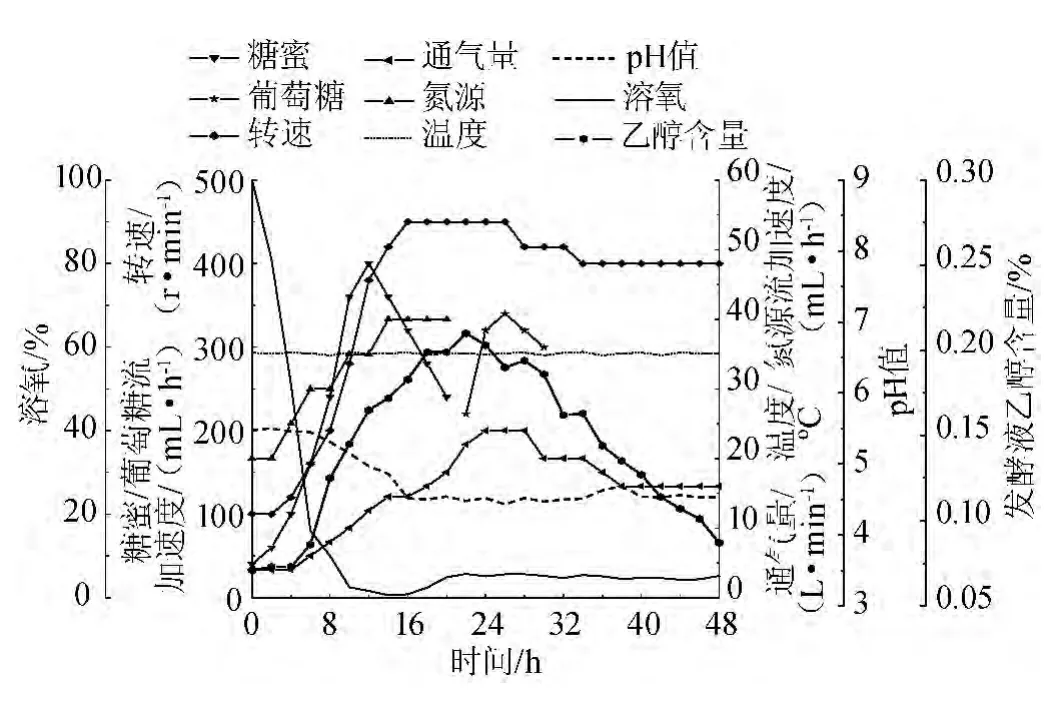
图8 温度调节下各控制参数的变化曲线Fig.8 Curve of all fermentation parameters under temperature control
在初始条件的基础上进行温度优化实验,其他参数pH值、发酵液中乙醇含量、溶氧控制在初始条件的范围内,整个过程通过调节碳源/氮源的流加速度、通气量、转速等来维持,实验中各参数变化情况如图8所示。由图8可知,结合酶的最适温度在35 ℃左右,当温度在35 ℃左右时γ-GCS酶的酶活达到最高,GSH合成第一步反应中获得γ-谷氨酰半胱氨酸量更多,经二步反应后最终合成的GSH也更多。
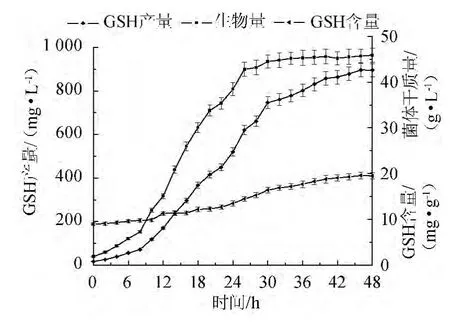
图9 温度调节下菌体生物量、胞内GSH含量与GSH产量的变化曲线Fig.9 Curve of cell biomass,intracellular GSH content and GSH yield under temperature control
图9为发酵48 h后菌体生物量、胞内GSH含量与GSH产量的变情况。由图9可知,菌体生物量(干质量)在34 h达到最大,34~48 h内变化很小。而胞内GSH含量在42 h后才达最大值,同时GSH产量也在此时达到最高。发酵结束时,菌体生物量达到(46.30±1.55)g/L,胞内GSH含量为(19.84±0.44)mg/g,GSH产量为(918.59±29.22)mg/L。与初始条件相比较,胞内GSH含量提高了3.87%,GSH生物量及胞内GSH含量到达最大值的时间也和初始条件一致,但生物量增高了13.70%,最终GSH产量增高了18.17%。
3 结论
本研究开始以工程菌表达的酿酒酵母γ-谷氨酰半胱氨酸合成酶为对象,对其酶活特性进行分析,得出γ-谷氨酰半胱氨酸合成酶在体外最适的pH值及温度。接着以γ-谷氨酰半胱氨酸合成酶的酶学特性为基础,在酿酒酵母补料分批发酵产GSH的过程中进行pH值控制及温度优化,补料分批培养过程中采用了同时控制碳源(葡萄糖、糖蜜)和氮源补加速度的流加方式,并在发酵过程严格监控发酵液中乙醇含量和溶氧。在初始条件的基础上经pH值优化后,GSH产量达到最大的周期明显缩短,胞内GSH的含量有一定提高,菌体生物量(干质量)和GSH产量有所提高。在温度后优化实验中,发现在温度对菌体生物量的影响明显,温度从30~35 ℃后,菌体生物量(干质量)明显提高,胞内GSH的含量也有一定提高,最终GSH产量有明显提高。综合pH值和温度控制优化的结果来看,pH值和温度不仅可以影响菌体的生物量,同样对胞内GSH含量有一定的提高,这与胞内γ-谷氨酰半胱氨酸合成酶的酶活特性有一致性。
[1]MEISTER A.Glutathione metabolism and its selective modification[J].J Biol Chem,1988,263(33):17205-17208.
[2]HENRY J F,ZHANG H Q,ALESSANDRA R.Glutathione:overview of its protective roles,measurement and biosynthesis[J].Mol Aspects Med,2009,30(1-2):1-12.
[3]PAUL G R,MEISTER A.Regulation ofγ-Glutamyl-Cysteine synthetase by nonallosteric feedback inhibition by glutathione[J].J Biol Chem,1975,250(4):1442-1426.
[4]TAKAHIRO S,AKI Y,TOSHIKAZU T,at el.Identification and characterization of genes involved in glutathione production in yeast[J].J Biosci Bioeng,2011,11(2):107-113.
[5]LI Y,WEI G Y,CHEN J.Glutathione:a review on biotechnological production[J].Appl Microbiol Biot,2004,66(3):233-242.
[6]WANG Z,ZHANG L Y,TAN T W.Efficient screening a high glutathione content mutant ofSaccharomyces cerevisiaeby flow cytometry[J].Process Biochem,2010,45(7):1168-1171.
[7]王小娟,卢美欢,王卫卫,等.高产谷胱甘肽菌株选育研究进展[J].中国酿造,2011,30(5):5-7.
[8]LUCIELEN O S,TATIANE A C,BEATRIZ T J,et al.Influence of culture conditions on glutathione production bySaccharomyces cerevisiae[J].Appl Microbiol Biot,2007,77(4):763-769.
[9]MANUELA R,MATILDE M.Influence of different fermentation parameters on glutathione volumetric productivity bySaccharomyces cerevisiae[J].Process Biochem,2006,41(7):1501-1505.
[10]周铭锋,黄 璠,张为巍,等.响应面法优化谷胱甘肽发酵培养基的研究[J].食品与发酵科技,2011,47(5):15-19.
[11]甘广东,刘清斌,吴建国,等.利用响应面法优化GSH 发酵培养基[J].中国酿造,2009,28(8):121-124.
[12]卫功元,李 寅,堵国成,等.产朊假丝酵母流加发酵生产谷胱甘肽[J].过程工程学报,2005,5(3):327-330.
[13]SHANG F,WANG Z,TAN T W.High-cell-density cultivation for co-production of ergosterol and glutathione bySaccharomyces cerevisiae[J].Appl Microbiol Biot,2008,77(6):1233-1240.
[14]ALIDA M,MATILDE M,MANUELA R.Post-fermentative production of glutathione by baker’yeast(Saccharomyces cerevisiae)in compressed and dried forms[J].N Biotechnol,2013,30(2):219-225.
[15]WANG Z,TAN T W,SONG J.Effect of amino acids addition and feedback control strategies on the high-cell-density cultivation ofSaccharomyces cerevisiaefor glutathione production[J].Process Biochem,2007,42(1):108-111.
[16]LIANG G B,LIAO X Y,DU G C,et al.A new strategy to enhance glutathione production by multiple H2O2-induced oxidative stress inCandida utilis[J].Bioresource Technol,2009,100(1):350-355.
[17]EKATERINA I,BITEROVA,JOSEPH J B.Structural basis for feedback and pharmacological inhibition ofSaccharomyces cerevisiaeglutamate cysteine ligase[J].J Biol Chem,2010,285(19):32700-32708.
[18]王洪臣,李建姝,刘洪洋,等.马丁仪微量测定醋酸发酵的酒精度[J].化学与生物工程,2008(2):25-28.
