浓厚味γ-谷氨酰肽研究进展、机遇与挑战
2022-05-25张宇昊
付 余,张宇昊
(西南大学食品科学学院 川渝共建特色食品重庆市重点实验室 重庆 400715)
流行病学研究表明,长期高钠盐饮食不仅会引发心血管疾病,还会引发肾结石、骨质疏松症、糖尿病等疾病[1]。目前,全球人均食盐摄入量远高于世界卫生组织(WHO)的人均推荐量(5 g/d),如美国人均每日食盐摄入量超过10 g,欧洲国家人均每日食盐摄入量为8~13 g[2],而我国人均每日食盐摄入量约为12 g,超出推荐量近1 倍。由此可见,减少膳食中钠盐的摄入,有助于降低全民潜在健康风险。食品工业上目前使用氯化钾、氯化钙等非钠盐部分替代氯化钠,易导致食品感官品质降低,而“减盐不减味”是减少膳食钠盐摄入的关键。一些食源性肽具有咸味增强作用,其本身没有咸味,当其与氯化钠共同摄入时能够增强味蕾对咸味的感知。有学者对一些咸味增强物质进行分离鉴定,发现γ-谷氨酰肽是其中关键组分之一。γ-谷氨酰肽是含有γ-谷氨酰残基的一类小分子肽[3],可用于增强食物的浓厚味(Kokumi)和持续性[4],并与食盐协同起到增咸、提鲜的效果[5],有望为食品工业减盐的实施提供全新的思路与策略。
虽然γ-谷氨酰肽因突出的呈味效果逐渐受到关注,但是在研究与应用过程中仍存在许多问题与挑战。在产物制备方面,γ-谷氨酰肽在自然界中分布广泛,在动物、植物、微生物中均有检出,然而,其含量或产率较低,且分布差异较大,如何经济、有效地富集或制备γ-谷氨酰肽,尚缺乏成熟方案。目前常采用一些蛋白酶,如γ-谷氨酰转肽酶、谷氨酰胺酶等催化制备γ-谷氨酰肽[6],然而,此方法受限于缺乏高特异性和高活性的食品级蛋白酶,生产效率较低,难以真正用于规模化的食品工业生产中。在呈味构效方面,γ-谷氨酰肽的浓度、阈值、C 端氨基酸残基与浓厚味的强、弱及呈味特性密切相关,而浓厚味与γ-谷氨酰肽的构效关系尚不明确[7],造成环境因素对γ-谷氨酰肽呈味的影响规律研究难以深入。在呈味机制方面,目前已证实γ-谷氨酰肽是钙敏感受体(CaSR)的变构激动剂,而γ-谷氨酰肽激活CaSR 过程中是否与咸味、鲜味受体之间存在一定的联系,且诱发浓厚味特性与细胞内外钙离子浓度的关系也尚不明确。在评价方法方面,当前浓厚味的评价方法主要包括感官评价法和CaSR 活性检测法等[8],仍缺少较为系统、客观的评价方法。例如,感官评价法主观性较强,单独使用难以实现浓厚味和增味效果的准确评估;CaSR 法主要利用γ-谷氨酰肽激活CaSR,而一些细胞表达CaSR 受体的能力有限,限制了该法的应用。
基于此,本文针对γ-谷氨酰肽的制备方法、呈味特性与钙敏感受体的结合机制、γ-谷氨酰肽的呈味影响因素以及浓厚味评价方法等方面进行综述,分析当前的机遇和挑战,并对未来的研究方向进行展望,旨在为食品工业中应用γ-谷氨酰肽进行减盐、增味提供理论参考。
1 γ-谷氨酰肽的制备
天然的γ-谷氨酰肽广泛存在于细菌、动植物及发酵食品中,而天然食物中的γ-谷氨酰肽含量较低,且分布差异较大。据报道,意大利鱼酱中γ-谷氨酰肽(γ-Glu-Val-Gly)的含量范围为0.4~12.6 mg/L,酱油中γ-谷氨酰肽的含量范围为1.5~6.1 mg/L,蓝纹奶酪中所有γ-谷氨酰肽的总量仅为3.59 mmol/kg[4]。由此可见,天然γ-谷氨酰肽因含量或产率低,无法满足工业化的需要,故定向合成方法成为制备浓厚味γ-谷氨酰肽的主要发展方向。目前,γ-谷氨酰肽的合成方法主要有生物合成法(如酶法、微生物发酵法等)和化学合成法。
1.1 酶法
酶法合成是利用酶的催化作用合成γ-谷氨酰肽。目前文献报道的具有合成γ-谷氨酰肽能力的蛋白酶主要包括谷氨酰转肽酶(GGT,EC 2.3.2.2)、谷氨酰胺酶(EC 3.5.1.2)和谷氨酰半胱氨酸合成酶(E.C.6.3.2.2)。
1.1.1 γ-谷氨酰转肽酶 γ-谷氨酰转肽酶(γ-Glutamyl transpeptidase,GGT)广泛存在于生物体内,是谷胱甘肽(GSH)代谢的关键酶之一,可催化3 种类型的反应:水解反应、转肽反应和自转肽反应(图1)。具体机制为:1)当亲核试剂为水分子时会发生水解反应,同时释放出游离的谷氨酸;2)如果受体为氨基酸或肽分子时,将发生转肽反应,生成γ-谷氨酰肽;3)当受体分子同时作为反应中的供体和受体时,将会发生自转肽反应。其中,转肽反应和自转肽反应都被证明可在体外高浓度的供体(游离谷氨酰胺)基质中发生,生成γ-谷氨酰肽[9]。

图1 GGT 催化反应机制Fig.1 The catalytic reaction mechanism of GGT
目前研究证实,GGT 可用于催化生成多种γ-谷氨酰肽[10]。杨娟[11]研究表明,GGT 的转肽反应最优条件为37 ℃、pH 10.0、反应时间3 h,最高产率88%。Lin 等[12]对GGT 的固定化进行研究,通过将地衣芽孢杆菌GGT 固定在石墨烯氧化物纳米片上合成γ-Glu-Phe 和γ-Glu-Leu,与未固定的谷氨酰胺转肽酶相比,固定化酶表现出明显更高的活性,并且产物的产率高于31%。由于谷氨酰胺转肽酶属于转移酶而不是合成酶,不消耗ATP 等能量化合物,具有较高的酶活性,因此该方法在食品工业中具有大规模生产γ-谷氨酰肽的应用前景。然而,目前食品工业仍缺乏食品级的高特异性、高活性的γ-谷氨酰胺转肽酶,利用合成生物学手段高效表达安全的GGT,是食品级γ-谷氨酰肽制备的发展方向之一。
1.1.2 谷氨酰胺酶 谷氨酰胺酶(Glutaminase)是一种能够合成γ-谷氨酰肽的重要酶制剂。与谷氨酰胺转肽酶不同的是谷氨酰胺酶是一种水解酶,它广泛分布于细菌、酵母菌和真菌等微生物中。除水解作用外,谷氨酰胺酶也具有一定的γ-谷氨酰基转移酶活性[13]。早在20世纪70年代,铜绿假单胞菌(P.Aeruginosa)[14]和大肠杆菌属(Escherichia coli)[15]来源的谷氨酰胺酶便被报道可催化γ-谷氨酰基供体与其它小分子物质结合生成γ-谷氨酰物质;硝基还原假单胞菌(P.nitroreducens)来源的谷氨酰胺酶也具有γ-谷氨酰基转移反应活性,在谷氨酰胺和羟胺的反应体系中,它能够催化形成γ-谷氨酰基异羟肟酸[16]。Tomita 等[17]研究表明米曲霉源谷氨酰胺酶的γ-谷氨酰转肽酶活性,并证实谷氨酰胺酶可以催化合成多种γ-谷氨酰肽,例如:γ-Glu-Gln、γ-Glu-Glu、γ-Glu-Ala、γ-Glu-Ser、γ-Glu-Phe、γ-Glu-Val、γ-Glu-Ile 和γ-Glu-Gly。近年来,也有不少学者通过研究更多微生物源谷氨酰胺酶合成多种γ-谷氨酰肽[18]。Yang等[19-20]利用从淀粉芽孢杆菌和米曲霉获得的谷氨酰胺酶合成了γ-[Glu](1≤n≤5)-Phe,并指出其最佳反应温度37 ℃,最佳pH 值为10,以及最佳反应时间3 h;研究还发现,从解淀粉芽孢杆菌中提取的一种谷氨酰胺酶也能催化转肽反应,它具有合成γ-[Glu](n=2,3,4)-Val 或γ-[Glu](n=2,3,4)-Met 的转肽酶活性。本研究团队利用谷氨酰胺酶分别催化秀珍菇蛋白肽和鸡骨蛋白肽合成γ-谷氨酰肽,研究发现通过优化反应条件来提升产率空间仍非常有限,最终产率仍较低(最高仅为39.38%),说明谷氨酰胺酶虽可用于生成γ-谷氨酰肽,但其底物特异性差且γ-谷氨酰基转移活性有限,很难真正用于规模化生产食品级γ-谷氨酰肽。
1.1.3 γ-谷氨酰半胱氨酸合成酶 γ-谷氨酰半胱氨酸合成酶(γ-Glutamyl cysteine synthetase)可催化合成一些γ-谷氨酰肽。Nakayama 等[21]报道从奇异变形杆菌中纯化的γ-谷氨酰半胱氨酸合成酶在30 ℃时可以合成含半胱氨酸的γ-谷氨酰肽,其中包括γ-Glu-Cys、γ-Glu-Abu、γ-Glu-Ser 和γ-Glu-Hse。然而,此合成酶在催化反应过程中需要消耗ATP,且产量受到ADP 和终产物的反馈抑制的影响[11],因此在γ-谷氨酰肽的制备中使用率不高。
1.2 微生物发酵法
微生物发酵法是在特定环境下,利用某些微生物代谢途径产生的蛋白酶来催化合成γ-谷氨酰肽的一种方法。Hasegawa 等[22]研究发现谷氨酸棒状杆菌发酵产生谷氨酸的过程中,在γ-谷氨酸转肽酶的催化作用下可以合成多种γ-谷氨酰肽。Sofyanovich 等[23]研究发现酿酒酵母除了可以产生GSH 外,还可以催化生成γ-Glu-Val 和γ-Glu-Val-Gly,其中γ-Glu-Val-Gly 是酵母多个重要生理代谢途径的共有产物,因此它能天然存在于酵母细胞中。Yan 等[24]探究了γ-谷氨酰半胱氨酸连接酶(GCL)在罗伊氏乳杆菌LTH5448 合成γ-谷氨酰二肽中的作用,发现罗伊氏乳杆菌中存在3个编码GCL 的基因,其中罗伊氏乳杆菌中的2 个基因能介导合成γ-Glu-Ile 和γ-Glu-Cys,并利用其合成具有浓厚味γ-谷氨酰肽的发酵剂培养物,从而改善发酵食品的风味。Yang 等[25]研究发现,在一些发酵食品中也存在罗伊氏乳杆菌中的GCL,可以催化合成具有独特浓厚味的γ-谷氨酰二肽(γ-Glu-Ile 和γ-Glu-Cys)。对于发酵类调味品,可以通过引入特定微生物菌种参与发酵,靶向提升产品中γ-谷氨酰肽含量,进而有助于开发富含γ-谷氨酰肽的低盐增味调味品。然而,从γ-谷氨酰肽制备的角度,尚缺乏以γ-谷氨酰肽制备为目的的发酵菌种及其发酵条件优化研究。目前主要使用诱变育种和基因工程手段提高GSH 的产率,虽然发酵效率有所提高,但是其产率最高也不超过20%。通过菌种改造获得γ-谷氨酰肽高产菌株,可能成为未来研究需要攻克的难题。
1.3 化学合成法
化学合成法是以氨基酸为原料,通过对活性基团进行保护或者屏蔽来实现目标产物的γ-谷氨酰基化,常用于合成高纯度的γ-谷氨酰肽。Amino 等[26]通过γ-谷氨酰基的N-α-苯氧羰基保护,以Glu、Val 和Gly 残基为主链依次缩合制备γ-Glu-Val-Gly,然而,该方法存在操作复杂,产物易产生消旋体,分离难度大,产率低,成本高等缺点,而且在制备过程中需要使用过量的偶联剂和酰化试剂,容易导致环境污染。这种方法不适用于食品级γ-谷氨酰肽工业化水平的大规模生产,然而,其可用于γ-谷氨酰肽的构效研究,为进一步阐明γ-谷氨酰肽呈味机理提供支撑。
2 γ-谷氨酰肽的呈味分子机制
γ-谷氨酰肽可以提高基本呈味物质的呈味强度,在食物中加入此类肽会增加食物的鲜咸味及浓厚味[27],然而,当γ-谷氨酰肽的添加量过高时又会引起浓厚味强度的减退[5]。随着对γ-谷氨酰肽呈味特性研究的深入,现已证实γ-谷氨酰肽的浓厚味受体为钙敏感受体(Calcium sensing receptor,CaSR),且浓厚味的味觉强度与其激活CaSR的能力呈正相关[28],因此从γ-谷氨酰肽与CaSR结合的角度,深入挖掘浓厚味的呈味机理,可为γ-谷氨酰肽的呈味分子机制研究提供理论参考。
2.1 γ-谷氨酰肽与CaSR 的结合机制
CaSR 是C 家族G 蛋白偶联受体(G-proteincoupled receptor,GPCR)的一种,属于细胞外氨基酸传感器家族。类似于其它C 类G 蛋白偶联受体,CaSR 识别配体的关键位点存在于一个大的N末端Venus Flytrap 结构域(VFT),此结构域由2个区域(LB1 和LB2)组成。此外,CaSR 还包含一个富含半胱氨酸的结构域(Cysteine-rich,CR),它将VFT 模块连接到跨膜区域,是受体激活所必需的途径[29]。L 型氨基酸以及γ-谷氨酰肽也都是通过与VFT 结合区域结合激活CaSR,并通过T145A/S170T 双突变体的共同机制发挥作用,可能占据受体VFT 结构域的重叠结合位点[30]。
2.2 信号传导机制
味觉受体细胞(Taste receptor cell,TRC)是味蕾的组成成分,主要分为4 种类型:Ⅰ、Ⅱ、Ⅲ和Ⅳ型(Ⅳ型细胞数量不足2%)。其中,Ⅱ型细胞中含有G 蛋白偶联受体T1Rs 和T2Rs,甜味、苦味和鲜味是由GPCRs 介导的,异二聚体受体T1Rs负责鲜味(T1R1/T1R3)和甜味(T1R2/T1R3),而T2Rs 是苦味味觉受体;CaSR 在Ⅱ、Ⅲ型2 种细胞中都有表达,且主要在Ⅲ型细胞中表达[31]。如图2所示,CaSR 主要在II 型细胞中与腔膜上的T2Rs共同表达,并对苦味(例如Ca2+或苯甲地那铵)和浓厚味(L-氨基酸或γ-谷氨酰胺)的转导发挥作用。具体而言,激活CaSR 同源二聚体或CaSR/T2R 异源二聚体,会促使通过磷脂酶(PLC)依赖性途径增加细胞内Ca2+浓度,最终促进细胞释放神经递质ATP 至细胞外[28],而CaSR 激动剂可直接激活表达在味觉受体细胞表面的CaSR,进而通过中枢神经系统(Central nervous system,CNS)反馈到大脑[27]。
鲜味物质谷氨酸钠和浓厚味物质GSH 可分别与II 型细胞膜上的T1Rs 和CaSR 结合,通过相似途径增强Ca2+的释放,提高细胞动作电位并促进ATP 的释放,以实现增强鲜味的效果。在III 型细胞中(图2),γ-谷氨酰肽激活顶端的CaSR 后,通过PLC 依赖的信号通路诱导细胞内Ca2+浓度的增加,同时III 型细胞内Ca2+浓度的增加与5-羟色胺(5-HT)的释放有关,而5-HT 会抑制II 型细胞中ATP 的释放,它们所产生的味觉信号互有影响。表达CaSR 的味觉受体细胞可以作为浓厚味的评价模型,在鲜味物质存在的情况下,γ-谷氨酰肽的鲜味增强作用是否依赖于CaSR 的激活而发生,目前尚不清楚,有待进一步研究[32]。
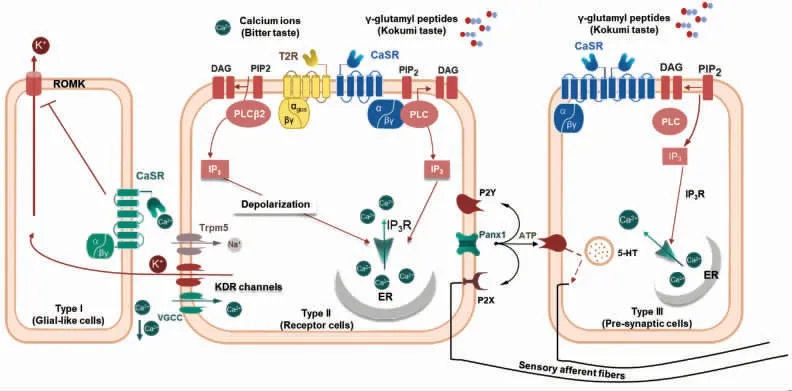
图2 CaSR 在味觉细胞中的作用途径[28]Fig.2 The role of CaSR in taste cells[28]
3 浓厚味γ-谷氨酰肽的呈味影响因素
γ-谷氨酰肽的浓厚味特性其实在很大程度上受不同因素的影响,如N 端氨基酸残基的差异会使γ-谷氨酰肽呈现出不同的浓厚味特性,浓度和pH 值等环境因素也会影响呈味效果。因此,原料来源、应用的食品体系以及γ-谷氨酰肽浓度阈值不同,均会造成浓厚味产生较大差异。本节针对影响γ-谷氨酰肽浓厚味的因素进行综述,为γ-谷氨酰肽在不同食品体系中的科学应用提供理论参考。
3.1 呈味构效
γ-谷氨酰肽的结构与其对CaSR 的激活能力密切相关,而γ-谷氨酰肽激活CaSR 的能力与浓厚味强度呈正相关[33]。明确γ-谷氨酰肽的呈味构效关系有助于厘清不同γ-谷氨酰肽的浓厚味呈味特点,进而筛选适合在不同食品体系中应用γ-谷氨酰肽。Amino 等[34]报道,具有以下结构特点的γ-谷氨酰肽能够有效激活CaSR:1)在N 末端存在1 个γ-L-谷氨酰残基;2)当第2 个残基为中等分子量,含有1~3 个C 或者含有2 个C 和1 个O 或S 原子的脂肪族中性取代基(如Val、Leu 等),并且为L 构型;3)第3 个残基的存在,特别是存在C末端的羧酸且没有侧链的残基(如Gly),将会呈现出较强CaSR 的激活能力,许多研究结果也证明了以上构效规律。Ohsu 等[27]研究表明,γ-Glu-Val-Gly、γ-Glu-Cys 和GSH(γ-Glu-Cys-Gly)均具有激活CaSR 的能力。此外,Amino 等[34]研究发现多种含硫氨基酸的γ-谷氨酰肽也具有激活CaSR 的能力,且具有较强的浓厚味。如表1所示,γ-L-谷氨酰-S-甲基-L-半胱氨酰甘氨酸的CaSR 激活能力,而该结构也满足上述对于表现强效的CaSR 激活能力的结构要求。相反,γ-L-谷氨酰-L-蛋氨酸、γ-L-谷氨酰-S-(正丙基)-L-半胱氨酸、γ-L-谷氨酰-S-(2-丙烯基)-L-半胱氨酸和γ-L-谷氨酰-S-(2-丙烯基)-L-半胱氨酸亚砜拥有分子量更大的侧链基团,然而,在CaSR 活性评价中未展现其活性。由此可以推测γ-谷氨酰肽和CaSR 相互结合以表达活性时,对于γ-谷氨酰肽的空间结构要求十分严格。Amino 等[35]还发现若将硫化物转化为极性官能团,如亚砜基团,会阻碍γ-谷氨酰肽和CaSR 的相互作用,并且发现α-L-谷氨酰肽不能激活CaSR 受体,进一步佐证了γ-L-谷氨酰残基对于呈现强效CaSR 激活能力的结构依赖性。

表1 含硫氨基酸的γ-谷氨酰肽的CaSR 激活能力[35]Table 1 CaSR activity of sulfur amino acid-containing γ-glutamyl peptides[35]
3.2 其它因素
γ-谷氨酰肽的结构决定其浓厚味的效果,不同食品体系下呈味物质组成、pH 值等因素会影响γ-谷氨酰肽对CaSR 的激活效果等,造成γ-谷氨酰肽在实际食品应用中呈现出的浓厚味不同。对于浓厚味γ-谷氨酰肽的产生,一些呈味物质具有协同作用,将γ-谷氨酰肽添加到如氯化钠、谷氨酸钠或鸡汤等风味基质中,γ-谷氨酰肽的浓厚味检测阈值显著降低,并且显著增强了风味基质的复杂口感、满口感和持续口感。Dunkel 等[36]通过感官评价法发现在鸡汤溶液中,γ-Glu-Leu、γ-Glu-Val、γ-Glu-Cys-β-Ala、γ-Glu-Cys-Gly 的浓厚味(复杂口感、满口感、延绵感)阈值分别为0.8,0.4,0.2,0.2 mmol/L,并发现γ-Glu-Cys-β-Ala 加入谷氨酸和氯化钠的混合溶液后,阈值下降约32倍,在加入低脂花生酱、低脂奶油冻中也会产生类似的效果[37]。此外,γ-谷氨酰肽加入基质的pH 值也会影响浓厚味的强度。Simone 等[38]利用感官评价法鉴定γ-谷氨酰肽在pH 值分别为4.7,5.7,6.7,7.7 时的浓厚味强度;当pH 值为6.7 时,γ-谷氨酰肽的浓厚味强度最强,当pH 值为5.7 时强度次之,然而,在较低pH 值(4.7)和较高的pH 值(7.7)下均未观察到明显的浓厚味,这表明γ-谷氨酰肽呈现的浓厚味强度强烈依赖于pH 值。由于γ-谷氨酰肽本身不具有基本味,只有在含有呈味物质的体系中才能体现出呈味效果,因此γ-谷氨酰肽呈现浓厚味的能力不仅受自身结构和浓度的影响,还与其应用的食品体系环境有关,环境因素对γ-谷氨酰肽呈味特性的影响规律有待进一步研究。
4 γ-谷氨酰肽浓厚味的评价方法
由于γ-谷氨酰肽不仅赋予食物醇厚、持续的味觉感受特性,还增强基本呈味物质的呈味强度,因此判断和评价浓厚味强度是研究γ-谷氨酰肽的必要前提。目前,评价γ-谷氨酰肽及其增味效果的方法主要有感官评价法、CaSR 法和电子舌法,如表2所示。加强对γ-谷氨酰肽的浓厚味的评价研究并制定科学有效的评价方法,对于γ-谷氨酰肽的高效制备及食品工业化生产具有重要意义。

表2 浓厚味γ-谷氨酰肽及其增味效果的评价方法Table 2 Methods for assessing kokumi γ-glutamyl peptides and their taste-enhancing effects
4.1 感官评价法
感官评价是通过视觉、嗅觉、触觉、味觉和听觉感知来测定和分析待测样品的分析方法[39],是一种常见的评定γ-谷氨酰肽赋予食物浓厚味的方法。早在1997年,Ueda 等[40]首次提出γ-谷氨酰肽——GSH 的感官评价方法,他们测定了水和鲜味溶液中GSH 的阈值及其对基本味觉(酸、甜、苦、咸、鲜)的调节能力。随后,该法又经研究学者的补充和完善,被广泛应用于浓厚味物质的评价中。
评价过程如下[41]:1)感官鉴评训练,通过让感官鉴评人员品尝一系列代表酸、甜、苦、咸、鲜和浓厚味的基础溶液,使他们对这些味觉具有准确的认识,并用描述性语言进行表达。2)鉴评试验,将不同浓度的待测物质溶解于含有2 种以上的呈味物质体系中(可采用空白鸡汤或肉汤),让鉴评人员品尝并通过评分法(0~10 分依次表示味觉强度从无到非常强烈),从酸、甜、苦、咸、鲜和浓厚味等方面对待测样品进行打分。3)汇总品尝相同溶液鉴评人员的结果并采用统计学方法进行分析,给出描述性感官评价结果。
探究γ-谷氨酰肽的阈值浓度也可采用感官评价法。味觉阈值浓度主要通过味觉浓度或稀释分析的三角形试验来确定[10]。感官评鉴小组需在其它2 个空白样品之外正确识别出待测样品,并以评鉴人员能够区分该差异的最小浓度作为待测物质的味觉阈值。例如,Liu 等[42]利用该法测定γ-Glu-Val-Gly 的味觉识别阈值浓度为1.55 μmol/L。此外,一些研究学者也通过感官评价法来评价γ-谷氨酰肽基础味的调节能力,即在基础味溶液中考察额外添加的浓厚味肽改变基础味的强度(例如氯化钠溶液中的咸味)[43]。
4.2 CaSR 法
目前,常用卵母细胞或人胚肾细胞HEK-293作为CaSR 受体细胞模型来评估γ-谷氨酰肽的受体激活情况。Amino 等[34]采用卵母细胞进行评价的方法如下:从非洲爪蟾(Xenopus laevis)卵巢中制备卵母细胞,然后将人源CaSR 的互补RNA(cRNA)转导至卵母细胞中。当卵母细胞中表达的CaSR 被激活时,会导致细胞间Ca2+增加,激活内源性钙离子依赖性Na+通道并产生电流。在含有CaSR 激活剂的缓冲液中培养卵母细胞时,可通过细胞两极的电流来表征激活剂的激活效果,记录的电流峰值与CaSR 被激活的强度相关[34]。HEK-293 细胞法则将人源CaSR 的cDNA 构建于表达载体pcDNA3.1 上,并迅速转染到HEK-293 细胞中,在含有待测物质的培养基中培养后,用钙离子指示剂或钙离子染料染色。当HEK-293 细胞中表达的CaSR 被激活后,细胞间Ca2+浓度会增加,此时,钙离子染料会与游离的Ca2+结合,从而导致染料荧光强度增加,因此可通过检测荧光强度评估各种待测样品的CaSR 激活能力及其浓度依赖性[27]。Broadhead 等[30]在表达CaSR 的HEK-293 细胞中评价了γ-谷氨酰肽对钙离子依赖的细胞内的钙调动的影响,研究发现S-甲基谷胱甘肽、谷胱甘肽(γ-Glu-Cys-Gly)、γ-L-谷酰基-L-丙氨酸(γ-Glu-Ala)和γ-L-谷酰基-L-半胱氨酸(γ-Glu-Cys)都是非常有效的CaSR 正变构调节剂,可以显著促进钙离子依赖的钙调动,它们的EC50值分别为1.7,3.9,4.7,4.8 μmol/L,且促进钙激活的能力排序为S-甲基谷胱甘肽>γ-Glu-Cys-Gly>γ-Glu-Ala>γ-Glu-Cys。该结果再次表明γ-谷氨酰肽的结构、肽序列及肽链长度对CaSR 的激活能力以及浓厚味强度都有影响,然而,其确切的构效关系有待进一步阐明。
与感官评定法相比,CaSR 法的时间和人力消耗少,由于CaSR 法基于细胞实验,此方法不需要对检测样本设定严格的食品级原料要求,因此比较适用于大规模检测。然而,CaSR 法的结果需进一步通过感官评定法验证。由于许多CaSR 激活剂并不是浓厚味物质[32],并且细胞有限的表达能力和复杂的细胞培养环境都对CaSR 法的大规模应用形成限制[7],因此,目前CaSR 法一般用于对待测物质的初步筛选[41]。
4.3 电子舌
电子舌(Electronic tongue)是通过模仿人体味觉机理制成的新型分析仪器,目前被广泛应用于食品、调味品、中药及中成药等领域。与人工的感官评价相比,电子舌更客观、灵敏、不易疲劳,可同时用于多种样本的测定。然而,对于浓厚味这种特征性味道,其复杂的呈味特性超出了电子舌检测的能力。目前,主要使用电子舌结合人工感官方法评价厚味肽对于基础溶液的增咸、增鲜效果。Yan等[44]对具有浓厚味的豌豆蛋白肽进行电子舌及感官分析,发现在0.5%NaCl 溶液中加入肽产物后,咸度及鲜味响应值均显著增加,说明这些小肽不仅具有浓厚感特征的醇厚、圆润的感觉,还可能对咸味和鲜味起到增强作用。Zhang 等[45]也利用电子舌、人工感官等方法对河豚中的关键味觉活性成分通过味觉重构、遗漏和添加试验确定其中的关键物质,发现两种味觉活性肽Pro-Val-Ala-Arg-Met-CysArg(PR-7)和Tyr-Gly-Gly-Thr-Pro-Pro-Phe-Val(YV-8) 是引起典型浓厚味的关键化合物,并在接近中性pH(6.5~8.0)时,具有显著鲜味增强作用[46]。除此之外,有学者通过感官分析和电子舌技术验证了典型的浓厚味γ-谷氨酰肽的鲜味增强作用[47-48]。综上所述,感官评价法、CaSR 法和电子舌可为浓厚味的特征和定量测定提供一定评价依据,然而,每种方法单独用于浓厚味评价都不足以获得有说服力的结论,尚需采用几种方法联合评价,方能得到相对客观的结果。
5 挑战与展望
目前,高钠盐摄入是我国居民膳食方面潜在风险之一。γ-谷氨酰肽不仅能够增强食品的呈味强度,具有潜在的生理调节功能,而且在工业化食品减盐领域具有广阔的应用前景。然而,目前γ-谷氨酰肽的研究还存在如下挑战:
1)目前酶法制备γ-谷氨酰肽的生物酶制剂主要有谷氨酰胺酶和谷氨酰转肽酶,然而,由于谷氨酰胺酶受体的转移活性较低,难以用于γ-谷氨酰肽的工业化生产;谷氨酰转肽酶催化合成γ-谷氨酰肽还处于实验室水平,具有高产量的优良菌株还有待开发。可以结合酶工程修饰与改造技术建立高效表达的酶制剂,并结合固定化酶技术,增强其特有的催化作用及回收率,筛选出高活性的谷氨酰转肽酶,为实现食品领域中γ-谷氨酰肽低成本、高产量的工业化生产提供前期基础。
2)除γ-谷氨酰肽外,CaSR 还有其它已知的激动剂,例如:乳酸钙、鱼精蛋白、聚赖氨酸和L-组氨酸,也可赋予食品浓厚味。然而,目前几乎未见γ-谷氨酰肽与其它CaSR 激动剂之间协同作用的研究。未来研究可以探究不同CaSR 激动剂结合所产生的协同作用,为浓厚味食品更高效、高质的生产提供新思路。
3)γ-谷氨酰肽不仅赋予食物浓厚味,还增强基本呈味物质的鲜、咸味强度。γ-谷氨酰肽与钙敏感受体相互作用产生浓厚味的同时,与II、III 型TRC 产生的味觉信号互有影响,这些细胞间的信号交流是否影响鲜味与咸味,目前尚不清楚。通过γ-谷氨酰肽的计算机模拟分析,根据同源性建模、分子动力学等策略,可从分子层面阐明呈味机制及其与呈味物质的相互作用。
4)γ-谷氨酰肽的浓厚味强度随肽链长度的增加而降低,浓厚味γ-谷氨酰肽大多是由2~5 个氨基酸组成的小肽,而C 端氨基酸残基不同的γ-谷氨酰肽,其呈味特性和浓厚味味觉阈值也存在差异。目前γ-谷氨酰肽的构效关系尚不明确,进一步加强γ-谷氨酰肽构效方面的研究,可为新型γ-谷氨酰肽的设计、制备提供思路。
5)目前检测浓厚感的方法复杂繁琐,且客观性和准确性不足,很难做到对浓厚感强度的精准定量评价。利用感官评价法、分子对接技术及CaSR 活性检测法3 种方法联合评价γ-谷氨酰肽与CaSR 受体的相互作用,有望实现γ-谷氨酰肽的准确评价和筛选。
6 结论
作为一种新型的呈味肽,γ-谷氨酰肽逐渐受到关注。γ-谷氨酰肽赋予食物浓厚味并增强基本呈味物质的呈味强度,尤其是在减少食盐用量的情况下起到增咸、提鲜的效果,有望作为食品工业减盐的全新原料。目前人工制备γ-谷氨酰肽主要通过谷氨酰转肽酶和谷氨酰胺酶进行酶法催化合成。检测γ-谷氨酰肽的浓厚味主要使用感官评价法和CaSR 活性检测法,其呈味能力与其呈味阈值、样品中的浓度和γ-谷氨酰肽的空间结构有较大关系。至今,我国对γ-谷氨酰肽的研究开发仍处于初步阶段,还需加强对γ-谷氨酰肽的制备方法、呈味机制、构效关系及呈味评价等方面的研究。
致谢:
感谢安琪酵母股份有限公司刘政芳对本文的帮助和建议。
