产纤维素酶里氏木霉的研究进展
2014-04-24陈介南闫兴伟
王 芳,陈介南*,张 林,闫兴伟,刘 娜
(中南林业科技大学 国家林业局生物乙醇研究中心,生物环境科学与技术研究所,湖南 长沙 410004)
随着世界人口迅速增长以及化石燃料由短缺变枯竭,能源危机问题成为人类面临的最主要挑战。寻找廉价的、不污染环境的可再生新能量来源日益成为人们关注的焦点。生物质资源与化石燃料不同,其属于可再生性资源。生物质最主要来源于绿色植物,地球上每年光合作用可产生高达150~200亿t的植物干物质,其中一半以上是木质纤维素类生物质[1]。纤维素的基本结构单位是纤维二糖,由D-葡萄糖分子以β-1,4糖苷键组成的大分子多糖。由于纤维素结构简单、含量丰富且具有可生物降解性的特点,如果能通过生物转化技术把地球上的纤维素和半纤维素转化成单糖,对于缓解世界能源危机及固体废弃物资源化具有不可估量的价值[2]。
纤维素酶在转化纤维素和半纤维素方面起着决定性的作用。自然界中能生产纤维素酶的微生物种类很多,但是大多数由于产纤维素酶能力低且酶系组分不完全,限制了其在工业上的应用。其中,里氏木霉由于产量高及其安全无毒性成为主要的纤维素酶生产菌株之一。从20世纪90年代初开始,国内外就开始利用里氏木霉产纤维素酶,并对产酶的工艺条件开始进行摸索。近年来,人类通过诱变选育、基因工程、原生质体融合等菌种选育方法,在纤维素酶的生产方面取得了较为突出的进展[3-5]。
1 里氏木霉及其纤维素酶
1.1 纤维素酶
纤维素酶是指降解纤维素的一组酶的总称,其不是单个酶,而是起协同作用的多组分复合酶系。纤维素酶主要由3种酶组成:内切型-β-葡聚糖酶(EC3.2.1.4),外切型-β-葡聚糖酶(EC3.2.1.91,也称纤维二糖水解酶)和纤维二糖酶(EC3.2.1.21,也称β-葡萄糖苷酶)[6]。纤维素酶特异性高,反应条件简单,降解过程中不会污染环境等,是将纤维素和半纤维素转化成葡萄糖的关键。
纤维素酶和一般酶反应不一样,其主要区别在于纤维素酶是多组分酶系。在水解纤维素为葡萄糖的过程中,必须依靠不同组分之间的协同作用才能完成。其作用机理如图1所示[7]。大分子首先在内切葡聚糖酶的作用下产生新的游离末端,然后由外切葡聚糖酶在新产生的还原端或非还原外切纤维素链,生成纤维素二糖(或葡萄糖),再由β-葡萄糖苷酶水解纤维二糖生成两个葡萄糖。
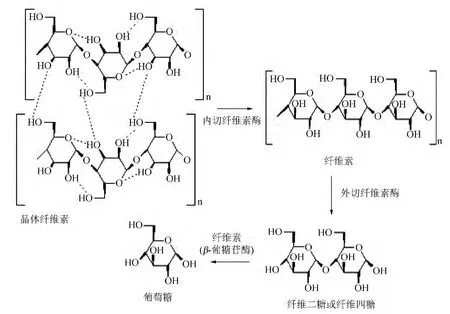
图1 纤维素酶作用机制Fig.1 Action mechanism of cellulose enzyme
目前,纤维素酶的产酶菌株的活力还不是很高,致使其生产成本过高,限制了其进一步的应用。所以,酶解成本过高是制约纤维素转化为生物乙醇的主要障碍,其占总生产成本的比例很大,只有将酶的成本降低,生物乙醇才有可能与石油竞争。纤维素酶的生产是成功的酶促转化纤维素生物质为生物乙醇的重要因素之一。因此,选育出高产纤维素酶且酶活性稳定的产酶菌株至关重要。
1.2 产纤维素酶的主要微生物
产纤维素酶的微生物包括真菌、细菌和放线菌。不同微生物生产的纤维素酶的各组分比例有着显著差异,且降解纤维素的能力也各不相同。其中,虽然放线菌比真菌耐受高温和酸碱,但由于生长繁殖慢且纤维素酶的产量低,研究较少[8]。另外,细菌的酶产量也不高,且以内切酶为主,大多数酶对结晶纤维素没有活性,所生产的纤维素酶是胞内酶或吸附于细胞壁上,分离纯化难度大,限制了其在工业上的应用。
而在丝状真菌中,产酶活力较强的菌种为木霉属(Trichoderma)、曲霉属(Aspergillus)、青霉属(Penicillium)和镰孢菌属(Fusarium)。其中最著名的是里氏木霉(Trichoderma reesei),其在生产纤维素酶方面具有很多优点[9],如生长环境粗放,便于控制和培养;稳定性好,不易退化;产纤维素酶活力高;生产的纤维素酶为胞外酶,易于分离纯化;且安全无毒,无污染。另外,里氏木霉生产的纤维素酶系各组分结构较为合理,包括5个内切酶EGⅠ、EGⅡ、EGⅢ、EGⅣ和EGⅤ(60%~80%),两个外切酶CBHⅠ、CBHⅡ(20%~36%)以及两种β-葡萄糖苷酶BGⅠ和BGⅡ(1%),能更有效的水解转化纤维素为葡萄糖。因此,里氏木霉被公认为是目前最具有工业应用价值的纤维素酶生产菌株。
1.3 里氏木霉的生产工艺
里氏木霉的生产工艺可以分为固态发酵和液态深层发酵。固态发酵是以小麦、甘蔗等农作物的秸杆为原料,类似于自然状态下真菌的生长条件,其优点是纤维素酶系完全,有利于降解天然纤维素;投入成本低,操作工艺简单。缺点是生产的纤维素酶很难提纯,生产效率低,容易污染,劳动强度大,不适合大规模生产。史通等[10]对里氏木霉RUT-C30与黑曲霉NL02固态混合发酵产酶进行了研究,经过优化后β-葡萄糖苷酶活力达到132.45 IU/g。
液态深层发酵是在通气搅拌式发酵罐中进行,里氏木霉在产酶过程中受到著多因素的影响,一般可以通过控制培养基中的营养成分比例、碳氮源、pH值、培养时间、温度、含水量、诱导剂、表面活性剂及溶氧水平等因素进行优化。液态深层发酵的缺点是技术水平先进,难度大;投资设备大,成本高。优点是原料利用率高,产量好;发酵条件易于控制,不易污染;机械自动化程度高,可大规模生产;从而成为近年来研究的主要培养方式。据相关文献报道,里氏木霉液态深层发酵生产的纤维素酶中滤纸酶活多数稳定在10 U/mL左右。王涫等[11]对里氏木霉FST-1的产酶培养基及条件进行优化,滤纸酶活力达到13.0 U/mL。张晓月等[12]研究了发酵培养基对里氏木酶RUT-C30产纤维素酶活力的影响,结果表明,滤纸酶活力达到9.13 IU/mL,较之前提高了72.26%。AHAMED A等[13]研究了机械搅拌对里氏木霉RUT-C30在发酵罐中生产纤维素酶活力的影响,研究结果表明,没有机械搅拌产酶效果较好,滤纸酶活力(filter paper activity,FPA)达到17U/mL,羧甲基纤维素酶(carboxymethyl cellulase,CMCA)活力达到11.8 U/mL。
2 产纤维素酶里氏木霉菌株的选育
虽然里氏木霉生产的内切葡聚糖酶和外切葡聚糖酶的活性较高,但也存在一些缺点,如生产的纤维素酶表现出较低的β-葡萄糖苷酶的活性,会导致纤维二糖的积累,而纤维二糖的积累对内切葡聚糖酶和外切葡聚糖酶具有很强的反馈抑制作用,从而导致纤维素的糖化效率不高[14]。为了克服里氏木霉的这些不足,提高纤维素酶的各组分酶活以及防止菌种退化,采用的适当菌种选育方法改良菌种的遗传是很有必要的。常用的菌种选育方法有自然育种、诱变育种、基因工程育种、原生质体融合育种、纤维素酶的分子改造等。
2.1 自然育种
自然诱变是指对微生物细胞群体不经过人工处理而直接进行筛选的育种方法,是一种简单易行的育种方法。缺点是微生物的自然突变率很低,难以提高菌株的产酶水平。李荣杰[15]从土壤中筛选出一株酶活较高的里氏木霉FYFJ928,其发酵水平经优化后可达到15.6 IU/mL。孙海彦等[16]从热带雨林土壤中分离纤维素酶高产菌,经鉴定为里氏木霉,其FPA活力达到5.8 U/mL,CMCA活力达到10.2 U/mL。AKINOLA G E等[17]从土壤中通过平板筛选出6株纤维素酶产量较高的木霉属菌株,并对产酶条件进行了优化。结果表明,里氏木霉生产的纤维素酶滤纸酶活和β-葡萄糖苷酶活最高。
2.2 诱变育种
诱变育种是选育出高产纤维素酶突变菌株的一种简单高效的方法,它能够使菌株的突变频率比自然突变提高几百倍至几千倍,从而大幅度改善菌种特性。优点是效果好、操作简单、条件和设备要求较低。缺点是突变不定向,具有盲目性。诱变育种可分为物理诱变、化学诱变和复合交替诱变。
2.2.1 物理诱变
物理诱变常用的诱变剂种类很多。有非电离辐射类的紫外线、激光和离子束等,及能够引起电离辐射的X射线、α射线、β射线、γ射线、快中子等[18]。
非电离辐射中紫外线由于其操作简单、成本低、效果好等优点,是微生物育种中应用广泛的有效诱变剂之一。傅力等[19]对里氏木霉DWC原生质体进行紫外诱变,得到突变菌株DWC5,其CMCA、FPA分别达到820.4 mg/(mL·h)和23.2 mg/(mL·h),为工业生产中提高纤维素的生物转化率提供实验依据。IKE M等[20]以里氏木霉ATCC66589为出发菌株,经紫外线诱变,获得两株突变菌株M2-1和M3-1,其滤纸酶活分别达到257 U和281 U。张素敏等[21]利用紫外线诱变里氏木霉T306,得到突变菌株的CMCA活力达到64.2 U/mL。
另外,低能离子注入法作为一种新型的生物诱变手段,具有损伤轻、突变率高、突变谱广等优点。张宁等[22]利用氮离子注入技术对里氏木霉进行诱变选育,研究表明,在注入剂量为250×1014N+/cm2的条件下得到突变幅度较大菌株,获得3株纤维素酶高产突变菌150-1、150-2、250-6,其平均酶活力较出发菌株增加了24.3%,建立了纤维素酶高产菌株的快速筛选方法,并为研究氮离子束的诱导机理提供依据。
电离辐射中,质子束照射与X射线、γ射线和电子束相比较,由于其局部高能量的特性已经成为一个新的突变方法。JUNG Y R等[23]质子数照射诱变里氏木霉KCTC6950,得到突变体菌株T-2(MT-2),其滤纸酶的活性增加了65%,CMCA活性增长了46%,β-葡萄糖苷酶的活性增加了213%。
2.2.2 化学诱变
在化学诱变剂中,主要有烷化剂、核酸碱基类似物和吖啶化合物。其中烷化剂可与巯基、氨基和羧基等直接反应,故更易诱发基因突变。最常用的烷化剂有亚硝基乙基脲烷(nitroso ethyl urea alkanes,NEU)、亚硝基胍(nitrosoguanidine,NTG)、甲基磺酸乙酯(ethylmethane sulfonate,EMS)、硫酸二乙酯(diethyl sulfate,DES)等。DURAND H等[24]分别用亚硝基胍(NTG)、甲基磺酸乙酯(EMS)、亚硝酸钠诱变里氏木霉QM9414,最终,在NTG的诱导下得到一株稳定性较好的突变菌株CL847,FPA酶活最高达到5.2 U/mL,较出发菌株提高了4倍。
2.2.3 复合交替诱变
单一诱变往往具有很多缺点,如突变不定向,效率低及易发生回复突变等。针对这一问题,很多学者把研究的热点放到了复合交替诱变上。复合交替诱变是指利用两种或两种以上的诱变剂对微生物以复合交替处理的方式进行诱变。因不同诱变剂的作用机理不同,相应的对微生物的诱变效应也不相同。所以如果诱变剂搭配合理,复合交替诱变更易得到理想突变株。
GADGIL N J等[25]利用紫外线和亚硝酸钠对里氏木霉QM9414进行复合交替诱变,突变株较出发菌株滤纸酶活提高至1.5倍,CMCA活力提高至1.8倍,β-葡萄糖苷酶活提高至1.06倍。HAO X C等[26]通过N-甲基-N'-硝基-N-亚硝基胍和紫外线诱变得到突变菌株里氏木霉WX-112,并用响应面法优化产酶培养基,滤纸酶活提高至10.6 IU/mL。HE J等[27]利用N-甲基-N'-硝基-N-亚硝基胍和紫外线两种诱变剂先后诱导里氏木霉RUT-C30,得到突变菌株NU-6,其滤纸酶活、CMCA活力及β-葡萄糖苷酶活分别达到6.2 U/mL、54.2 U/mL、0.39 U/mL。张晓烜等[28]对里氏木霉40359进行紫外线、亚硝酸钠、硫酸二乙酯诱变,得到一株稳定性较好的菌株YB40359,FPA酶活达到57.31 U/mL,提高了87.12%;CMCA活力达到142.60 U/mL,提高了58.66%。这些研究对里氏木霉高产纤维素酶菌株的选育及其工业化应用具有显著意义。
2.3 基因工程育种
基因重组技术又称为遗传工程,是指在体外通过人工剪接,将不同来源的DNA分子组成一个杂合DNA分子(DNA分子重组体),然后导入宿主细胞去复制扩增或表达[29]。可以从不同产纤维素酶菌株中筛选出比活力高、酶学性质稳定的基因重组在一起并高效表达,具有定向性,是选育出高产纤维素酶菌株的有效途径。表1列出了已成功在里氏木霉中克隆表达的基因。

表1 已成功在里氏木霉中克隆表达的基因Table 1 Successfully expressed gene in the cloning of Trichoderma reesei
2.4 原生质体融合育种
原生质体融合技术是指用自然或人为的方法,使遗传性状不同的两个细胞的原生质体融合在一起,以期获得兼有双亲遗传性状稳定的重组子。它具有杂交频率高、重组体种类多及遗传物质传递的更为完整等优点[35],但它的遗传稳定性还需要研究。里氏木霉具有较高的内切和外切葡聚糖酶活性,而黑曲霉有较高的β-葡萄糖苷酶活性,为了选育出更好的纤维素酶生产菌,可将里氏木霉和黑曲霉进行原生质体融合,筛选到具有这两属优点的融合子。EI-BONDKLY A M等[36]将木霉属与黑曲霉通过原生质体融合技术融合。其中,里氏木霉NRRL 18670与黑曲霉NRRL 599融合获得的融合子(1/5)滤纸酶活,CMCA、β-葡萄糖苷酶活相较于黑曲霉分别提高了200%、212.5%、66.7%。原生质体融合在获得高产纤维素酶菌株方面具有广阔的发展前景。
2.5 纤维素酶的分子改造
纤维素酶在很多领域广泛应用,不同的行业由于目的不同所要求的酶学性质也不相同。如有些生物工艺要求纤维素酶耐高温,而另外有些则要求纤维素酶耐碱性或耐酸性。而真菌生产的天然纤维素酶还不能满足人们的实践要求,因此对纤维素酶进行有目的的分子改造很有必要[37]。ZHANG J W等[38]对里氏木霉RUT C30的β-葡萄糖苷酶基因BGLⅠ进行改造,获得3个转化子B2、B12、B15,其中β-葡萄糖苷酶活力最高达到5.90 IU/mg,提高到出发菌株的3.7倍;滤纸酶活最高达到1.42 IU/mg,提高到出发菌株2.29倍。
3 应用和前景展望
目前,里氏木霉生产的纤维素酶在食品加工、酿造、饲料、医药、纺织、造纸工业等各个领域都有重要的用途[39]。在食品加工工业中[40],用纤维素酶对农产品进行预处理相较于传统的加热蒸煮或酸碱处理有很多优点,如使植物组织膨化松软,减少农产品香味和营养物质的损失,改善口感,更利于消化,节约处理时间等。另外,纤维素酶也应用于发酵和酿造等工业中。动物饲料中含有大量纤维素,而大部分饲养动物(除某些反刍动物以外)都不具有分解纤维素的能力,造成资源浪费及环境污染。纤维素酶一方面以添加剂的形式加入到动物饲料中;另一方面纤维素酶用于动物饲料的预处理,如秸秆或其他粗饲料。在医药领域中,用于中草药有效成分的提取,中药提取成分分析和治疗某些疾病等。纤维素酶还在纺织和造纸工业中都有重要应用。
里氏木霉在生产纤维素酶具有非常广阔的应用前景,但要获得高效的纤维素酶生产菌株,还需要长时间的努力。从20世纪90年代初人们就开始对里氏木霉产纤维素酶进行研究,但是里氏木霉在生产纤维素酶方面还是具有很多缺点,如生产技术落后、规模小、生产成本高、酶活性低等,这极大地限制了其在工业上的应用。目前,可以通过诱变育种、基因重组、原生体融合技术、杂交育种、分子改造等各种行之有效的方法,以期提高纤维素酶的质量和产量,获得纤维素酶高产菌。另外,可以选择廉价的工业化原料为碳氮源,节约生产成本。随着不断深入的研究里氏木霉,以及高新技术的快速发展,获得适合工业生产的高活力纤维素酶菌株的前景将是一片光明。
[1]石元春.中国生物质原料资源[J].中国工程科学,201l,13(2):16-23.
[2]方志锋,刘昆仑,陈复生,等.木质纤维素类生物质制备生物乙醇研究进展[J].现代化工,2013,33(1):30-33.
[3]DE CASTRO A M,FERREIRA M C,DA CRUZ J C,et al.High-yield endoglucanase production byTrichoderma harzianumioc-3844 cultivated in pretreated sugarcane mill byproduct[J].Enzyme Res,2010,26:1-8.
[4]NEAGU D A,DESTAIN J,THONART P,et al.Trichoderma reeseicellulase produced by submerged versus solid state fermentations[J].Bull UASVM Agr,2012,69(2):320-326.
[5]JUHASZ T,SZENGYEL Z,SZIJARTO N,et al.Effect of pH on cellulase production ofTrichoderma reeseiRUT C30[J].Appl Biochem Biotechnol,2004,113-116:201-211.
[6]ZHANG Y H,HIMMEL M E,MIELENZ J R.Outlook for cellulose improvement:Screening and selection strategies[J].Biotechnol Adv,2006,24:452-481.
[7]刘树立,王 华,王春艳,等.纤维素分子结构及作用机理的研究进展[J].食品科技,2007(7):12-15.
[8]韩鸿鹏,张丽琴,郝青梅,等.放线菌产纤维素酶的化学修饰[J].安徽农业科学,2012,40(4):2298-2300.
[9]KAWAI T,NAKAZAWA H,IDA N,et al.A comprehensive analysis of the effects of the main component enzymes of cellulase derived fromTrichoderma reeseionbiomass saccharification[J].J Ind Microbiol Biotechnol,2013,40(8):805-810.
[10]史 通,宋向阳,欧阳嘉,等.黑曲霉与里氏木霉固态混合发酵产β-葡萄糖苷酶[J].生物加工过程,2013,11(5):11-15.
[11]王 涫,王明钰,穆子铭,等.里氏木霉纤维素酶生产工艺的优化[J].黑龙江农业科学,2012(5):108-111.
[12]张晓月,孜力汗,李勇昊,等.里氏木霉RUT-C30 产纤维素酶培养基优化及酶解特性[J].过程工程学报2014,14(2):312-317.
[13]AHAMED A,VERMETTE P.Effect of mechanical agitation on the production of cellulases byTrichoderma reeseiRUT-C30 in a draft-tube airlift bioreactor[J].Biochem Eng J,2010,49(3):379-387.
[14]DAI Z Y,ARYAL U K,SHUKLA A,et al.Impact ofalg3 gene deletion on growth,development,pigment production,protein secretion,and functions of recombinantTrichoderma reeseicellobiohydrolases inAspergillus niger[J].Fungal Genet Biol,2013,61:120-132.
[15]李荣杰.纤维素酶高产菌的分离筛选与培养基优化[J].畜牧与饲料科学,2009,30(6):9-11.
[16]孙海彦,赵平娟,黎绢华,等.纤维素酶高产菌株的筛选及鉴定[J].安徽农业科学,2011,39(36):22206-22208.
[17]AKINOLA G E,OLONILA O T,ADEBAYO-TAYO B C.Production of cellulases byTrichodermaspecies[J].Acad Arena,2012,4(12):27-37.
[18]周德庆.微生物学教程[M].北京:高等教育出版社,1993.
[19]傅 力,涂正东,叶 凯,等.里氏木霉高产纤维素酶菌株的选育及产酶培养基的优化[J].食品与机械,2009,25(3):10-13.
[20]IKE M,PARK J Y,TABUSE M,et al.Cellulase production on glucose-based media by the UV-irradiated mutants ofTrichoderma reesei[J].Appl Microbiol Biotechnol,2010,87(6):2059-2066.
[21]张素敏,陈彩芳,叶云秀,等.内切葡聚糖苷酶高产菌株的诱变选育[J].微生物学通报,2013,40(8):1448-1456.
[22]张 宁,蒋剑春,杨 静,等.低能离子注入法诱变选育纤维素酶产生菌的研究[J].林产化学与工业,2012,32(5):29-33.
[23]JUNG Y R,SHIN H Y,YOO H Y,et al.Production of cellulases andβ-glucosidase inTrichoderma reeseimutated by proton beem irradiation[J].Korean J Chem Eng,2012,29(7):925-930.
[24]DURAND H,CLANET M.Genetic improvement ofTrichoderma reeseifor large scale cellulase production[J].Enzyme Microb Tech,1988,10(6):341-346.
[25]GADGIL N J,DAGINAWALA H F,CHAKRABARTI T,et al.Enhanced cellulase production by a mutant ofTrichoderma reesei[J].Enzyme Microb Tech,1995,17(10):942-946.
[26]HAO X C,YU X B,YAN Z L.Optimization of the medium for the production of cellulase by the mutantTrichoderma reeseiWX-112 using response surface methodology[J].Food Technol Biotech,2006,44(1):89-94.
[27]HE J,YU B,ZHANG K Y,et al.Strain improvement ofTrichoderma reeseiRut C-30 for increased cellulase production[J].Indian J Microbiol,2009,49(2):188-195.
[28]张晓烜,王傲雪.饲用高产纤维素酶菌株的诱变选育[J].中国饲料,2011(13):20-23.
[29]SONG J Z,LIU B D.Cloning of two cellobiohydrolase genes fromTrichoderma virideand heterogenous expression in yeastSaccharomyces cerevisiae[J].Mol Biol Rep,2010,37(4):2135-2140.
[30]王冰冰,夏黎明,杜风光.黑曲霉纤维二糖酶基因的克隆及其在里氏木霉中的表达[J].化工学报,2011,62(2):452-457.
[31]MA L,ZHANG J,ZOU G,et al.Improvement of cellulase activity inTrichoderma reeseiby heterologous expression of a beta-glucosidase gene fromPenicillium decumbens[J].Enzyme Microb Tech,2011,49(4):366-371.
[32]金 欣,夏黎明.厌氧真菌内切-β-葡聚糖苷酶基因在里氏木霉中的重组与表达[J].高效化学工程学报,2011,25(4):637-642.
[33]JIN X,XIA L M.Heterologous expression of an endo-β-1,4-glucanase gene from the anaerobic fungusOrpinomycesPC-2 inTrichoderma reesei[J].World J Microbiol Biotechnol,2011,27(12):2913-2920.
[34]顾斌涛,江守坤,夏黎明.中性内切-β-葡聚糖酶基因在里氏木霉中的重组与表达[J].高校化学工程学报,2013,27(1):108-112.
[35]张晓烜,李景富,王傲雪.里氏木霉40359 原生质体制备条件研究[J].东北农业大学学报,2011,42(8):108-111.
[36]EL-BONDKLY A M.Gene transfer between differentTrichodermaspecies andAspergillus nigerthrough intergeneric protoplast fusion to convert ground rice straw to citric acid and cellulases[J].Appl Biochem Biotechnol,2006,135(2):117-132.
[37]FANG H,XIA L M.High activity cellulase production by recombinantTrichoderma reeseiZU-02 with the enhanced cellobiohydrolase production[J].Bioresource Technol,2013,144:693-697.
[38]ZHANG J W,ZHONG Y H,ZHAO X N,et al.Development of the cellulolytic fungusTrichoderma reeseistrainwith enhancedβ-glucosidase and filter paper activity using strong artificial cellobiohydrolase 1 promoter[J].Bioresource Technol,2010,101(24):9815-9818.
[39]王仁华,刘晓兰,王琤韋華,等.水产动物纤维素酶的应用研究[J].饲料研究,2011(12):62-64.
[40]李西腾.纤维素酶及其在发酵食品工业中的应用[J].江苏调味副食品,2009,26(4):33-41.
