纳豆激酶高活性菌株BN-05鉴定及发酵工艺优化
2014-04-24王常苏孙晓彤
王常苏,孙晓彤,余 洁,高 冰*
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.武汉鑫宏食品酿造科研所,湖北 武汉 430051)
血栓性疾病可导致心肌梗塞、脑血栓中风、急性肺原性心脏病等相关性疾病[1],因其发病率高、复病率高,而且难以根治,已成为威胁人类健康的主要疾病。因此,近几年来就如何有效的治愈血栓性疾病,引起了医学界、科技界高度重视。纳豆激酶(nattokinase,NK)已被证明具有高效的溶栓作用[2-4],其不仅可以直接降低纤维蛋白原,而且可以促进催化血纤维蛋白溶酶原转化为血纤维蛋白溶酶,增加体内血栓溶解因子的合成[5-7]。相比临床上的溶栓药物(尿激酶(urokinase,UK)、链激酶(streptokinase,SK)和组织型纤溶酶原激活剂(tissue-type plasminogenactivator,t-PA),纳豆激酶具有高效的溶纤活性、安全性好、生产成本低、无毒副作用、半衰期长、在胃肠的稳定性好等优点[8-12]。
实验对筛选的纳豆激酶生产菌BN-05进行了菌落形态观察和分子鉴定;并采用单因素和正交试验对筛选菌株产纳豆激酶的固体发态发酵条件进行了初步研究,以期提高纳豆激酶的含量,为该酶的进一步扩大培养奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
菌种:纳豆枯草芽孢杆菌(Bacillus natto)BN-05,由本实验室保存。柱式细菌DNAout(细菌基因组抽提试剂盒):北京天恩泽基因科技有限公司。
1.1.2 培养基
初筛培养基:酪蛋白培养基,其组成为5g/L酪素,1g/L葡糖糖,1g/L酵母膏,1g/L K2HPO4,0.5g/L KH2PO4,0.1g/L MgSO4,pH7.0~7.2。
斜面培养基:LB培养基,其组成为10g/L蛋白胨,5g/L酵母提取物,10g/L NaCl,15g/L琼脂,pH7.0。
液体种子培养基:10g/L葡糖糖,5g/L酵母提取物,10g/L牛肉膏,5g/L,pH7.4~7.6。
固体发酵培养基:黄豆洗净,与水以1∶5(w/v)的比例混合。
1.1.3 主要试剂
纤维蛋白原标准试剂(88mg可凝蛋白/支)、牛凝血酶(560U/支)和尿激酶生物标准品(1 240IU/瓶)均购于中国药品生物制品检定所;琼脂糖购自Biowest公司;其余试剂均为国产分析纯。
1.2 仪器与设备
AvcmJ-E冷冻离心机:美国贝克曼库尔特公司;FTGENE 5D PCR仪:英国Techne公司;Hitachi S-3000N 扫描电子显微镜(sanning electron microscope,SEM):日本电子株式会社;UV-1800PC 紫外可见分光光度计:上海美谱达仪器有限公司;SLY-2112B立式双层大容量恒温培养摇床:金坛市盛蓝仪器制造有限公司;LHS-250SC 型智能型恒温恒湿箱:上海浦东荣丰科学仪器有限公司。
1.3 实验方法
1.3.1 菌种鉴定
形态学鉴定:LB培养基培养菌株BN-05,为更清楚的观察菌体形态和表面结果,对菌株进行扫描电子显微镜(SEM)观察拍照。
16S rRNA菌株鉴定:用细菌DNA试剂盒(中国北京天恩泽基因科技有限公司)提取活性高菌株的基因组。PCR扩增采用通用引物:16sf95(TGACGAGTGGCGGACGGGTG)和16sr394(CCATGGTGTGACGGGCGGTGTG)由上海捷瑞生物工程有限公司合成。扩增片段送华大基因公司测序,测序结果在NCBI网站利用Blast进行比对,调出相似序列,用MEGA5.0软件构件系统发育树[13-14]。
1.3.2 菌种生长曲线
将保藏的菌种转接于新鲜的LB平板培养基上,活化24h,接入液体种子培养基(装液量100mL/250mL)中,37℃、180r/min条件下培养,每隔2h取样,测定波长660nm处的OD值,作出种子的生长曲线,确定接入发酵培养基的种龄。
1.3.3 固态发酵产纳豆激酶酶的条件优化
固态发酵工艺:将精选的大豆进行清洗除杂,加入5倍的清水,20~25℃浸泡3~5h,沥去水分,115℃灭菌30min,待其冷却至35℃以下,按湿黄豆8%的接种量进行接种发酵培养,37℃静置发酵48h,每隔12h搅拌一次。发酵结束后,提取粗酶液,用琼脂糖-纤维蛋白原平板法测定纳豆激酶的活性。
产酶条件优化:通过碳源、大豆破碎度、接种量、发酵温度进行单因素试验,在单因素试验的基础上设计L9(34)正交试验,确定最佳的发酵条件。每个试验设计3个重复。
1.3.4 酶活测定方法
琼脂糖-纤维蛋白平板的配制:按照Atrup法制备纤维蛋白原平板[15]并进行改进:首先将1%的琼脂糖溶于0.05mol/L的Tris-HCl(pH7.8)缓冲溶液中,加热至完全溶解后,取出10mL置于大试管中,待其冷却至50℃左右,迅速倒入10mL 1.5mg/L牛血纤维蛋白原溶液,不断振荡,使其完全混合均匀,注入直径9cm的培养皿中,再迅速加入300μL 20IU/mL的凝血酶溶液,不断晃动平皿使三者混合均匀,防止气泡的产生,静置1h后,用直径为2mm的无菌胶头吸管在平板上打孔。
粗酶液的提取:将发酵好的纳豆收集到离心管中(外粘物也一起收集),称质量,向离心管中加入生理盐水,纳豆质量(g)∶生理盐水(mL)=1∶2,4℃浸提4h后过滤,取滤液10000r/min离心15min,取上清液即所需要的粗酶液。
样品测定:取粗酶液10μL点样于琼脂糖-纤维蛋白平板上,37℃恒温培养16h,测量溶解圈的直径,计算各溶解圈面积,根据尿激酶标准曲线计算酶的活力单位。
2 结果
2.1 BN-05菌种鉴定
2.1.1 形态特征
菌落特征:经LB平板,37℃培养24h后,菌落圆形,边缘不规则,白色,稍透明,中间凸起,表面皱褶,湿润,用牙签挑菌落有拉丝现象,菌落与培养结合紧密。
菌体形态:挑取单菌落革兰氏染色后镜检,镜下细胞形态为杆状,革兰氏染色呈阳性,产芽孢,芽孢椭圆形,中生或近中生。菌的形态在SEM扫描电镜下放大10 000倍的结果见图1。
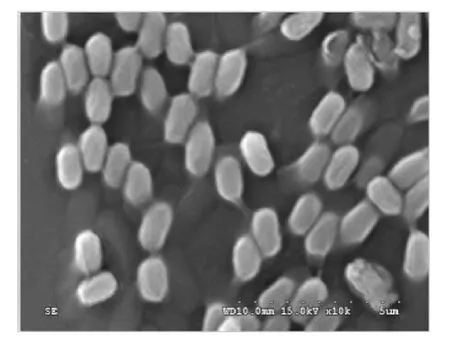
图1 菌株BN-05的SEM形貌分析Fig.1 SEM analysis of strain BN-05
2.1.2 16S rRNA序列分析及系统发育树的构建
PCR扩增所得BN-05菌株16S rRNA全长1513bp,序列已提交至GeneBank数据库(序列号为KC703051)。BLAST分析结果显示该基因同枯草芽孢杆菌(Bacillus subtillis)的16S rRNA基因相似度达到99%。通过MEGA5.05软件进行系统进化树的构建,得到了系统发育树状图见图2。系统发育学分析结果表明,该系统树以Paenibacillus borealis(AJ011322)作为一个单独的外群种,其中BN-05菌株与Bacillus subtillis属菌株在同一分支,结合菌株形态特征,初步鉴定BN-05为枯草芽孢杆菌属。
2.2 种子生长曲线
种子是发酵的基础,直接影响着固态发酵产纳豆激酶的含量。将BN-05接入种子培养基,于37℃、180r/min条件下培养,每隔2h取样,测波长660nm处的OD值,确定接入发酵培养基的种龄,结果见图3。
由图3可知,0~8h为延滞期,8~16h为生长对数期,16~28h为稳定期,从28h开始进入衰亡期。接种菌龄在对数生长期菌株存活率高且繁殖能力强,因此最佳接种龄为16h。
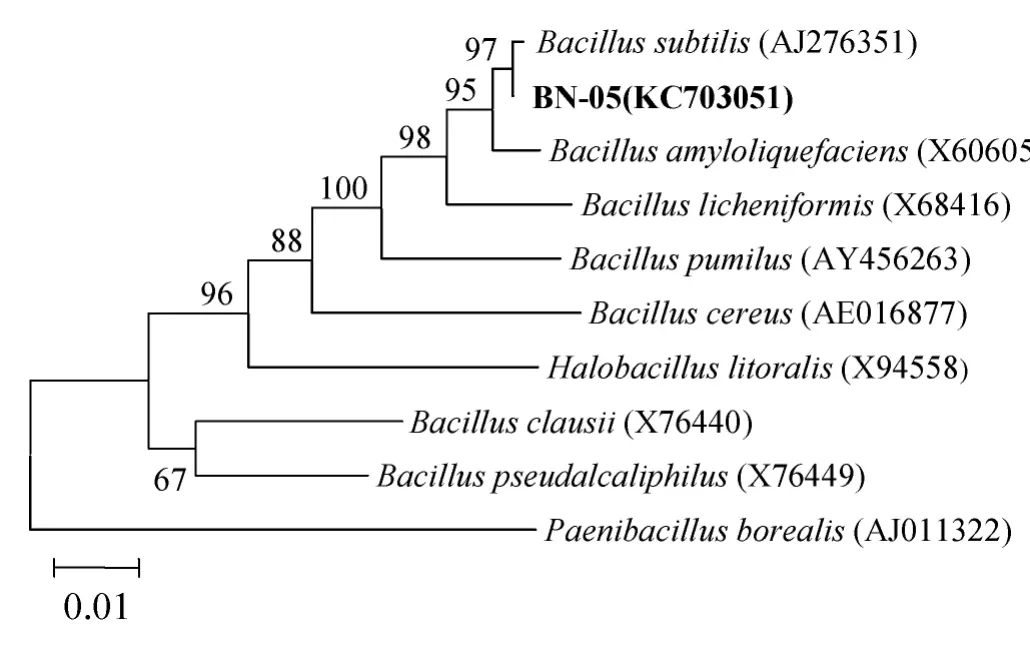
图2 MEGA 5.05用邻近法基于16S rRNA基因序列构建的系统进化树Fig.2 Phylogenetic tree inferred by neighbor-joining method based on 16S rRNA gene sequence using MEGA version 5.05
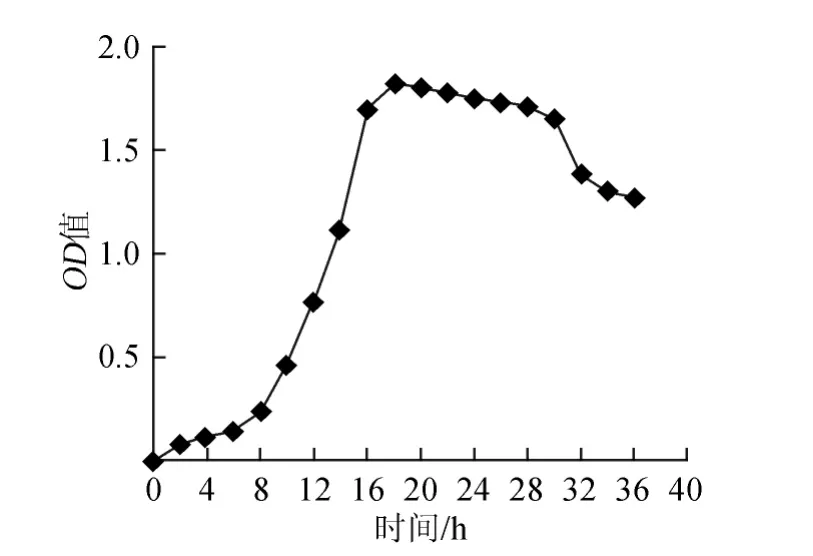
图3 BN-05 种子生长曲线Fig.3 Growth curve of the BN-05 seed
2.3 尿激酶的标准曲线[16]
配制不同的尿激酶标准品(200IU/mL、400IU/mL、800IU/mL、1000IU/mL、1200IU/mL、1400IU/mL、1600IU/mL、1 800IU/mL、2 000IU/mL和2 400IU/mL)各10μL点样于新配制的纤维蛋白原平板上,放置10min,37℃培养16h后取出,测定溶解圈的直径,计算各溶解圈面积,得出尿激酶活力的对数值(y)与溶解圈面积(x)呈线性关系,结果见图4。
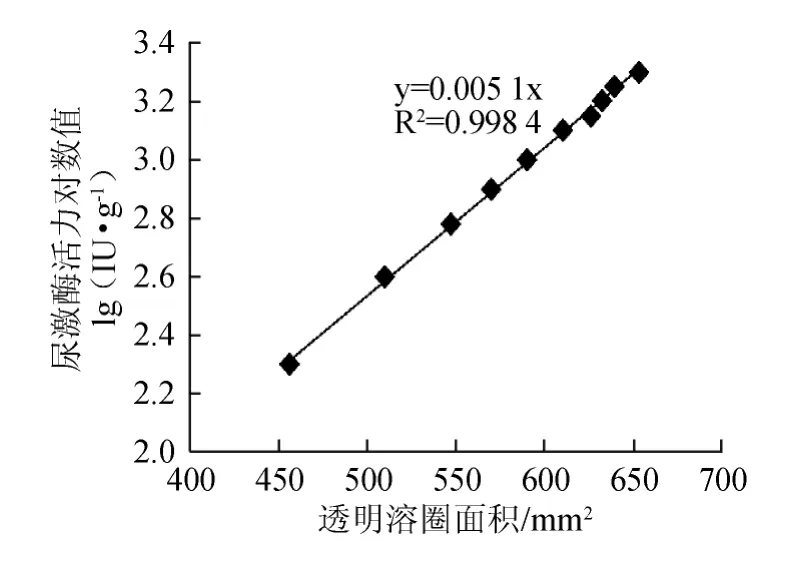
图4 尿激酶标准曲线Fig.4 Standard curve of urokinase activity
由图4可知,尿激酶标准线性方程为y=0.005 1x,相关系数R2=0.998 4。此标准曲线可用于测定纳豆激酶的活性,根据纳豆激酶溶解圈的面积,可计算出纳豆激酶的活力单位。
2.4 固态发酵产纳豆激酶的条件优化
2.4.1 不同碳源对发酵产酶的影响
以黄豆为基础发酵培养,在基质黄豆灭菌冷却后称质量,按2%的量分别添加甘油、葡糖糖、木糖、蔗糖、可溶性淀粉,接种纳豆枯草芽孢杆菌发酵,置于37℃的恒温培养箱中培养48h,每隔12h搅拌一次,发酵完成后检测纳豆激酶的含量,结果见图5。
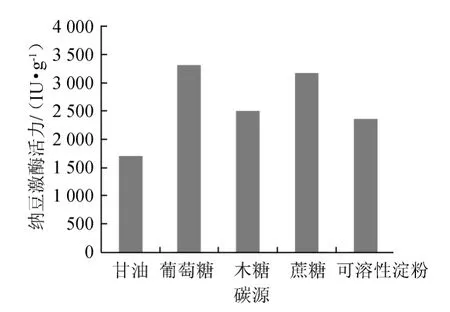
图5 不同碳源对纳豆激酶的影响Fig.5 Effect of different carbon source on NK activity
以黄豆为单一的固态发酵基质,其蛋白质的含量比较高而碳水化合物的含量并不高,因此在基质中补加适量的碳源,可补充基质中碳水化合物的不足,提高纳豆激酶的活力。由图5可知,葡糖糖的添加可使纳豆激酶的活力达到最大值为(3 310±110.23)IU/g湿黄豆,因此相对最佳碳源为葡糖糖。
2.4.2 大豆的破碎度对产酶的影响
为研究大豆破碎度对发酵产酶的影响,在其破碎度为0、2、4、6、8时,其他条件都相同的情况下进行发酵培养,发酵完成后测定样品中纳豆激酶的活性,结果见图6。
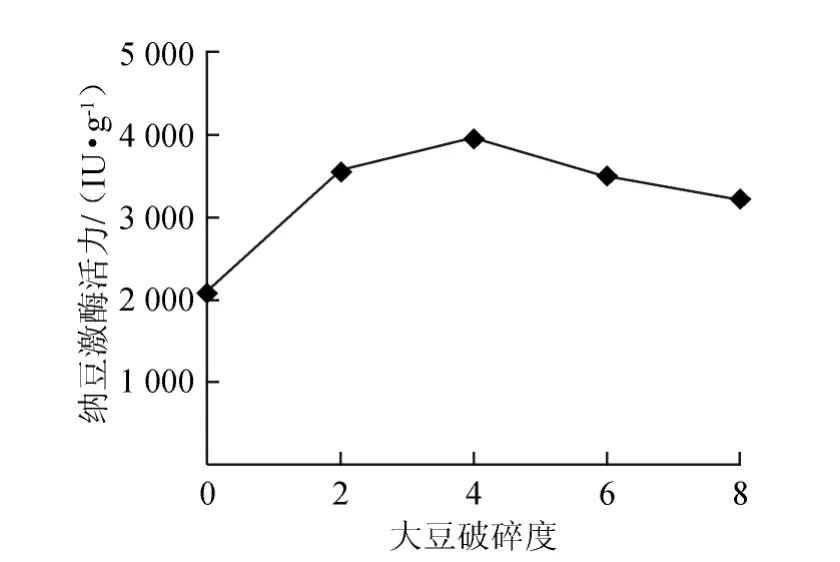
图6 大豆破碎度对纳豆激酶的影响Fig.6 Effect of fragmentation of fermented soybean on NK activity
图6表明,纳豆激酶的活性随着原料的破碎度不同而变化,当大豆的破碎度为4时,纳豆激酶活性达到最大值,为(4 180±112.05)IU/g湿黄豆。
2.4.3 接种量对发酵产酶的影响
接种量的多少直接影响发酵过程菌株产酶的活力,研究其对发酵产酶的影响,在其他发酵条件不改变的情况下,分别按2%、4%、6%、8%、10%的接种量进行发酵培养,发酵结束后,测定纳豆激酶的活力,结果见图7。
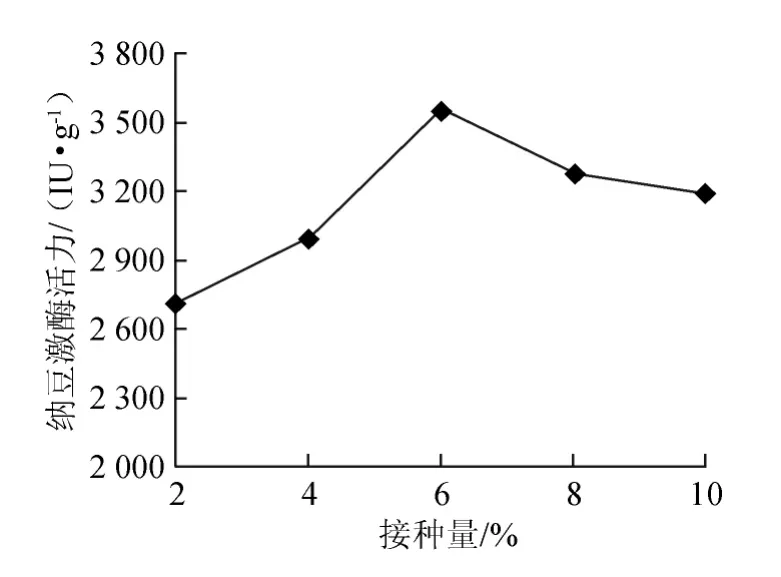
图7 接种量对纳豆激酶的影响Fig.7 Effect of different inoculum size on NK activity
由图7可以看出,接种量达到6%时,纳豆激酶的含量较高,达到(3 560±105.43)IU/g湿黄豆。当接种量为2%~6%时,NK的活力呈增长趋势,当增加为8%~10%时,NK的活力反而有所下降,这可能是接种量高容易造成前期消耗基质过多和基质缺氧,故选择接种量为6%。
2.4.4 发酵温度对发酵产酶的影响
选取发酵温度分别为29℃、31℃、33℃、35℃、37℃、39℃、40℃,在其他发酵条件不改变的情况下,考察温度对纳豆枯草芽孢杆菌产酶的影响,结果见图8。
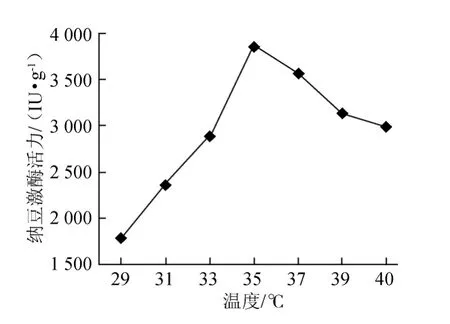
图8 温度对纳豆激酶的影响Fig.8 Effect of different culture temperature on NK activity
温度太低不利于菌株的生长,过高又不利于产酶,且酶在过高的温度下极易失活。由图8可以看出,培养温度为35℃时,NK的活力相对较高,活力为(3 864±95.21)IU/g湿黄豆。因此菌株的适宜培养温度为35℃。
2.4.5 发酵产酶条件优化
根据碳源、大豆破碎度、接种量和培养温度这4个因素设计L9(34)正交试验,确定最佳的发酵条件,因素水平见表1,试验结果及方差分析表分别见表2和表3。
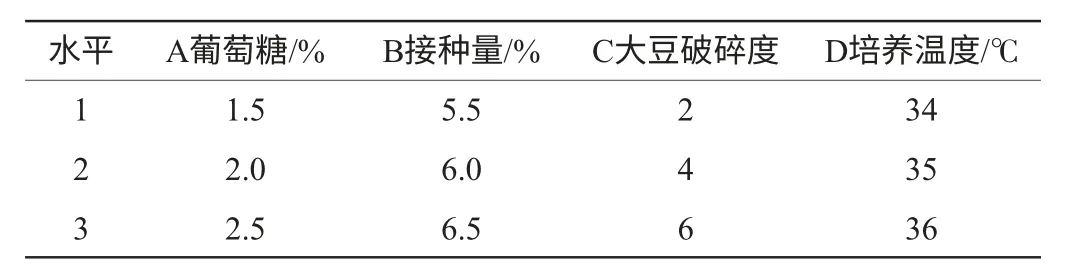
表1 固态发酵产酶正交试验L9(34)因素水平Table 1 Factors and level of L9(34) solid fermentation producing NK orthogonal experiment
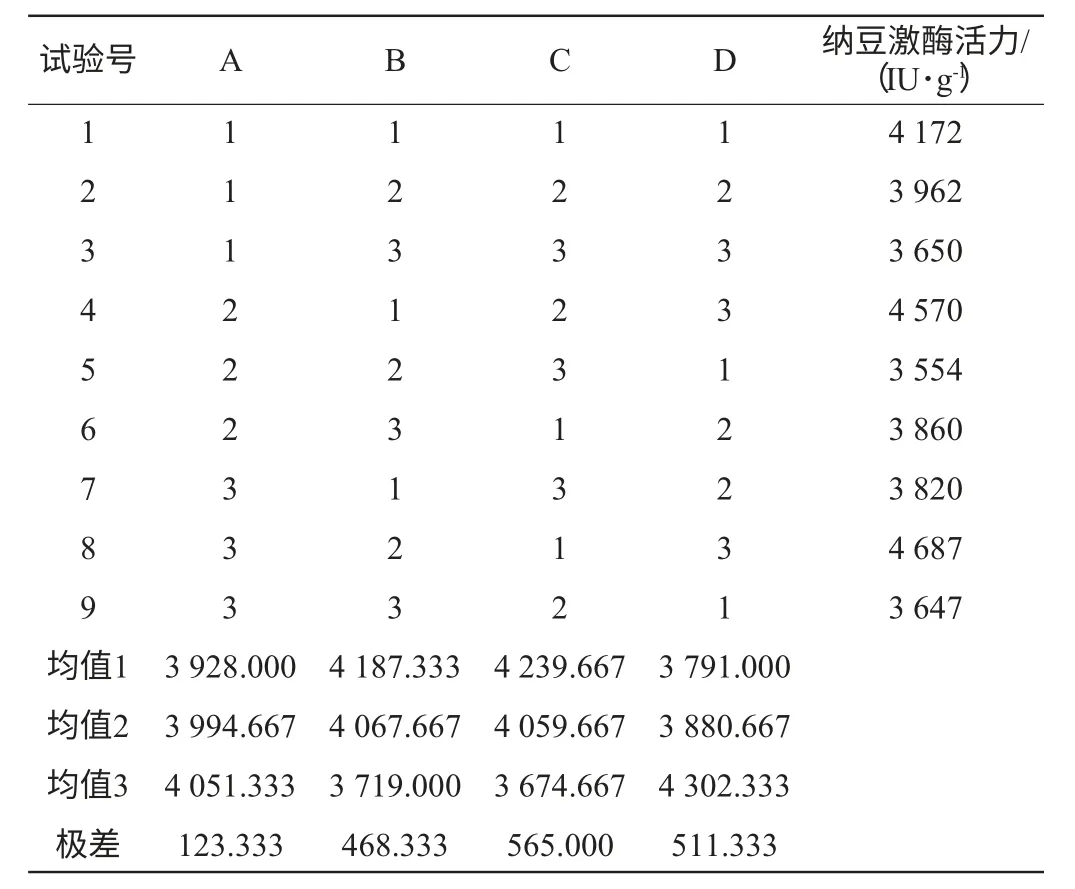
表2 固态发酵产酶正交试验结果Table 2 Results of solid fermentation producing NK orthogonal experiment
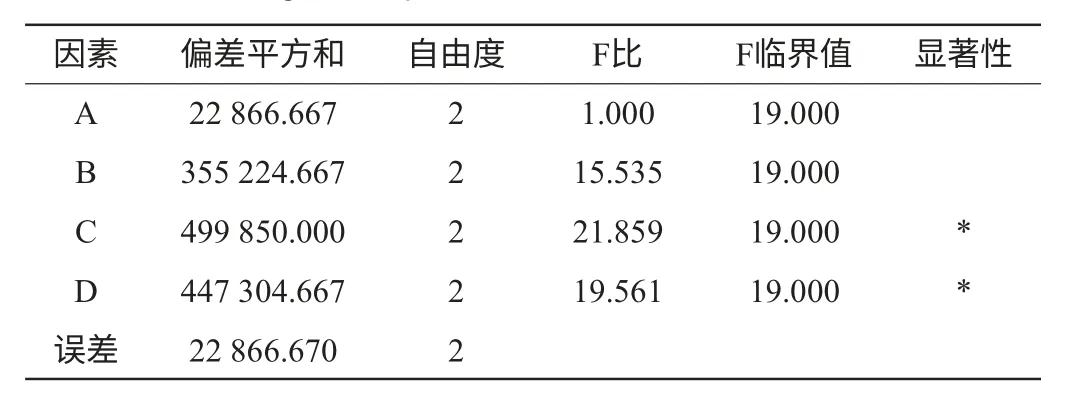
表3 固态发酵产酶正交试验方差分析Table 3 Variance analysis of solid fermentation producing NK orthogonal experiment
从正交试验结果及方差分析表可以看出,4个影响因素对发酵产纳豆激酶活力的影响因素主次为C>D>B>A,其中C因素和D因素影响比较显著,以黄豆为基质发酵纳豆产纳豆激酶的最佳发酵条件为C1D3B1A3,即大豆破碎度为2,发酵温度为36℃,接种量为5.5%,葡萄糖为2.5%。在最佳的发酵条件下进行发酵试验,3次试验得纳豆激酶活力的平均值为(4 715.26±103.23)IU/g湿黄豆,与之前相比(发酵条件优化前BN-05纳豆激酶的活力为(1 991±93.87)IU/g湿黄豆),酶活性提高了137%。
3 讨论
本研究对实验室分离的纳豆枯草芽孢杆菌BN-05进行了形态特征和分子生物鉴定,确定为枯草芽孢杆菌属。对该菌株的发酵产纳豆激酶的条件进行了探讨和研究。单因素和正交试验结果表明,该菌株产纳豆激酶的最佳发酵条件:大豆破碎度为2,发酵温度为36℃,接种量为5.5%,葡萄糖为2.5%。经过多次试验验证,采用此优化条件,BN-05的纳豆激酶的活力为(4 715.26±103.23)IU/g湿黄豆,比之前提高了137%。本研究对纳豆激酶的成品开发应用打下了基础。
[1]FURIE B,FURIE B C.Mechanisms of thrombus formation[J].N Engl J Med,2008,359(9):938-949.
[2]KUMADA K.Isolation ofBacillus subtilisnatto which shows high fibrinolytic activity[J].Igakutu Seibutsugaku,1993,126(6):299-303.
[3]平谷一,中西晃一朗,须见洋行.血栓溶解剂[P].日本公开特许89 180 834,1989.
[4]SUMI H,HAMADA H,TSUSHIMA H,et al.A novel fibrinolytic enzyme (nattokinase)in the vegetable cheese natto:A typical and popular soybean food in the Japanese diet[J].Experientia,1987,43(10):1110-1111.
[5]TAI M W,SWEET B V.Nattokinase for prevention of thrombosis[J].Am J Health Syst Pharm,2006,63(12):1121-1123.
[6]FUJITA M,NOMURA K,HONG K,et al.Purification and characterization of a strong fibrinolytic enzyme(nattokinase)in the vegetable cheese natto:A popular soybean fermented food in Japan[J].Biochem Biophys Res Commun,1993,197(3):1340-1346.
[7]SUMI H,HAMADA H,NAKANISHI K,et al.Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J].Acta Haematol,1990,84(3):139-143.
[8]FUJITA M,ITO Y,HONG K,et al.Characterization of nattokinase degraded products from human fibrinogen or cross-linked fibrin[J].Fibrinolysis,1995,9(3):157-164.
[9]IWAI K,NAKAYA N,KAWASAKI Y,et al.Antioxidative functions of natto,a kind of fermented soybeans:effect on LDL oxidation and lipid metabolism in cholesterol-fed rats[J].J Agr Food Chem,2002,50(12):3597-3601.
[10]URANO T,IHARA H,UMEMURA K,et al.The profibrinolytic enzyme subtilisin NAT purified fromBacillus subtiliscleaves and inactivates plasminogen activator inhibitor type1[J].J Biol Chem,2001,276(27):24690-24696.
[11]刘俊果,邢建民,畅天狮,等.反胶团萃取分离纯化纳豆激酶[J].科学通报,2006,51(2):133-137.
[12]DEEPAK V,KALISHWARALAL K,RAMKUMARPANDIAN S,et al.Optimization of media composition for nattokinase production byBacillus subtilisusing response surface methodology[J].Bioresour Technol,2008,99(17):8170-8174.
[13]闫建芳,齐小辉,高晓梅,等.拮抗放线菌B-20 的种类鉴定及其16S rDNA 序列分析[J].微生物学杂志,2008,28(3):26-29.
[14]蒋 茜.海洋放线菌GY-4 的鉴定及其抗菌物质研究[D].南京:南京农业大学硕士论文,2011.
[15]ASTRUP T,MÜLLERTZ S.The fibrin plate method for estimating fibrinolytic activity[J].Arch Biochem Biophys,1995,40(2):346-351.
[16]杨 明,董 超,史延茂,等.纤维蛋白平板法测定纳豆激酶方法的改进[J].中国酿造,2008,27(7):77-80.
