双糖体系中5-羟甲基糠醛的形成动力学分析
2014-03-22,,,,,
, ,,,,
(1.北京工商大学食品质量与安全北京实验室,北京 100048;2.北京市食品风味化学重点实验室,北京 100048;3.中国农业大学食品科学与营养工程学院,北京 100083)
5-羟甲基糠醛,又名5-(羟甲基)-2-呋喃甲醛(5-Hydroxymethylfurfural,HMF),是一种含有呋喃环的小分子化合物,性状为无色针状结晶,具有甘菊花味[1]。在热加工过程中,含糖丰富的食品会产生大量的5-羟甲基糠醛,当其含量超过标准时,就会对人体产生危害[2]。5-羟甲基糠醛广泛存在于葡萄干[3]、乳制品[4]、蜂蜜[5]、蛋糕[6]等食品中。
5-羟甲基糠醛的形成途径有两种:一种是美拉德反应途径[7];另一种是在酸性条件下糖的直接水解,即焦糖化反应途径[8]。美拉德反应和焦糖化反应形成5-羟甲基糠醛,其形成的速度会受到加热时间和温度的影响。随着加热温度的升高、热处理时间或储存时间的延长,5-羟甲基糠醛的浓度会明显升高,但在酸性条件下,5-羟甲基糠醛甚至可以在低温条件下形成[9]。
热加工是食品加工的一种重要的方式。在饮料的加工过程中常常涉及到热处理工序,并需要添加适量的蔗糖等,来改善饮料的状态和口感。这就为5-羟甲基糠醛的形成创造了条件。如果5-羟甲基的含量超标,说明食品可能加热过度。为了尽量减少有害物质的产生,就需要对食品的加工工艺进行合理的设计。而更好地设计食品的热加工工艺,防止过度加热,首先需要研究食品中不同的处理阶段的化学反应的动力学模型。动力学模型能够反映化学反应的速度快慢和产物的形成规律,为加工工艺提供理论指导。部分食品中5-羟甲基糠醛的形成动力学已有研究,如米酒[10]、蜂蜜[11]和曲奇饼[12-13]等。但双糖溶液模拟体系中5-羟甲基糠醛的形成动力学模型鲜有研究。
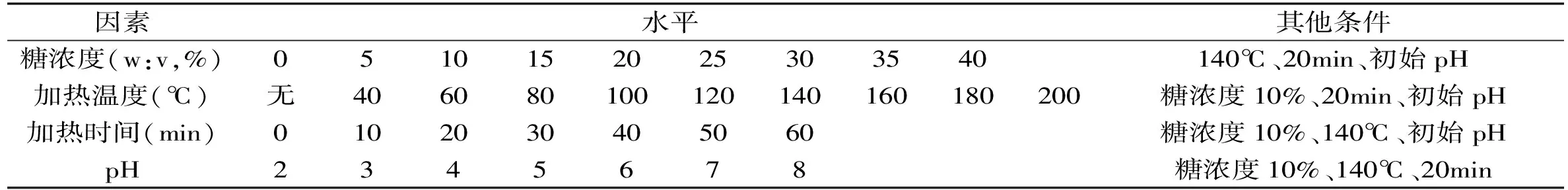
表1 单因素实验设计Table 1 Single-factor experimental design
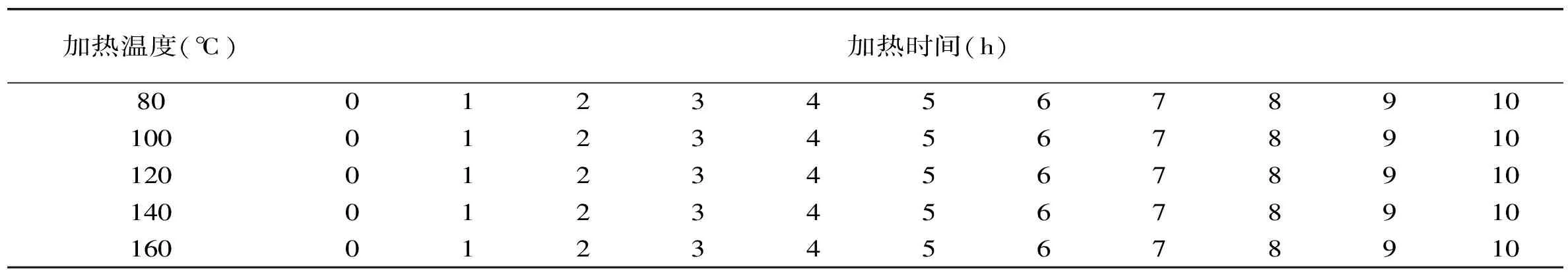
表2 动力学实验设计Table 2 Kinetics experimental design
本文采用高效液相色谱法,测定3种双糖(蔗糖、麦芽糖和乳糖)的单一糖溶液模拟体系中5-羟甲基糠醛的含量;通过数据拟合研究5-羟甲基糠醛的动力学模型。目的在于,探讨在热处理过程中,糖的种类对5-羟甲基糠醛形成的影响;确定单一糖溶液模拟体系中5-羟甲基糠醛的动力学形成规律。旨在为热加工含糖食品中的蔗糖等双糖形成5-羟甲基糠醛的形成过程提供理论基础。
1 材料与方法
1.1材料与仪器
5-羟甲基糠醛(纯度99%,色谱纯) 美国Sigma公司;甲醇(色谱纯) 美国MREDA技术有限公司;蔗糖、乳糖、麦芽糖(分析纯) 国药集团化学试剂有限公司。
LC-20A高效液相色谱仪(配有LC-20AT洗脱泵、SPD-20A检测器、CTO-20A柱温箱LCSolution工作站) 岛津国际贸易有限公司;Venusil XBP-C18色谱柱(4.6mm×250mm,5μm) 博纳艾杰尔科技有限公司;Orion/Model 868 pH计 Thermo Orion公司;DHG-9053A恒温烘箱 上海精宏实验设备有限公司。
1.2实验方法
1.2.1 模拟体系的制备 分别称取一定质量的(精确到小数点后两位)3种糖标品(蔗糖、麦芽糖、乳糖),加入去离子水定容至20mL,配成溶液置于50mL的烧杯中,用铝箔纸封住烧杯口并留一个直径为2mm的气孔(防止铝箔爆裂)。将烧杯放到恒温烘箱中加热一定时间,迅速冷却至室温,然后定容至50mL的容量瓶中。用0.45μm的水系滤膜过滤,待液相检测。
糖的单因素实验的因素及水平设计如表1所示;糖的动力学实验设计如表2所示。不同pH的缓冲液的配制:采用0.2mol/L Na2HPO4和NaH2PO4的磷酸缓冲溶液,分别以1mol/L HCl或NaOH调整pH为2、3、4、5、6、7、8作为溶解糖的溶液。
1.2.2 pH的测定 糖溶液样品在恒温箱中加热一定时间后,定容至50mL的容量瓶中,室温下使用pH计测定pH。
1.2.3 5-羟甲基糠醛含量的测定 采用高效液相色谱法[14]。
测定条件:色谱条件:Venusil XBP-C18色谱柱(4.6mm×250mm,5μm);柱温:30℃;UV检测器,检测波长:284nm;流动相:甲醇-水(5∶95,v/v);流速:1.0mL/min;进样量:20μL;检测时间20min。
标准曲线的建立:5-羟甲基糠醛储备液制备:精确称取5-羟甲基糠醛标准品0.0286g,用超纯水溶解,定容到100mL的容量瓶中,得0.286mg/mL的5-羟甲基糠醛标准品储备液,于4℃条件下避光保存。分别将储备液稀释为0.0143、0.0715、0.143、0.286、0.572、1.144、4.29、8.58、11.44μg/mL的标准品溶液。将标准品溶液用0.45μm的水系微孔滤膜过滤后,进行HPLC分析,重复进样3次,取平均值。以5-羟甲基糠醛浓度为横坐标,对应色谱峰面积为纵坐标作图,得浓度与峰面积的标准曲线。
样品的测定:称取糖样品2.00g,热处理后,用去离子水定容至50mL,0.45μm的水系微孔滤膜过滤后,HPLC进样分析,用外标法定量,每个样做3个重复。
1.2.4 数据处理 动力学对糖溶液中的5-羟甲基糠醛含量的变化规律,用零级动力学模型和一级动力学模型两种动力学模型进行分析,利用Arrhenius公式计算5-羟甲基糠醛形成的表观活化能,公式如式1、式2:
零级动力学模型:Ct=C0+k0·t
式(1)
一级动力学模型:Ct=C0exp(k1·t)
式(2)
其中,Ct代表测定指标在任意时间的值(mg/kg),C0是该指标的起始值(mg/kg),t为时间(h),k、k0和k1分别是动力学常数(h)。
Arrhenius公式:
k=kfexp(-Ea/RT)
式(3)
其中,kf是速率因子(h),Ea是表观活化能(kJ/mol),R为气体常数(8.314J/(k·mol))。
模型建立以后,需要定量地对模型的拟合度进行评价,常见的评价指标有:根平均方差(RMSE)、回归系数(R2)、精确因子(Af)、偏差因子(Bf)、SS。Af、Bf、SS、RMSE和R2五个参数通常作为一种定量的方法来评价模型[15-17]。公式如式4~式7:
根平均方差(RMSE):RMSE值越小,模型对数据的拟合度越高[15]。
式(4)
其中n是计算中实测值的个数。
回归系数(R2):R2值是模型拟合值与实测值拟合得到直线的相关系数,R2值越高,模型描述数据的精确性越好[15]。
精确因子(Accuracy factor,Af):用于评价预测值与观测值之间的偏离度[18]。
式(5)
Af值越接近1,表明模型拟合度越好。
偏差因子(Bias factor,Bf):用于表示实测值是大于预测值(Bf>1)或者小于预测值(Bf<1)或者等于预测值(Bf=1)[18]。
式(6)
SS是实测值和预测值之比的自然对数的平方和:
式(7)
2 结果与分析
2.15-羟甲基糠醛的色谱图
蔗糖、麦芽糖和乳糖3种双糖及标准品中5-羟甲基糠醛的高效液相色谱图如图1所示。从图1中可以看出,选定的测定条件能够很好地分离测定双糖溶液体系中的5-羟甲基糠醛。
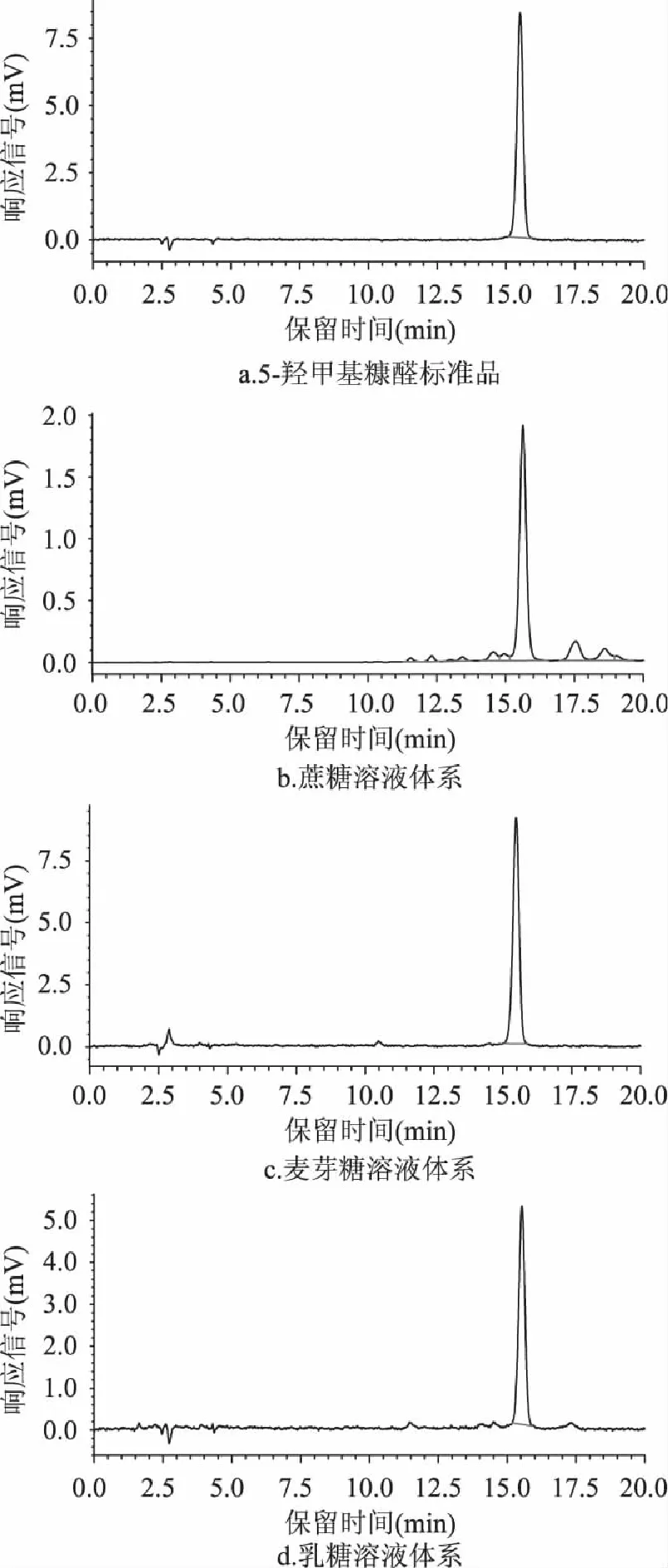
图1 3种双糖溶液体系中5-羟甲基糠醛的高效液相色谱图 Fig.1 Chromatograms(284nm)of 5-hydroxymethylfurfural in 3 disaccharide systems
2.2糖浓度对5-羟甲基糠醛含量的影响
在140℃,加热20min的条件下,糖浓度对模拟体积5-羟甲基糠醛含量的影响如图2所示。
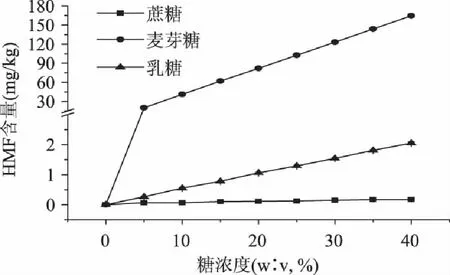
图2 糖浓度对模拟体系中5-羟甲基糠醛含量的影响 Fig.2 Effects of the amount of sugars on formations on 5-hydroxymethylfurfural
从图2中可以看出,随着糖浓度的增大,5-羟甲基糠醛的含量逐渐增大。Gökmen等[19]在研究糖浓度对曲奇饼中5-羟甲基糠醛形成的影响时,发现随着蔗糖含量的增加,5-羟甲基糠醛的形成量也随之增加。这说明5-羟甲基糠醛的形成量与糖浓度成正相关。所以在含糖食品的加工过程中,为了降低5-羟甲基糠醛的含量,应尽量减少易形成5-羟甲基糠醛的糖的添加量。
2.3温度对5-羟甲基糠醛含量的影响
在不同的加热温度,加热20min的条件下,加热温度对糖溶液5-羟甲基糠醛形成的影响如图3所示。蔗糖在160℃,20min时5-羟甲基糠醛含量达到最大值,为(0.11±0.01)mg/kg;乳糖和麦芽糖在180℃时,5-羟甲基糠醛含量达到最大值,为(0.64±0.01)mg/kg和(41.38±0.02)mg/kg。在热处理温度达到140℃和160℃时,糖溶液模拟体系中的5-羟甲基糠醛的含量在10h内有一个最大值,随后下降。在较低的热处理温度和较短的时间内,5-羟甲基糠醛的形成始终是一个累加的过程,5-羟甲基糠醛的含量呈现增加的趋势;在温度继续增加和热处理时间延长的条件下,5-羟甲基糠醛会加快聚合或分解反应,使得形成量小于消耗量,所以5-羟甲基糠醛的含量就会呈现下降的趋势[8]。所以,建议在设计焙烤、油炸、加热灭菌等食品热处理工艺时,为了减少5-羟甲基糠醛的形成以及相关副反应的发生,应尽量采用较低的热处理温度。
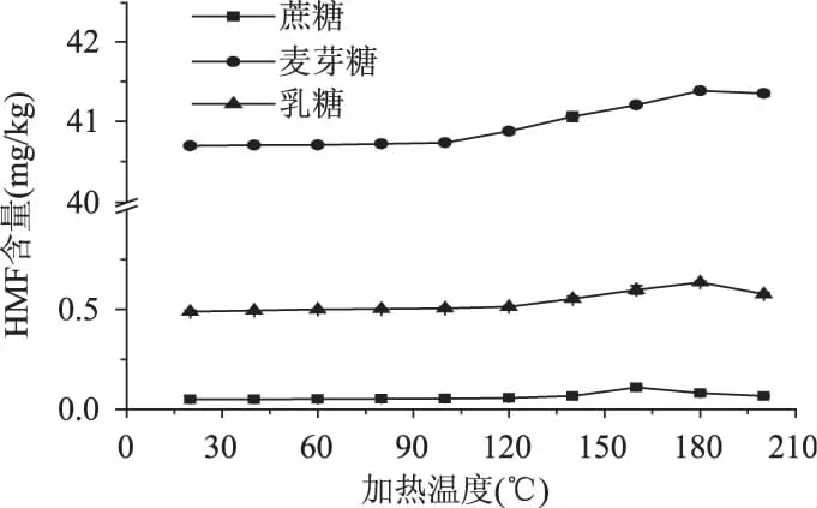
图3 加热温度对模拟体系中5-羟甲基糠醛含量的影响 Fig.3 Effects of the temperature on formations of 5-hydroxymethylfurfural
2.4加热时间对5-羟甲基糠醛含量的影响
在140℃的条件下,不同加热时间对糖溶液的模拟体系中5-羟甲基糠醛形成的影响如图4所示。从图4中可以看出,随着加热时间的延长,糖溶液中5-羟甲基糠醛的含量逐渐升高。这与已研究过的蛋糕模型体系中,5-羟甲基糠醛的含量变化一致。在蔗糖、麦芽糖和乳糖体系中的5-羟甲基糠醛的含量均随加热时间的延长而增加[6]。蔗糖溶液中5-羟甲基糠醛的含量从0.05mg/kg增加至0.08mg/kg;麦芽糖溶液中5-羟甲基糠醛的含量从40.69mg/kg增加至48.72mg/kg;乳糖溶液中5-羟甲基糠醛的含量从0.49mg/kg增加至0.75mg/kg。麦芽糖体系中5-羟甲基糠醛的增加量最大,而蔗糖体系的变化最小。
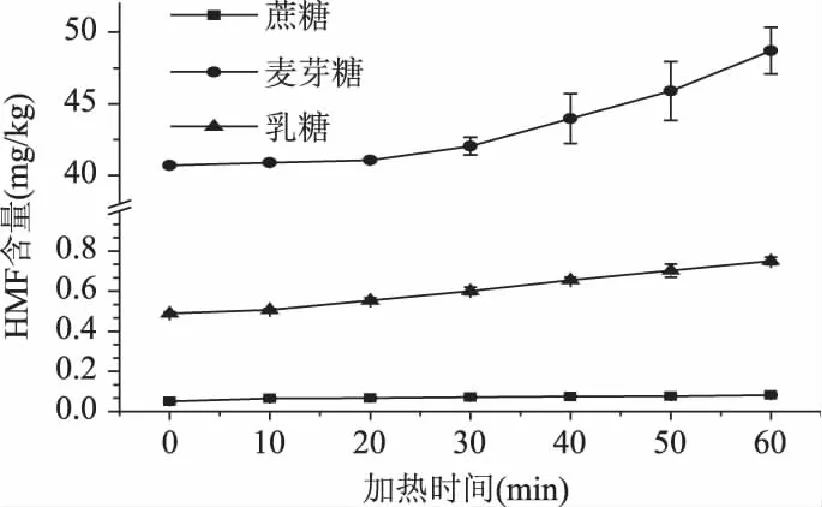
图4 加热时间对模拟体系中5-羟甲基糠醛含量的影响 Fig.4 Effects of the heating time on formations of 5-hydroxymethylfurfural
2.5初始pH对5-羟甲基糠醛含量的影响
在140℃,加热20min的条件下,不同初始pH的糖溶液模拟体系中5-羟甲基糠醛含量的变化如图5所示。
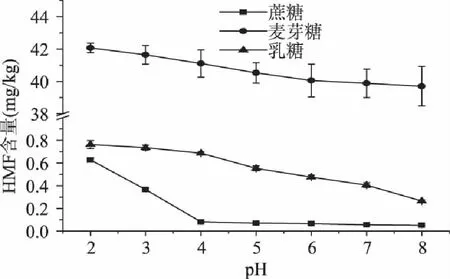
图5 初始pH对模拟体系中5-羟甲基糠醛含量的影响 Fig.5 Effects of the initial pH on formations of 5-hydroxymethylfurfural
从图5中可以看出,糖溶液的初始pH对5-羟甲基糠醛形成的影响较大,尤其是在pH2时,6种糖溶液中5-羟甲基糠醛的含量均达到最大值。但随着糖溶液pH的升高,5-羟甲基糠醛的形成量也逐渐减少。从pH2至pH8,蔗糖溶液中5-羟甲基糠醛的形成量从0.63mg/kg降低至0.05mg/kg;麦芽糖溶液中5-羟甲基糠醛的形成量从42.07mg/kg降低至39.70mg/kg;乳糖溶液中5-羟甲基糠醛的形成量从0.76mg/kg降低至0.27mg/kg。pH是一个影响5-羟甲基糠醛形成的重要因素,酸性条件能够促进焦糖化反应的发生,在酸性条件下,5-羟甲基糠醛甚至可以在低温条件下形成[10]。为了减少5-羟甲基糠醛的形成,在饮料等食品的配料过程中,应控制食品体系的pH。在单一糖溶液模拟体系的加热过程中,5-羟甲基糠醛的形成不可能通过美拉德反应途径,所以焦糖化反应途径是该体系中5-羟甲基糠醛形成的主要途径。焦糖化反应能够释放H+,随着焦糖化反应的进行样品的pH逐渐下降,最终到达pH为4~5的微酸区域[8],从而促进5-羟甲基糠醛的形成。
2.6蔗糖中5-羟甲基糠醛的形成动力学分析
在不同的加热温度和加热时间的条件下,蔗糖溶液pH的变化如表3所示。
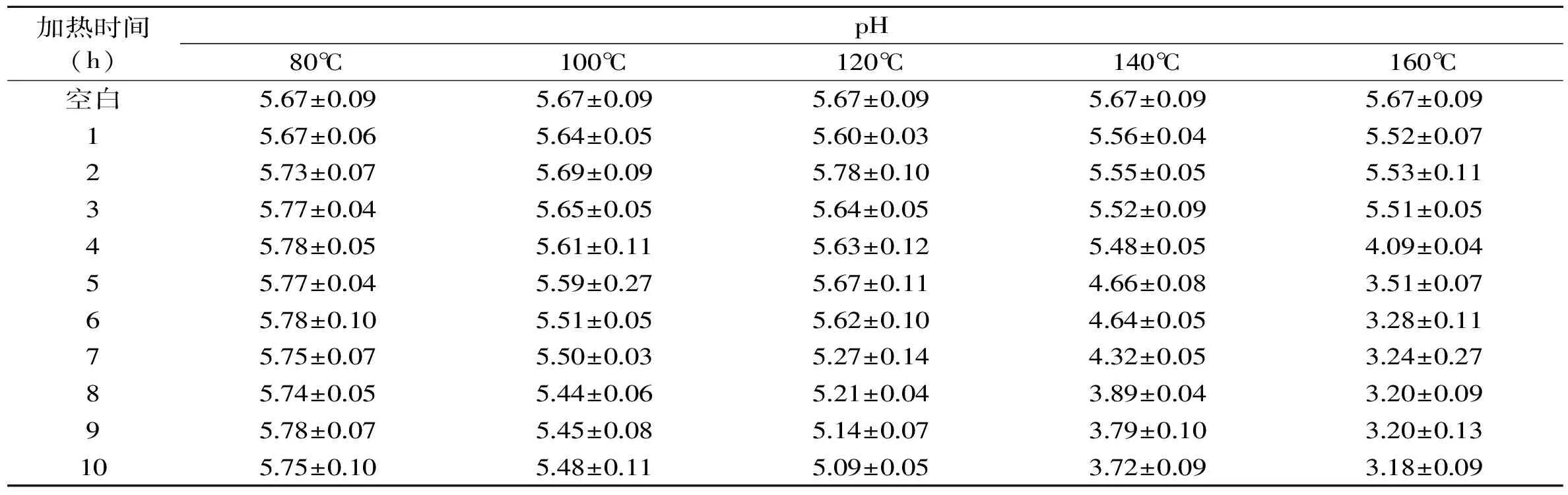
表3 不同加热时间和温度对蔗糖溶液pH的影响Table 3 Effects of the heating temperature and time on the pH of sucrose solution
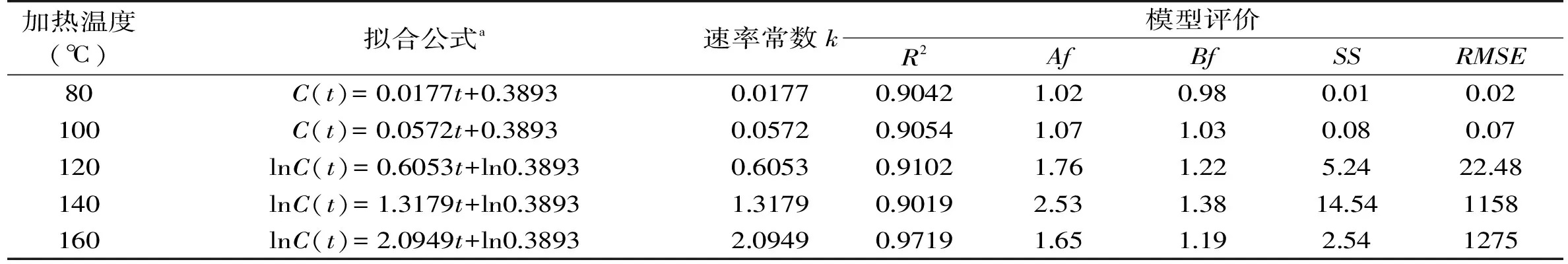
表4 蔗糖溶液模拟体系中5-羟甲基糠醛的形成动力学分析Table 4 Summary of kinetic analysis of 5-hydroxymethylfurfural formation in sucrose solution
在加热温度为80℃和100℃时,蔗糖溶液的pH无明显变化,继续升温至120℃时,pH下降至5.09,140℃时,pH下降至3.72,160℃时,pH下降至3.18。随着加热温度的升高和时间的延长,蔗糖加速分解;六碳糖在加热,发生脱水反应生成5-羟甲基糠醛的过程中,会伴随着许多副反应的发生,生成很多复杂的反应副产物,如2-羟基乙酰呋喃、呋喃甲醛、5-氯甲基糠醛、甲酸、乙酰丙酸等[20-21],造成体系中的pH下降。
在不同的加热温度和加热时间的条件下,蔗糖溶液模拟体系中5-羟甲基糠醛含量的变化如图6所示。蔗糖溶液模拟体系中5-羟甲基糠醛的形成动力学分析如表4所示。从图6和表4中可以看出,在140℃,8h时5-羟甲基糠醛形成量达到最大值12201.17mg/kg;160℃,5h时达到最大值13544.15mg/kg。在加热80℃和100℃时,蔗糖溶液中5-羟甲基糠醛的形成量与加热时间成线性关系,符合零级级动力学模型。在120、140(<8h)和160℃(<5h)时,5-羟甲基糠醛的形成量与加热时间成指数关系,符合一级动力学模型。
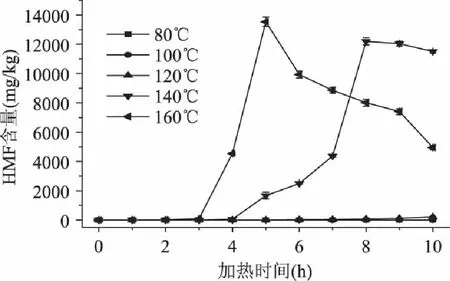
图6 加热温度和时间对蔗糖溶液模拟体系中5-羟甲基糠醛含量的影响 Fig.6 Effects of the temperature and time on formations of 5-hydroxymethylfurfural in sucrose solution
2.7麦芽糖中5-羟甲基糠醛的形成动力学分析
在不同的加热温度和加热时间的条件下,麦芽糖溶液pH的变化如表5所示。在加热温度为80℃和100℃时,麦芽糖溶液的pH无明显变化,继续升温至120℃时,pH下降至4.49,140℃时,pH下降至3.95,160℃时,pH下降至3.39,这与蔗糖的变化趋势相同。
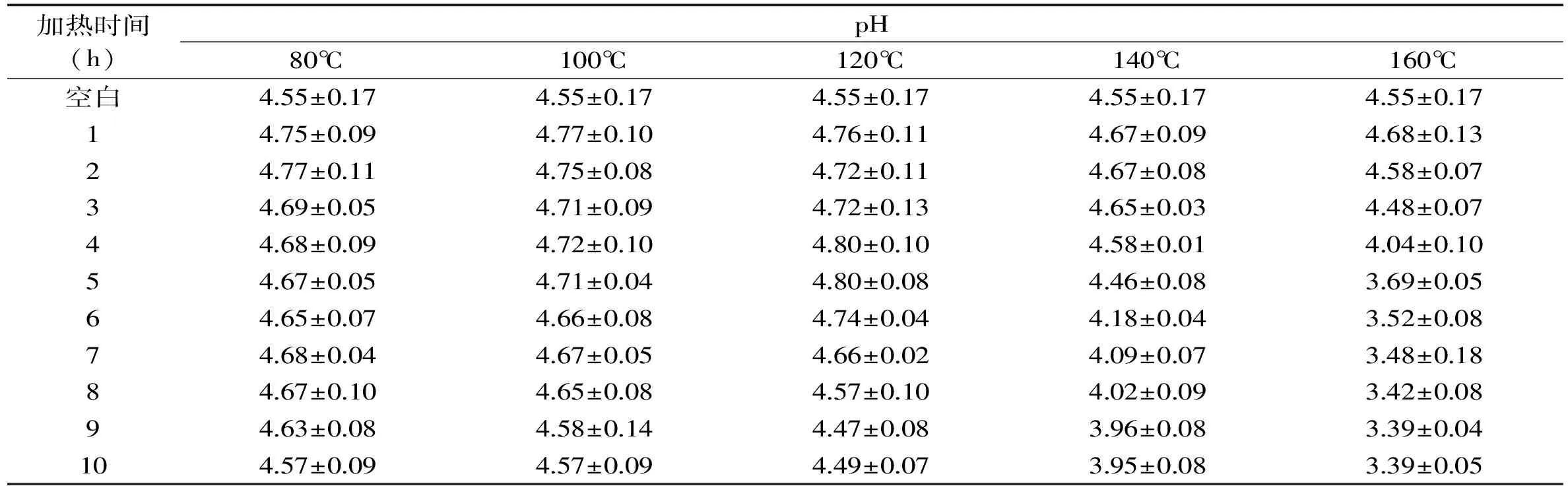
表5 不同加热时间和温度对麦芽糖溶液pH的影响Table 5 Effects of the heating temperature and time on the pH of maltose solution
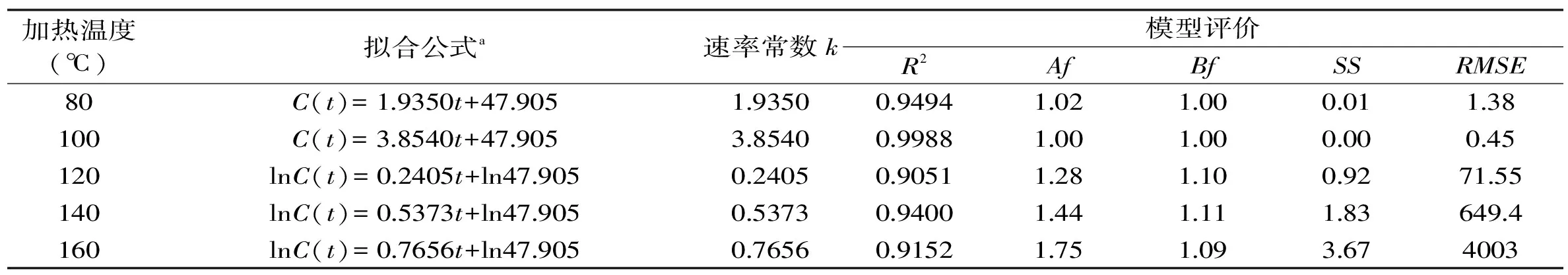
表6 麦芽糖溶液模拟体系中5-羟甲基糠醛的形成动力学分析Table 6 Summary of kinetic analysis of 5-hydroxymethylfurfural formation in maltose solution
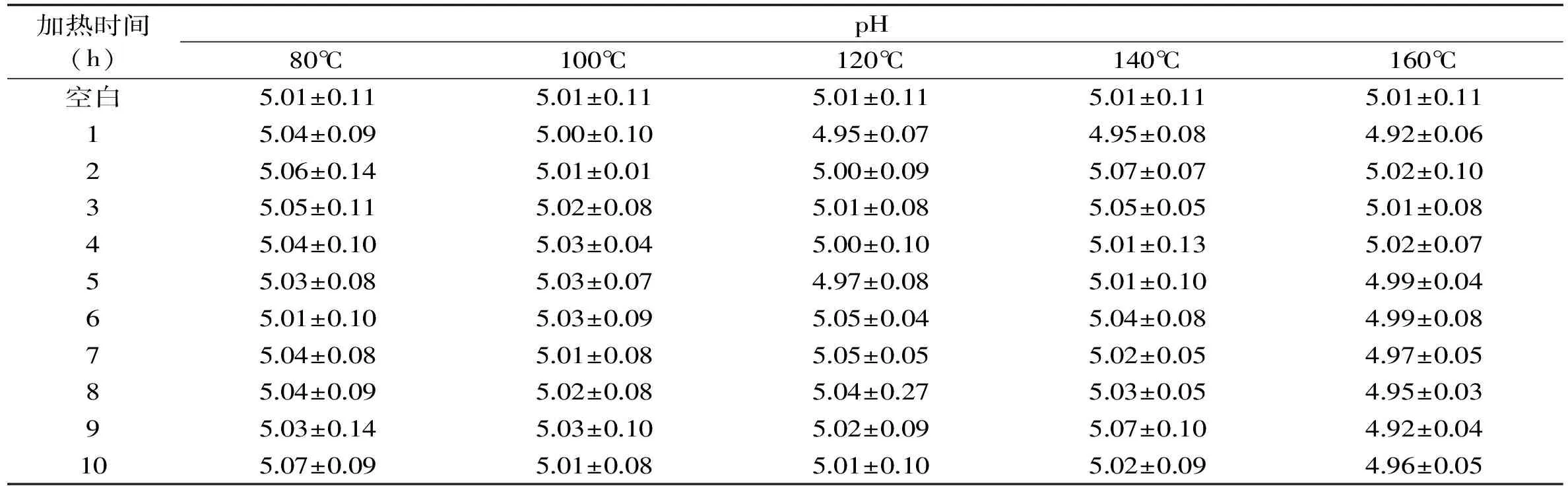
表7 不同加热时间和温度对乳糖溶液pH的影响Table 7 Effects of the heating temperature and time on the pH of lactose solution
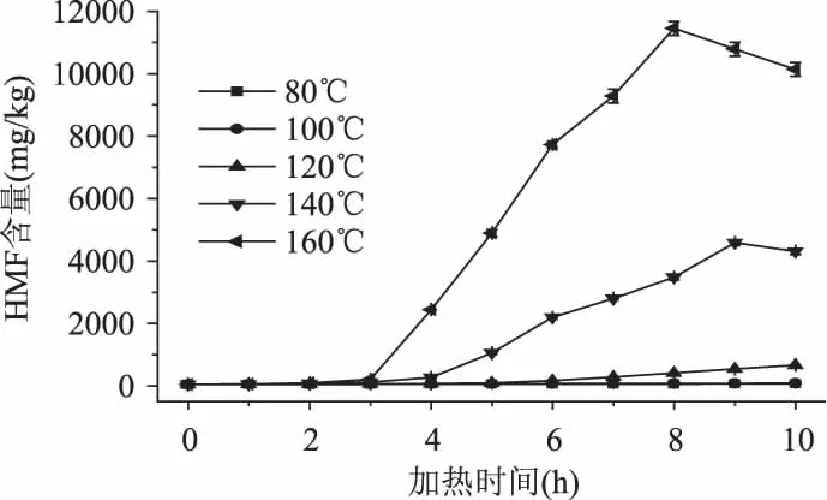
图7 加热温度和时间对麦芽糖溶液模拟体系中5-羟甲基糠醛含量的影响 Fig.7 Effects of the temperature and time on formations of 5-hydroxymethylfurfural in maltose solution
在不同的加热温度和加热时间的条件下,麦芽糖溶液模拟体系中5-羟甲基糠醛含量的变化如图7所示。麦芽糖溶液模拟体系中5-羟甲基糠醛的形成动力学分析如表6所示。从图7和表6中可以看出,在140℃,9h时5-羟甲基糠醛形成量达到最大值4587.73mg/kg,在160℃,8h时5-羟甲基糠醛形成量达到最大值11452.32mg/kg;在加热80、100℃时,麦芽糖溶液中5-羟甲基糠醛的形成量与加热时间成线性关系,符合零级级动力学模型。在120、140(<9h)和160℃(<8h)时,5-羟甲基糠醛的形成量与加热时间成指数关系,符合一级动力学模型。
2.8乳糖中5-羟甲基糠醛的形成动力学分析
在不同的加热温度和加热时间的条件下,乳糖溶液pH的变化如表7所示。在加热温度为80、100、120、140和160℃时,乳糖溶液模拟体系的pH均没有明显变化,这与蔗糖和麦芽糖的变化趋势不同。
在不同的加热温度和加热时间的条件下,乳糖溶液模拟体系中5-羟甲基糠醛含量的变化如图8所示。乳糖溶液模拟体系中5-羟甲基糠醛的形成动力学分析如表8所示。
从图8和表8中可以看出,在140℃,9h时5-羟甲基糠醛形成量达到最大值37.98mg/kg,160℃,5h时达到最大值46.26mg/kg;在加热80,100,120,140(<9h)和160℃(<5h)时,乳糖溶液中5-羟甲基糠醛的形成量与加热时间成线性关系,符合零级动力学模型。在相同的加热温度条件下,乳糖溶液中5-羟甲基糠醛的形成量比蔗糖和麦芽糖溶液中5-羟甲基糠醛的形成量低。在3种单一糖溶液模拟体系中,乳糖是形成5-羟甲基糠醛量最少,最稳定的一种糖。
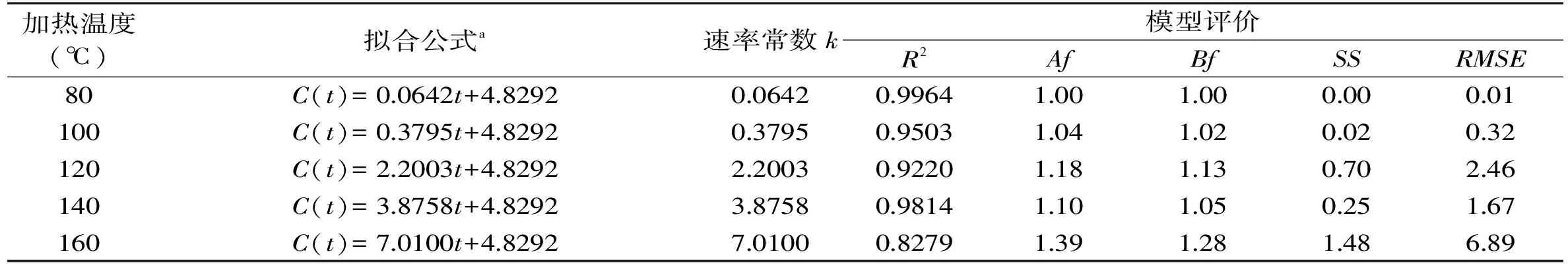
表8 乳糖溶液模拟体系中5-羟甲基糠醛的形成动力学分析Table 8 Summary of kinetic analysis of 5-hydroxymethylfurfural formation in lactose solution
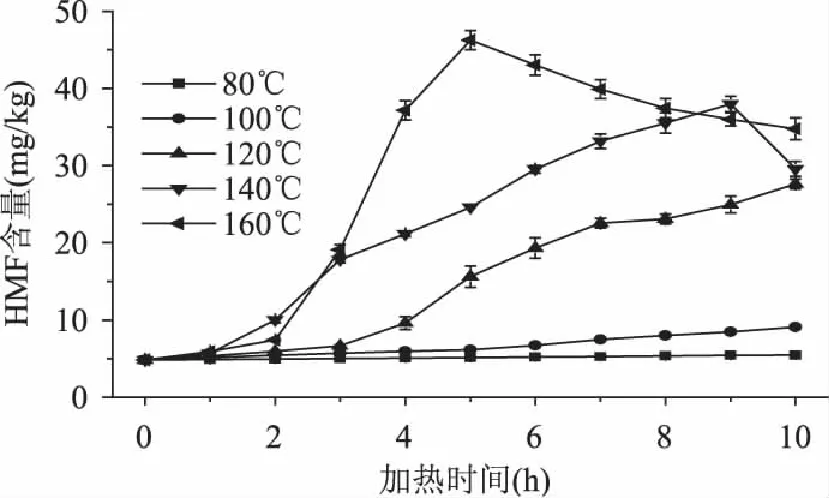
图8 加热温度和时间对乳糖溶液模拟体系中5-羟甲基糠醛含量的影响 Fig.8 Effects of the temperature and time on formations of 5-hydroxymethylfurfural in lactose solution
糖的种类、热处理温度和时间、pH、食品体系中的化合物,都会对5-羟甲基糠醛的形成产生影响,动力学模型也不相同。在蛋糕、曲奇饼等焙烤食品中,5-羟甲基糠醛的形成符合一级动力学模型[13];在氨基酸-葡萄糖模拟体系[22]、苹果汁模拟体系[23]、牛奶模拟体系[24]中,5-羟甲基糠醛含量变化均符合零级反应动力学模型。Gentry和Roberts[25]报道70、80℃下苹果汁中5-羟甲基糠醛的变化符合零级动力学模型。在80~100℃的热处理条件下,荔枝果汁中5-羟甲基糠醛的形成符合一级动力学模型[26];Ibarz[27]研究表明在较高温度下(90、100、121℃)梨汁中为5-羟甲基糠醛含量变化符合一级反应动力学。
随着加热温度的升高,5-羟甲基糠醛的形成量也在不断增加。反应温度对5-羟甲基糠醛的生成有着非常重要的影响[28]。较高的温度可以加快反应速率,因为在较高的反应温度条件下,烯醇缩合反应以及相关的水解和脱水反应均比较容易进行[29]。一般认为5-羟甲基糠醛反应的底物是单糖化合物,但也有报道称,在高于250℃的条件下烘烤饼干,若将葡萄糖或果糖置换为蔗糖,则会产生大量的5-羟甲基糠醛[13],这可能是由于蔗糖在高温条件下产生了具有较高活性的呋喃果糖基离子造成的[30]。在加热80~160℃,10h范围内,5-羟甲基糠醛的最大形成量为13544.15mg/kg(蔗糖)>11452.32mg/kg(麦芽糖)>46.26mg/kg(乳糖)。在热解条件下,蔗糖能够形成高活性的呋喃果糖基离子,而呋喃果糖基离子能够直接高效地转化成5-羟甲基糠醛[30],这就促使蔗糖比其他双糖形成5-羟甲基糠醛更加快速有效。所以在含糖食品的加工过程中,应根据加热时间和温度,选择合适的糖及其含量,尽量降低蔗糖和麦芽糖这类易产生5-羟甲基糠醛的糖的含量。这与蛋糕中5-羟甲基糠醛的形成规律的研究结果是一致的[6]。
3 结论
3.1双糖溶液模拟体系中5-羟甲基糠醛形成的研究结果表明:在3种双糖溶液的模拟体系中,5-羟甲基糠醛的形成与糖溶液的浓度、初始pH、加热时间和加热温度有关。随着糖浓度、加热温度和加热时间的增加以及pH的下降,3种糖溶液中的5-羟甲基糠醛生成量也逐渐增加。初始pH对5-羟甲基糠醛的形成影响较大,在初始pH2~pH8的范围内,pH2时,5-羟甲基糠醛的形成量最大。
3.2在加热80~160℃(<10h),且5-羟甲基糠醛的形成量不超过最大值的范围内,乳糖溶液中5-羟甲基糠醛的形成符合零级动力学模型;蔗糖和麦芽糖溶液中5-羟甲基糠醛的形成量在80℃和100℃时,符合零级动力学模型,在120,140和160℃时符合一级动力学模型。5-羟甲基糠醛的最大形成量为13544.15mg/kg(蔗糖)>11452.32mg/kg(麦芽糖)>46.26mg/kg(乳糖)。双糖溶液模拟体系的研究结果再次证明了,5-羟甲基糠醛的产生与糖的种类、浓度、pH、加热时间和温度密切相关。在热加工含糖食品时,应尽量降低糖的含量,并采用较低的加热温度和缩短加热时间的加工工艺,以减少5-羟甲基糠醛的生成。
[1]王军,张春鹏,欧阳平凯. 5-羟甲基糠醛制备及应用的研究进展[J]. 化工进展,2008,27(5):702-707.
[2]Abraham K,Gürtler R,Berg K,etal. Toxicology and risk assessment of 5-Hydroxymethylfurfural in food[J]. Molecular Nutrition and Food Research,2011,55(5):667-678.
[3]Charlton A J,Farrington W H H,Brereton P. Application of 1H NMR and Multivariate Statistics for Screening Complex Mixtures:Quality control and authenticity of instant coffee[J]. Journal of Agricultural and Food Chemistry,2002,50(11):3098-3103.
[4]Palma M,Taylor L T. Supercritical fluid extraction of 5-hydroxymethyl-2-furaldehyde from raisins[J]. Journal of Agricultural and Food Chemistry,2001,49(2):628-632.
[5]Zhang Y Y,Song Y,Zhou T T,etal. Kinetics 5-hydroxymethylfurfural formation in Chinese Acacia honey during heat treatment[J]. Food Science and Biotechnology,2012,21(6):1627-1632.
[6]Zhang Y Y,Song Y,Hu X S,etal. Effects of sugars in batter formula and baking conditions on 5-hydroxymethylfurfural and furfural formation in sponge cake models[J]. Food Research International,2012,49:439-445.
[7]Ames J M. The Maillard reaction in foods. In B. J. F. Hudson(Ed.),Biochemistry of food proteins[M]. London:Elsevier,1992,99-153.
[8]Kroh L W. Caramelisation in food and beverages[J]. Food Chemistry,1994,51(4):373-379.
[9]Lee H S,Nagy S. Relative reactivities of sugars in the formation of 5-hydroxymethyl furfural in sugar-catalyst model systems[J]. Journal of Food Processing and Preservation,1990,14:171-178.
[10]Chen L,Huang H,Liu W,etal. Kinetics of the 5-hydroxymethylfurfural formation reaction in Chinese rice wine[J].Journal of Agricultural and Food Chemistry,2010,58(6):3507-3511.
[12]Ameur L A,Trystram G,Birlouez-Aragon I. Accumulation of 5-hydroxymethyl-2-furfural in cookies during the backing process:Validation of an extraction method[J]. Food Chemistry,2006,98(4):790-796.
[13]Ameur L A,Mathieu O,Lalanne V,etal. Comparison of the effects of sucrose and hexose on furfural formation and browning in cookies baked at different temperatures[J]. Food Chemistry,2007,101(4):1407-1416.
[14]张玉玉,宋弋,周婷婷,等. 高效液相色谱法测定镇江香醋中5-羟甲基糠醛的含量[J]. 北京工商大学学报,2012,30(2):39-42.
[15]Ross T. Indices for performance evaluation of predictive models in food microbiology[J]. Journal of Applied Bacteriology,1996,81(5):501-508.
[16]Zhong K,Chen F,Wang Z F,etal. Inactivation and kinetic model for the Escherichia coli treated by a co-axial pulsed electric field[J]. European Food Research and Technology,2005,221(6):752-758.
[17]McClure P J,Baranyi J,Boogard E,etal. A predictive model for the combined effect of pH,sodium chloride and storage temperature on the growth of Bronchothrix thermosphacta[J]. International Journal of Food Microbiology,1993,19(3):161-178.
[18]Matser A M,Krebbers B,Van Den Berg R W,etal. Advantages of high pressure sterilisation on quality of food products[J]. Trends in Food Science & Technology,2004,15(2):79-85.
[19]Gökmen V,Açar Ö Ç,Köksel H,etal. Effects of dough formula and baking conditions on acrylamide and hydroxymethylfurfural formation in cookies[J]. Food Chemistry,2007,104(3):1136-1142.
[20]Cantor S M. 2-Hydroxyacetylfuran from sugars robert ellsworth miller[2][J]. Journal of the American Chemical Society,1952,74(20):5236-5237.
[21]Brown D W,Floyd A J,Kinsman R G,etal. Dehydration reactions of fructose in non-aqueous media[J]. Journal of Chemical Technology and Biotechnology,1982,32(10):920-924.
[22]Carabasa-Giribet M,Ibarz-Ribas A. Kinetics of colour development in aqueous glucose systems at high temperatures[J].Journal of Food Engineering,2000,44(3):181-189.
[23]Lozano J E. Kinetics of non-enzymatic browning in model systems simulating clarified apple juice[J]. LWT-Food Science and Technology,1991,24(4):355-360.
[24]Morales F J,Romero C,Jiménez-PéREZ S. New methodologies for kinetic study of 5-(Hydroxymethyl)-furfural formation and reactive lysine blockage in heat-treated milk and model systems[J]. Journal of Food Protection,1995,58(3):310-315.
[25]Gentry T S,Roberts J S. Formation kinetics and application of 5-hydroxymethylfurfural as a time-temperature indicator of lethality for continuous pasteurization of apple cider[J]. Innovative Food Science and Emerging Technologies,2004,5(3):327-333.
[26]万鹏. 荔枝果汁非酶褐变机理研究[D]. 广州:华中农业大学,2010.
[27]Ibarz A,Pagán J,Garza S. Kinetic models for colour changes in pear puree during heating at relatively high temperatures[J]. Journal of Food Engineering,1999,39(4):415-422.
[28]Asghari F S,Yoshida H. Kinetics of the decomposition of fructose catalyzed by hydrochloric acid in subcritical water:Formation of 5-hydroxymethylfurfural,levulinic,and formic acids[J]. Industrial and Engineering Chemistry Research,2007,46(23):7703-7710.
[29]Aida T M,Tajima K,Watanabe M,etal. Reaction of d-fructose in water at temperatures up to 400℃ and pressures up to 100 MPa[J]. Journal of Supercritical Fluids,2007,42(1):110-119.
[30]Locas C P,Yaylayan V A. Isotope labeling studies on the formation of 5-(hydroxymethyl)-2-furaldehyde(HMF)from sucrose by pyrolysis-GC/MS[J]. Journal of Agricultural and Food Chemistry,2008,56(15):6717-6723.
