丁苯酞对局灶性脑梗死大鼠皮层MMP-9和p-MLC表达的影响
2014-03-14刘永亮王丽娟王丽娜李建民赵雅宁
刘永亮,王丽娟,王丽娜,李建民,赵雅宁,王 鹏
(1.河北省唐山市人民医院神经外科,河北 唐山 063000;2.河北省唐山市丰润区第二人民医院检验科,河北 唐山 063000;3.河北联合大学附属医院神经外科,河北 唐山063000)
丁苯酞是我国自行研制的一类治疗缺血性脑血管病的新药,主要成分为消旋正丁基苯酞,具有改善缺血区微循环,保护线粒体,改善神经细胞能量代谢、抑制神经细胞凋亡等作用。脑水肿的发生是引起急性脑梗死病情加重的主要原因之一,有关丁苯酞对脑水肿的影响尚未见临床报道,本研究通过检测梗死灶周围皮层基质金属蛋白酶9 (matrix metalloproteinase-9,MMP-9)和磷酸化肌球蛋白轻链 (phosphorylation of myosin light chain,p-MLC)的表达,进一步探索丁苯酞治疗脑水肿可能的作用机制。
1 材料与方法
1.1 动物分组:健康Sprague-Dawley雄性大鼠150只,清洁级,体质量280~320g,由河北联合大学实验动物中心提供。按照随机性原则分为对照组50只、模型组50只和丁苯酞组50只。
1.2 模型制备:各组大鼠给予10%水合氯醛3~5mL/kg腹腔麻醉,模型组与丁苯酞组大鼠尾静脉注入光敏剂红四氮唑即玫瑰红B 150mg/kg,立体定位仪固定大鼠头部,常规消毒后,沿正中线切开头皮,暴露右侧颅骨,于前囟右3mm后2mm处,磨钻磨除直径约6mm外层颅骨,绿色冷光源照射30min,缝合皮肤。以实验动物麻醉清醒后Longa行为学评分1~3分作为纳入标准。对照组鼠尾静脉注射生理盐水,只暴露颅骨,磨除外板,照射时间同上。
1.3 免疫组织化学检测:取各大鼠等部位切片3张,经二甲苯二级脱蜡各5min,梯度酒精脱水,3%双氧水室温10min,以消除内源性过氧化物酶,高压热修复,后滴加1∶100比例稀释的MMP-9一抗和p-MLC一抗4℃过夜,次晨取出置常温,PBS冲洗后,滴加二抗,37℃孵育1h,DAB显色,水冲洗后苏木素复染,脱水,透明,中性树胶封片。光镜下观察细胞核呈蓝色,阳性细胞肿胀,包浆黄染。在200倍显微镜下随机选取梗死区5个视野,用美国Media Cybernetics公司生产的Image-Pro-Plus图像分析系统照相后计算每个视野中阳性细胞数目。
1.4 Western blot 检测:用细胞裂解液提取各组各时间点大鼠梗死灶周围脑组织总蛋白,运用考马·斯亮蓝比色法测定各个样本蛋白含量,上样量为100μg蛋白。进行15% SDS-PAGE凝胶电泳,NC转膜,5%脱脂奶粉封闭;山羊抗MMP-9多克隆一抗(1∶500稀释)、山羊抗p-MLC多克隆一抗(1∶500稀释)、山羊抗actin多克隆一抗(1∶1 000稀释),4℃过夜,加入辣根过氧化物酶标记的山羊抗兔二抗(1∶1 000稀释)进行杂交。EcL发光剂3min,曝光、显影、定影。采用数码成像分析系统软件对Western blot结果进行定量分析。以目标的平均灰度值与内参的平均灰度值的比值大小作为分析对象进行比较。

2 结 果
2.1 MMP-9免疫组织化学染色结果:对照组可见少量被染成棕黄色的阳性细胞。与对照组相比,模型组和丁苯酞组梗死区周围阳性细胞数明显增加,差异有统计学意义(P<0.05),以24h增加最明显,3d后开始减少,7d后明显减少。但丁苯酞组阳性细胞数目明显少于模型组,差异有统计学意义(P<0.05)。见表1。
2.2 p-MLC免疫组织化学染色结果:对照组可见少量被染成棕黄色的阳性细胞。与对照组相比,模型组和丁苯酞组梗死区周围阳性细胞数明显增加,差异有统计学意义(P<0.05),与模型组比较,丁苯酞组阳性细胞数目明显减少,差异有统计学意义(P<0.05)。见表2。
2.3 MMP-9 Western bolt结果:与对照组相比,模型组大鼠梗死灶周围脑组织MMP-9含量明显增加,以24h p-MLC增加最明显,3d后开始减少,7d后明显减少。丁苯酞组p-MLC含量明显低于模型组,但高于对照组。见表3。
2.4 p-MLC Western bolt结果:与对照组相比,模型组大鼠梗死灶周围脑组织p-MLC含量明显增加,以24h p-MLC增加最明显,3d后开始减少,7d后明显减少。丁苯酞组p-MLC含量明显低于模型组,但高于对照组。见表4。
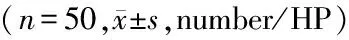

GroupsMMP-93h12h1d3d7dControl19.40±2.3019.60±2.7020.20±3.9621.00±2.8320.00±2.35Model28.60±2.70∗55.40±3.21∗111.80±2.95∗75.80±2.86∗27.40±3.21∗Butylphthalide23.00±2.92∗#41.80±2.59∗#86.20±1.92∗#48.00±4.58∗#22.00±2.55∗#
*P<0.05vscontrol group #P<0.05vsmodel group byANOVAofrepeatedmeasurementdata
MMP-9:matrix metalloproteinase-9
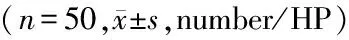

Groupsp-MLC3h12h1d3d7dControl41.40±4.1641.80±4.2142.20±4.4342.00±4.2442.60±3.36Model83.00±4.18∗101.80±4.97∗167.60±4.04∗142.60±3.36∗71.00±3.74∗Butylphthalide65.20±2.86∗#87.40±5.13∗#130.80±4.55∗#120.60±2.97∗#58.00±3.39∗#
*P<0.05vscontrol group #P<0.05vsmodel group byANOVAofrepeatedmeasurementdata
p-MLC:phosphorylation of myosin light chain
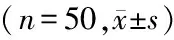
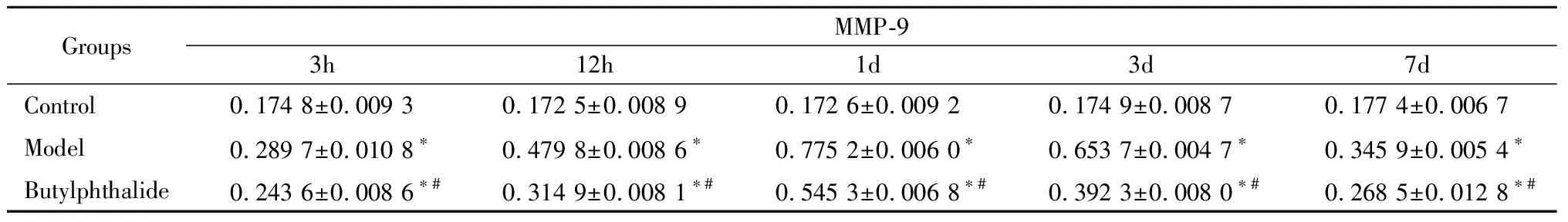
GroupsMMP-93h12h1d3d7dControl0.174 8±0.009 30.172 5±0.008 90.172 6±0.009 20.174 9±0.008 70.177 4±0.006 7Model0.289 7±0.010 8∗0.479 8±0.008 6∗0.775 2±0.006 0∗0.653 7±0.004 7∗0.345 9±0.005 4∗Butylphthalide0.243 6±0.008 6∗#0.314 9±0.008 1∗#0.545 3±0.006 8∗#0.392 3±0.008 0∗#0.268 5±0.012 8∗#
*P<0.05vscontrol group #P<0.05vsthe model group byANOVAofrepeatedmeasurementdata
MMP-9:matrix metalloproteinase-9
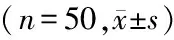
Groupsp-MLC3h12h1d3d7dControl0.181 9±0.007 80.183 7±0.006 40.184 5±0.005 90.184 7±0.004 80.185 7±0.006 6Model0.284 9±0.006 6∗0.482 8±0.006 3∗0.908 8±0.003 4∗0.692 4±0.005 3∗0.274 9±0.006 1∗Butylphthalide0.227 4±0.009 8∗#0.280 3±0.010 2∗#0.650 6±0.008 0∗#0.434 9±0.006 3∗# 0.235 8±0.005 8∗#
*P<0.05vscontrol group #P<0.05vsthe model group byANOVAofrepeatedmeasurementdata
p-MLC:phosphorylation of myosin light chain
3 讨 论
急性脑梗死是一种常见的缺血性脑血管病,其发病率、病死率和致残率均较高,严重危害着人类的生命和健康。脑水肿是急性脑梗死的一种继发性病理反应,可加重脑梗死症状,加重神经系统的损伤。减轻脑水肿可明显减轻神经系统的损伤,改善患者的预后,降低病死率和致残率。因此,探讨脑水肿的治疗对治疗急性脑梗死有非常重要的临床意义。目前对脑损害后脑水肿的治疗主要有限制入水量、脱水、抗自由基,应用激素、钙拮抗剂、兴奋性氨基酸受体拮抗剂、镁离子和脑细胞代谢功能活化剂[1]。本研究利用光化学法制造局灶性脑梗死大鼠模型,应用磁共振成像技术观察大鼠脑损伤后大脑T2像的变化,结果提示脑损伤后6h大鼠大脑皮层T2像即可见明显的高信号区,24h高信号区面积最大,而丁苯酞组T2像高信号区面积明显小于模型组,表明丁苯酞对急性脑梗死后脑水肿有明显的治疗作用。
MMP是一种Zn2+依赖性蛋白酶,主要参与调解细胞外的基质成分,临床上主要参与动脉粥样硬化、肿瘤转移、炎症反应等病理过程[2]。其中MMP-9主要存在于脑组织中,与脑血管病的关系最为密切。Lucivero等[3]研究发现脑梗死患者血清MMP-9浓度在梗死早期明显上升,1周后下降,但其下降后的水平仍高于对照组,与脑梗死的病情恶化过程相一致,可见MMP-9参与了脑梗死的病理过程。MMP-9可通过攻击脑血管外基膜的主要成分层黏蛋白和纤黏蛋白,破坏血脑屏障,导致血脑屏障通透性增高,从而加重脑水肿的形成。Gidday等[4]发现白细胞,特别是中性粒细胞是脑梗死后MMP-9的来源,而MMP-9能促进白细胞的募集,造成继微血管基底膜层黏蛋白水解后血氧屏障的破坏,最终导致神经元的损伤。另一方面,MMP-9的降解产物能使纤溶酶原水解,生成血管他汀,而血管他汀作为血管抑制性因子,具有对抗血管内皮生长因子进而抑制血管新生的作用[5-6],最终导致脑缺血后的神经损伤。研究[7]表明,MMP-9还参与脑梗死出血性转化的病理过程。Amantea等[8]利用原位酶谱法测定大脑中动脉梗死大鼠明胶酶活性,并使用MMP抑制剂GM600l,发现能明显减少脑梗死病灶。可见抑制MMP-9对脑梗死具有明显的治疗作用。MMP-9成为了人类研究脑梗死治疗的新靶点。本研究利用免疫组织化学和Western blot检测梗死灶周围皮层MMP-9含量变化提示,与对照组相比,急性脑梗死后梗死灶周围皮层MMP-9含量明显增加,急性脑梗死后6h MMP-9含量开始增加,1d增加最明显,3d MMP-9含量开始降低,7d MMP-9含量明显降低,与Lucivero等[3]研究基本一致。而丁苯酞组大鼠模型梗死灶周围皮层MMP-9的含量明显低于模型组,其中以7d效果最明显。提示丁苯酞可减少梗死灶周围皮层MMP-9的表达。具体机制可能如下:丁苯酞能明显减少梗死区中性粒细胞的数目,丁苯酞可通过减少中性粒细胞的数目来减少MMP-9的表达;丁苯酞具有保护线粒体、改善缺血区能量代谢、改善缺血区呼吸链的功能,丁苯酞可能通过减轻机体的氧化应激反应来减少MMP-9的表达。
肌球蛋白轻链(myosin light chain,MLC)是血管平滑肌细胞骨架结构的主要成分,参与维持细胞骨架结构的收缩力和细胞间连接的完整性。MLC磷酸化为p-MLC,可导致细胞骨架结构收缩力增强,内皮通透性增高,加重脑水肿的形成。MLC是Rho信号通路下游的主要蛋白,其磷酸化水平主要通过Rho信号通路进行调节[9]。王志等[10]研究表明,急性脑梗死后可通过多种途径激活Rho信号通路,导致肌球蛋白磷酸酶激活,进而导致Rho信号通路下游效应分子MLC磷酸化水平增高,肌动球蛋白的收缩性增加,使细胞收缩,从而破坏血管内皮细胞的屏障功能,导致血脑屏障通透性增高,加重脑水肿的形成。本研究显示急性脑梗死后MLC磷酸化水平明显增高,参与了急性脑梗死后脑水肿形成的病理过程。娄四龙等[11]研究提示应用Rho信号通路抑制剂法舒地尔可抑制MLC的磷酸化,进而可减轻脑损伤后脑水肿的形成。而本研究显示丁苯酞也可通过减少MLC的磷酸化来减轻脑水肿的形成。Doe等[12]发现,Rho 激酶抑制剂可能通过抑制巨噬细胞、白细胞介素6 mRNA 的转录,减少白细胞介素6、白细胞介素1和肿瘤坏死因子α等炎症细胞因子的产生。此外,丁苯酞具有抑制脑缺血患者血清C反应蛋白表达的作用[13]。而唐淑俊等[14]研究表明,炎性细胞因子和C反应蛋白与脑梗死后脑水肿的关系密切。推测丁苯酞可能正是通过抑制炎症反应的形成来抑制Rho激酶的激活,从而减少MLC的磷酸化水平和减轻脑水肿形成的。
综上所述,丁苯酞对局灶性脑梗死大鼠脑水肿有明显的治疗作用,丁苯酞可能是通过减少梗死灶周围MMP-9的表达,减轻MMP-9对脑血管层黏蛋白和纤黏蛋白的破坏,减轻血脑屏障的破坏,从而减轻脑水肿的形成。
[1] 曹翠芳.急性脑血管病脑水肿的治疗[J].河北医科大学学报,2006,27(5):520.
[2] ROSENBERG GA.Matrix metalloproteinases in neuroinflammation[J].Glia,2002,39(3):279-291.
[3] LUCIVERO V,PRONTERA M,MEZZAPESA DM,et al.Different roles of mamxmetalloproteinases-2 and -9 after human ischaemic stroke[ J ].Neurol Sci,2007,28(4):165-170.
[4] GIDDAY JM,GASCHE YG,COPIN JC,et al.Leukocyte-derived matrix metalloproteinase-9 mediates blood-brain barrier breakdown and is proinflammatory after transient focal cerebral ischemia[J].Am J Physiol Heart Circ Physiol,2005,289(2):558-568.
[5] CORNELIUS LA,NEHRING LC,HARDING E,et al.Matrix metalloproteinases generate angiostatin:effects on neovascularization[J].J Immunol,1998,161(12):6845-6852.
[6] CHUNG AW,HSIANG YN,MATZKE LA,et al.Reduced expression of vascular endothelial growth factor paralleled with the increased angiostatin expression resulting from the upregulated activities of matrix metalloproteinase-2 and -9 in human type 2 diabetic arterial vasculature[J].Circ Res,2006,99(2):140-148.
[7] 顾晔,刘振国.MMP-9与脑梗死出血性转化及研究进展[J].中国临床神经科学,2008,16(4):428-432.
[8] AMANTEA D,CORASANITI MT,MERCURI NB,et al.Brain regional and cellular localization of gelatinase activity in rat that have undergone transient middle cerebral artery occlusion[J].Neuroscience,2008,152(1):214-218.
[9] ZECHNER R,MADEO F.Cell biology: another way to get rid of fat[J].Nature,2009,458(7242):1118-1119.
[10] 王志,曹秉振.Rho/Rho激酶信号通路与缺血性脑血管病[J].国际脑血管病杂志,2008,16(5):375-379.
[11] 娄四龙,戴勤弼,毛德强.Rho激酶抑制剂在外伤性蛛网膜下腔出血后脑血管痉挛的疗效研究[J].临床神经外科杂志,2009,6(2):74-76.
[12] DOE C,BENTLEY R,BEHM DJ,et al.Novel Rho kinase inhibitors with anti-inflammatory and vasodilatory activities[J].J Pharmacol Exp Ther,2007,320(1):89-98.
[13] 朱海生.丁苯酞对慢性脑供血不足患者血清高敏C反应蛋白水平的影响[J].中华实用诊断与治疗杂志,2012,26(1):73-74.
[14] 唐淑俊,梅凤君.炎性细胞因子和C-反应蛋白在急性脑梗死中的变化及相关性研究[J].河北医科大学学报,2010,31(11):1347-1350.
