紫苏分离蛋白及主要蛋白组分功能性质研究
2014-03-14姜文鑫闵伟红谭雨青刘惠麟
姜文鑫 吴 丹 闵伟红 谭雨青 刘惠麟 方 丽
(吉林农业大学食品科学与工程学院1,长春 130118)(小麦和玉米深加工国家工程实验室2,长春 130118)
紫苏(Perilla Prutescens Linn,Britton)为1年生唇形科植物[1],在我国长白山地区较为丰富,是传统的药食两用植物。近年来研究表明紫苏具有多种生理功能[2-3]。如 Ha等[4]从紫苏种子中分离和鉴定了具有抑制α-葡聚糖苷酶活力的5种酚类化合物。IharaM等[5]对比了红花油和紫苏籽油对小鼠血脂的影响,发现紫苏籽油具有降血脂作用。Chang等[6]的研究证明了紫苏油能够降低小鼠血清中脂类和卵白蛋白IgG1含量,并且增加IgI的水平。Yang等[7]研究了紫苏叶提取物对肝中毒的影响,发现紫苏叶提取物具有保护肝脏的功能。以上研究主要集中在紫苏叶提取物和紫苏籽油的药用价值方面,而对紫苏蛋白的研究报道相对较少。
紫苏籽含油量为30%~51%,被广泛作为油料来源[8],紫苏粕是紫苏籽脱脂后的工业副产品,在生产加工过程中一般作为动物饲料或直接抛弃,造成了资源浪费和环境污染。脱脂后的紫苏粕蛋白质量分数可高达39%,而焙烤后的紫苏籽蛋白功效比值、净蛋白比值和真消化率分别为4.8%、79.8%、94.2%[9],因此紫苏籽蛋白是一种具有潜在开发价值的蛋白。本研究通过分离制备紫苏分离蛋白、谷蛋白、球蛋白和清蛋白,并对比分析分离蛋白和3种主要蛋白组分的功能性质,为紫苏蛋白的开发利用提供依据。
1 材料和方法
1.1 原料与试剂
脱脂紫苏粕:敦化广晟生物油脂有限公司。
5,5’ -二硫代-2-硝基苯甲酸(DTNB)、考马斯亮蓝R-250、考马斯亮蓝G-250、β-巯基乙醇、过硫酸铵、丙烯酰胺、10%SDS、聚乙二醇、溴酚蓝均购自Sigma公司;磷酸二氢钠、磷酸氢二钠、三氯乙酸等试剂均为国产分析纯。
1.2 仪器与设备
FD-1B-50型冷冻干燥机:北京博医康仪器有限公司;日立L-8900型氨基酸自动分析仪:日本日立公司;FE-20型实验室pH计:瑞士梅特勒-托利多集团;UV-1700型分光光度计:日本岛津;T-10均质机:德国IKA集团;SE-260型蛋白电泳仪:GE Healthcare Bio-Sciences AB;Z36HK高速冷冻离心机:德国HERMLE公司。
1.3 原料预处理与紫苏分离蛋白的制备
脱脂紫苏粕粉碎过40目筛,所得脱脂粉用乙醚溶剂在索式抽提装置中抽提6 h,通风橱内室温晾干,脱脂粉装入聚乙烯袋中,在-20℃储存备用。
紫苏分离蛋白通过碱溶酸沉法制备[10]。脱脂紫苏粉与蒸馏水 1∶20(m/V)混合,2 mol/L NaOH调节pH至10.0,60℃水浴1 h,5 000 r/min离心10 min,取上清液,1 mol/L HCl调至等电点 pH 4.4,5 000 r/min离心 10 min,沉淀水洗 3次,用 1 mol/L NaOH调至pH 7.0,冷冻干燥,即得分离蛋白,过60目筛4℃储存。
1.4 紫苏蛋白质组分的分级提取
紫苏分级蛋白按照Osborne法制备[11]:脱脂紫苏粉与蒸馏水以1∶10混合,搅拌1 h,离心取上清液,重复提取3次,合并上清液去沉淀1,调节 pH 4.2,离心取沉淀调节至中性,装入透析袋(分子质量8 000 ku)4℃透析3 d,聚乙二醇浓缩,冷冻干燥即得清蛋白;沉淀1用1 mol/L NaCl溶液1∶10提取,离心取上清液去沉淀2,重复提取3次,合并上清液,加入硫酸铵至50%饱和度,离心收集沉淀,处理过程同清蛋白;沉淀2用料液比1∶1070%乙醇提取3次,除去醇溶蛋白;沉淀继续用1∶10 0.02 mol/L NaOH提取,处理过程同1.3部分中分离蛋白的提取工艺,得谷蛋白。
1.5 化学组成分析
根据 GB 5009.5—2010、GB 5009.3—2010、GB 5009.4—2010分别测定蛋白、水分和灰含量。
1.6 二硫键和巯基含量测定
总巯基(SHT)和暴露巯基(SH0)根据 Beveridge等[12]法进行测定,二硫键(SS)根据 Thannhauser等[13]方法进行测定。总巯基和暴露巯基含量按式(1)计算,二硫键含量按式(2)计算。
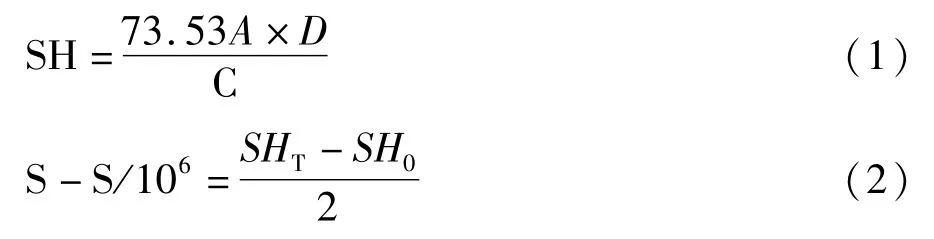
式中:A为412 nm处的吸光值;C为样品浓度mg/mL;D为稀释因子;73.53为 106/(1.36×104);1.36×104是摩尔吸光系数,106由从 mol转化为μmol/mL和从mg转化为g换算得来。
1.7 氨基酸组成分析
蛋白样品在含10 mmol/L苯酚和6 mol/L HCl的真空管中水解24 h。测定4种蛋白样品的氨基酸组分,氨基酸含量结果表达为g/100 g蛋白。营养参数和氨基酸来源根据 FAO/WHO(2007)[14]。
1.8 SDS-PAGE
SDS-PAGE在不连续的缓冲系统中进行,电泳凝胶由12%的分离胶和5%的浓缩胶组成[15]。
1.9 总糖和还原糖的测定
总糖类物质根据Yem等[16]的方法对样品进行预处理,还原糖采用3,5-二硝基水杨酸法测定[17]。
1.10 功能性质分析
1.10.1 蛋白溶解性
蛋白溶解性采用Aluko等[18]方法测定。上清液中蛋白含量通过考马斯亮蓝法测定[19],总蛋白含量通过微量凯氏定氮法测定。蛋白溶解性为上清液蛋白和总蛋白质量分数的百分比,按照(3)计算。

1.10.2 起泡性和起泡稳定性
起泡性和起泡稳定性根据Tao等[20]的方法测定。按照式(4)计算。起泡稳定性表示为储存30 min后的泡沫体积与之前的泡沫体积之比,按照式(5)计算。起泡性和起泡稳定性在pH 1~12范围内测量。
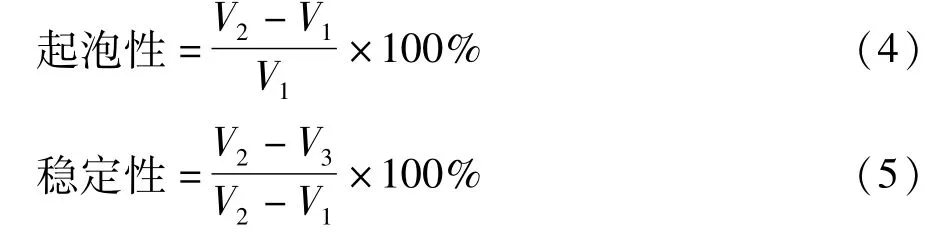
式中:V1为搅打前溶液的体积;V2为搅打后的总体积;V3为搅打后30 min的体积。
1.10.3 乳化性和乳化稳定性
乳化性和乳化稳定性根据Chau等[21]方法测定。乳化性为乳化层体积占总体积的百分比,按照式(6)计算。样品于80℃加热30 min后,冷却至室温,4 000 r/min离心5 min,乳化稳定性为加热后乳化层的高度占起初乳化层的高度的百分比,按照式(7)计算。
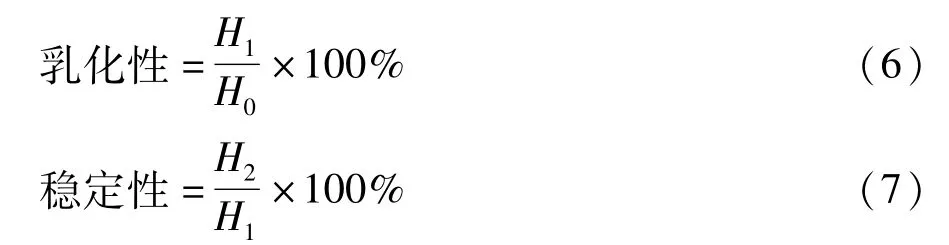
式中:H0为油水混合物起始高度;H1为乳化层高度;H2为30 min后乳化层高度。
1.10.4 持水和持油能力
持水和持油能力根据Tao等[20]的方法测定。按照式(8)计算每克样品水或油的保持量。

式中:m0为离心管质量;m1为样品质量;m2为持水/持油后的总质量。
1.11 统计分析
数据用Origin 7.5分析,所有试验为3个平行。
2 结果与讨论
2.1 紫苏蛋白的主要组成
表1为PAP、PGP、PLP和PPI 4种蛋白样品成分组成,蛋白质量分数分别为60.1%、82.9%、74.7%和86.1%。球蛋白的表面巯基和总巯基含量最高,分别为27.35μmol/g和36μmol/g大于其他蛋白,而谷蛋白的表面巯基和总巯基含量相对于其他3种蛋白最低,分别为 14.47μmol/g和 17.03μmol/g。表面巯基对蛋白溶解性呈正相关,这在溶解图谱也有体现,球蛋白在pH 1~12范围内的溶解性均高于谷蛋白。一般认为二硫键能够稳定蛋白构象中的折叠结构减少构象的熵,因此能够改善他们的热力学稳定性[22]。二硫键的数量在谷蛋白中最高,由此可以推测谷蛋白的热稳定性高于其他蛋白。

表1 紫苏4种蛋白主要组成
2.2 氨基酸分析
表2为紫苏分级蛋白和分离蛋白的氨基酸组成,由表2可知,紫苏蛋白中氨基酸种类相对全面,含有人体所需的7种必须氨基酸:苏氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸,和1种半必需氨基酸酪氨酸。必需氨基酸含量高于FAO/WHO(2007)推荐成年人必须氨基酸每日摄取量,但低于推荐的儿童每日摄入量,因此可以满足成年人对必需氨基酸的需求。在氨基酸或低聚肽的混合物中,支链氨基酸与芳香族氨基酸的物质的量比称为F值。高F制剂具有辅助治疗或减轻肝性脑病能够用于改善术后及卧床病人的蛋白营养状况、抗疲劳等功效[23]。表2显示的芳香族氨基酸(酪氨酸、苯丙氨酸、组氨酸、脯氨酸)含量相对较少,这表明紫苏蛋白是开发高F值制剂的潜在原料。
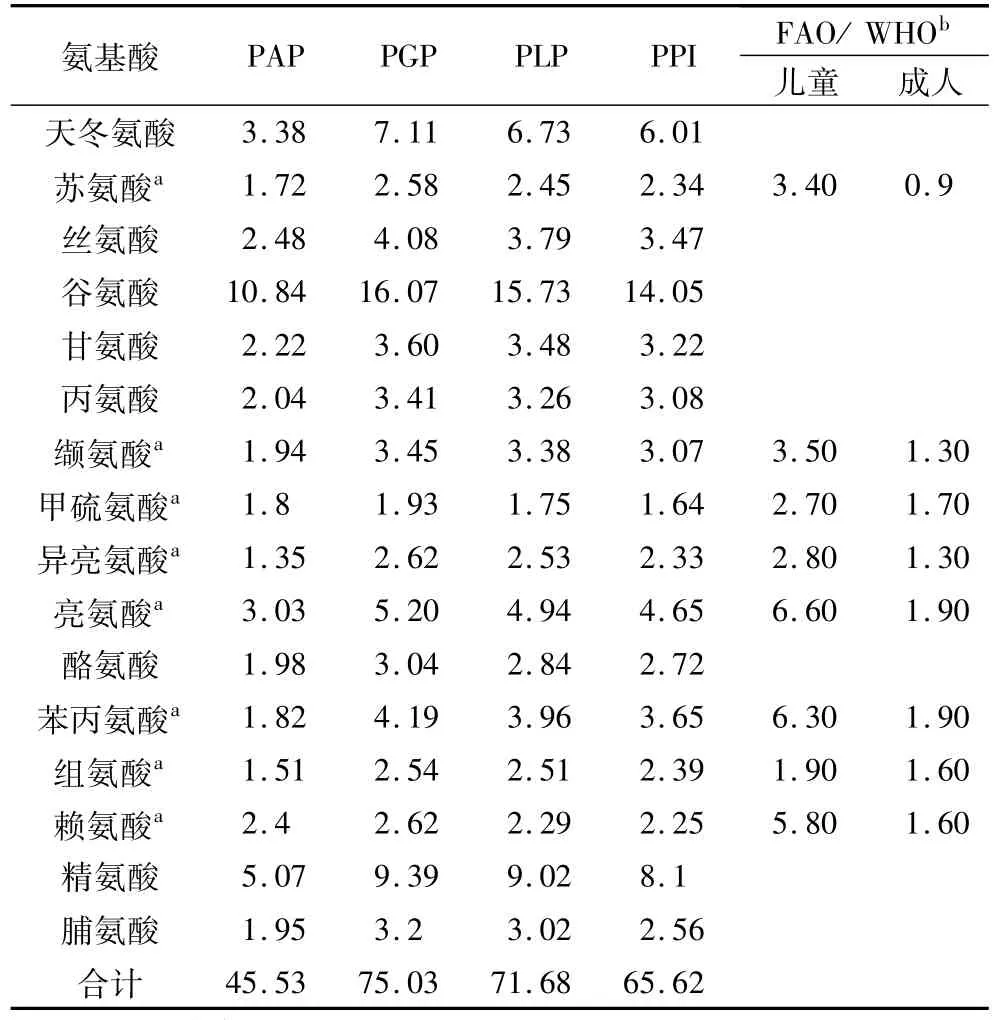
表2 紫苏蛋白氨基酸组成/%
2.3 SDS-PAGE分析
图1为SDS-PAGE图谱,该图谱显示紫苏各蛋白具有共同的亚基条带,这与木通蛋白中报道的结果相类似[24]。PAP(1泳道)包含了3条浓度较大的条带(10.5、20.1、27.8 ku)和2条较浅的条带(40.6、42.3 ku);PGP(2泳道)中主要包含分子质量为20.1、24.5、32.7和40.6 ku条带;PLP(4泳道)亚基条带分布与PGP基本相似,另外还包含2条与PPI(5泳道)相似的较浅条带(36.7、37.5 ku)。PPI包含了PAP、PGP和 PLP显示的所有亚基条带(10.5、20.1、24.5、27.8、32.7、36.7、37.5和 40.6 ku),这表明分级提取的蛋白是分离蛋白某种程度的细化。其中10.5、20.1、32.7和40.6 ku的条带浓度最大,为紫苏蛋白主要的亚基组成。
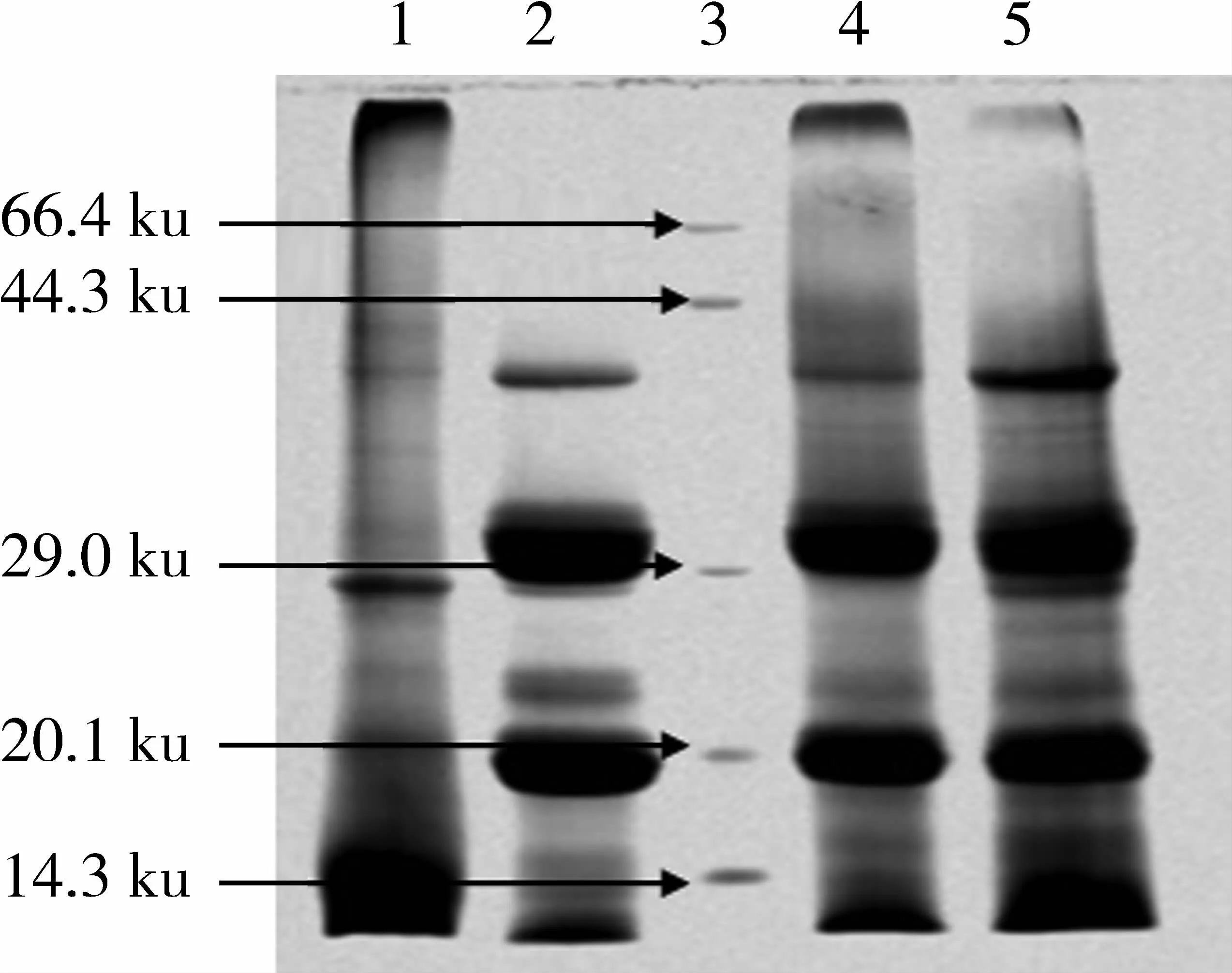
图1 紫苏4种蛋白凝胶电泳图
2.4 功能特性研究
2.4.1 蛋白溶解性
图2显示了pH 1~12范围内紫苏蛋白溶解性变化曲线,所有样品的溶解曲线均呈现相似U型趋势。PAP、PGP、PLP和PPI的溶解性在pH 1~4范围内随pH的增加溶解性逐渐减小,除PGP外均在pH 4.0时溶解性达到最小;PGP在pH 5.0时溶解性最小,这可能是因为组成蛋白分子的酸性亚基和碱性亚基的比例不同,导致了蛋白的等电点pH值也不相同,类似的现象出现在无患子蛋白[25]和非洲豆蛋白[26]的溶解性变化中。所有蛋白在pH大于等电点后溶解性逐渐增加,并在pH 12.0达到最大。随着pH远离等电点,蛋白分子延展程度增加,溶解性逐渐增大,然而在过酸或过碱的条件下,会引起蛋白结构的破坏,导致蛋白内部疏水基团暴露,使蛋白的溶解度下降,这可能是引起PLP在pH 1.0时溶解性下降的原因,相似的结果也在芝麻分离蛋白中观察到[27]。相对于另外3种蛋白,PAP表现了最大的溶解性93.39%,这可能与PAP中含有一些糖类物质有关(表2中显示PAP的糖类物质最高),糖类物质与蛋白结合会增大蛋白与水的结合能力。PGP、PLP、PPI的最大溶解性分别为88.35%、78.04%、85.19%。对比于其他蛋白,谷蛋白的溶解性相对较低,这一现象在也在木通种子谷蛋白中观察到[24]。

图2 pH对4种蛋白溶解性的影响
2.4.2 起泡性和起泡稳定性
图3显示了pH对4种蛋白起泡性和起泡稳定性的影响。PAP、PLP、PPI起泡性在pH 4.0时最低,分别为5.47%、4.05%、6.28%,与此同时PGP的起泡性在pH 5.0时达到最低为15.38%。PAP、PGP、PLP和PPI的起泡性最高值均在pH 12.0时被观察到,分别为15.26%、47.19%、53.68%和35.19%。其中PAP的起泡性在pH 4.0时最低(5.47%),在pH 12.0时最高(15.26%),通常来说良好的溶解性是蛋白起泡性的先决条件,然而相对PAP较高溶解性,PAP起泡性较低并且受pH影响不明显,这可能是因为PAP的平均疏水性较低,蛋白分子的柔性不适合在气-液界面展开和重排,另外PAP中含有较高的糖类化合物,糖类的存在通常会抑制蛋白的起泡沫性,类似的现象也出现在芸豆清蛋白中[28]。PGP在pH 1~3时显示了与其他3种蛋白相反的变化,这可能是过酸环境破坏了球蛋白分子的部分结构,因而降低了蛋白的起泡能力,这与芝麻分离蛋白的报道相一致[27]。4种蛋白的溶解性与起泡性在pH 2~12的范围内相关性非常明显,这可能由于pH的上升或减少增加了蛋白分子在溶液中的柔性,使其更加容易扩散到空气-水的界面上,因此提高了起泡性能力[29]。

图3 pH对4种蛋白起泡性的影响
图4显示了紫苏蛋白的起泡稳定性变化,PLP、PPI在pH 1~12范围内起泡稳定性变化相类似,并在pH 10.0时稳定性达到最大分别为89.69%和86.53%,随后逐渐下降,这可能是因为在过碱环境下,蛋白分子结构遭到破坏对气-液界面造成不稳定影响,同样现象也被报道在银杏的清蛋白、球蛋白和分离蛋白起泡稳定性变化中[24]。PGP在pH 5~10范围内与PLP、PPI的变化趋势基本一致,并在pH 10.0时稳定性达到最大93.62%,随后迅速降低。值的注意的是PAP的稳定性曲线有2个波峰,1个波峰在pH 10.0,另1个在pH 4.0,在碱性范围内,起泡稳定性的变化趋势类似于另外3种蛋白,而在pH 4.0时(即等电点附近),起泡稳定达到最高达72.2%,这是由于在等电点时蛋白分子间的排斥力很小,有利于蛋白分子相互作用,形成黏稠的吸附膜稳定较好[24],而另外3种蛋白在远离等电点时气泡稳定性增加,可能是因为随着蛋白浓度的增加,蛋白质分子在空气-水界面间的相互作用增强,提高了气泡稳定性[28]。

图4 pH对4种蛋白起泡稳定性的影响
2.4.3 乳化性及乳化稳定性
图5显示了4种蛋白乳化性与pH值的变化关系。其中PLP和PPI在pH 4.0时的乳化能力最低,分别为1.72%和24.22%;PAP和PGP的乳化性在pH 5.0时达到最低,分别为37.21%和31.91%。不同的蛋白达到最大乳化值的pH各不相同,其中PAP在pH 8.0时达到最高为41.39%。PAP的乳化性随pH变化不明显,这是因为当pH值远离等电点时,影响了氨基酸侧链的解离,产生了有利于乳浊液中稳定的静电斥力,避免了液滴的凝集,提高蛋白对水的结合能力,使乳化性增加[30]。当pH大于9.0时蛋白的部分发生了变性,使乳化能力减弱,类似结果也出现在银杏蛋白中[20],相同的解释也适用于另外3种蛋白。对于PAP乳化能力高于其他3种蛋白可能是PAP分子上高度亲水区和高度疏水区域是隔开的,所以乳化性相对较好,乳浊液的油滴直径更小[31]。PLP在pH 3~6范围内乳化性较低,这与谷蛋白的溶解性是密切相关的,结合PAP和PGP的溶解性变化趋势可以得出一个结论,良好的溶解性是乳化性的先决条件,但乳化性与溶解性并不成正相关关系,这一结论与Mcwatters等[32]的研究报道相一致。

图5 pH对4种蛋白乳化性的影响
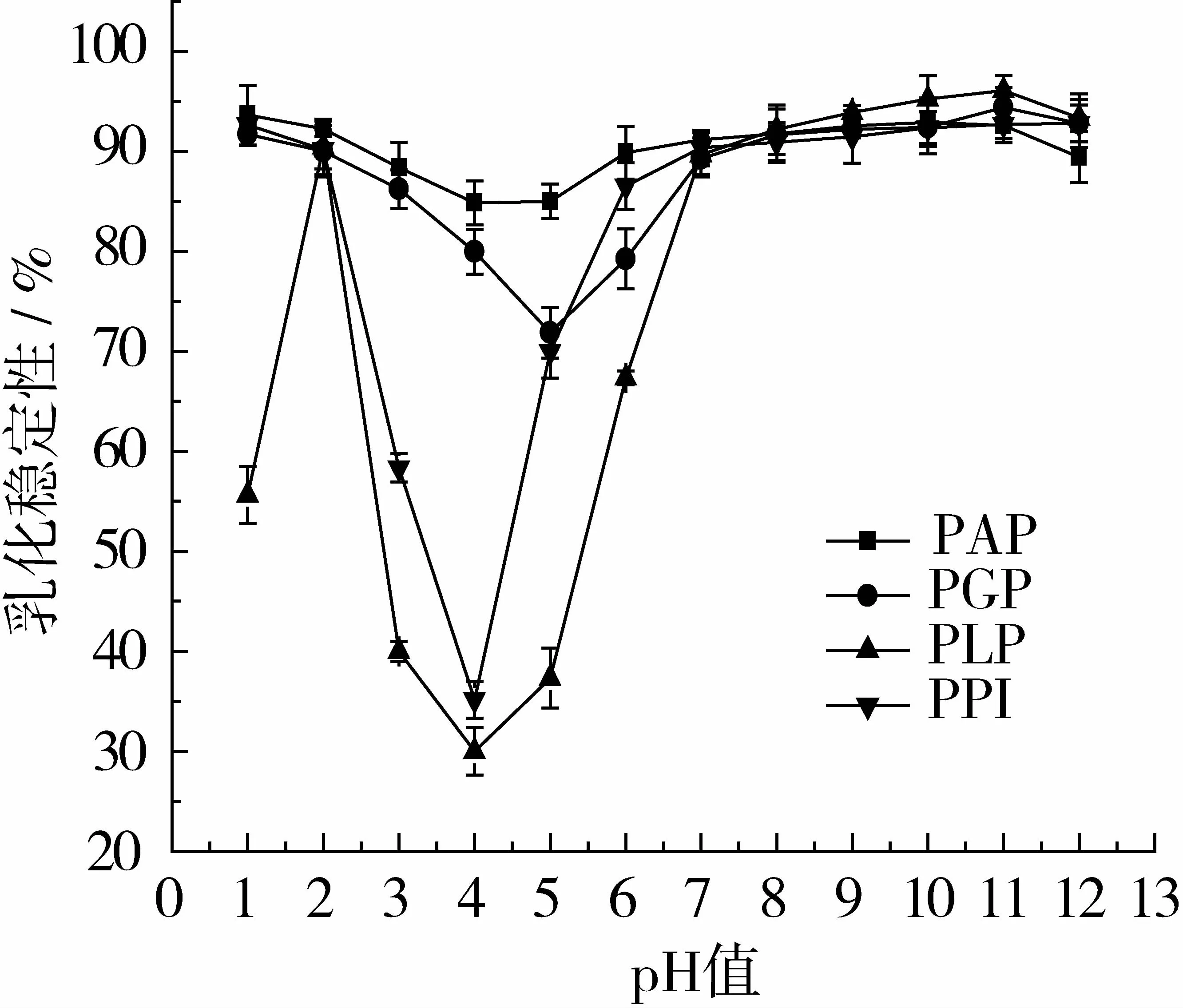
图6 pH对4种蛋白乳化稳定性的影响
由图6可以看出,乳化稳定性依pH的变化趋势与乳化性依pH的变化趋势相类似,这表明乳化性越高乳化稳定性越好。相类似的结论在之前的芸豆研究中也被报道[33]。PAP在pH 1.0时乳化稳定性最高为93.64%,这可能是因为PAP分子较小所以形成的乳化油滴直径更小,乳化微粒间库伦排斥力较大,因此乳化性相对较好。PPI的乳化稳定性最高值在pH 12.0时被观察到为92.76%。与此同时各蛋白的乳化稳定性最低值均在等电点处。
2.4.4 持水和持油性
蛋白持水性是指蛋白将水截留在组织中的能力,持水性对食品的嫩度、多汁性、柔软性具有重要的实际意义。从图7中可以看出,相比于其他3种蛋白,PAP的持水性最好为 3.81 mL/g;PGP、PLP、PPI的持水性分别为 1.77、3.05、2.96 mL/g。PAP的持水性高于PGP,类似的结果也体现在菜豆清蛋白和球蛋白的持水性对比中[33]。紫苏分离蛋白的持水性高于豇豆分离蛋白2.2 mL/g[34]和芝麻分离蛋白的2.1 mL/g[32]。早期的报道表明持水性在 1.49~4.72 mL/g范围内的蛋白适用于黏性食品[34],因此紫苏蛋白可以满足在食品高持水构造方面的应用,具有开发潜质。
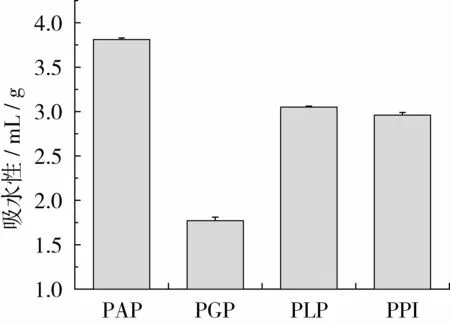
图7 PAP、PGP、PLP和 PPI的持水性
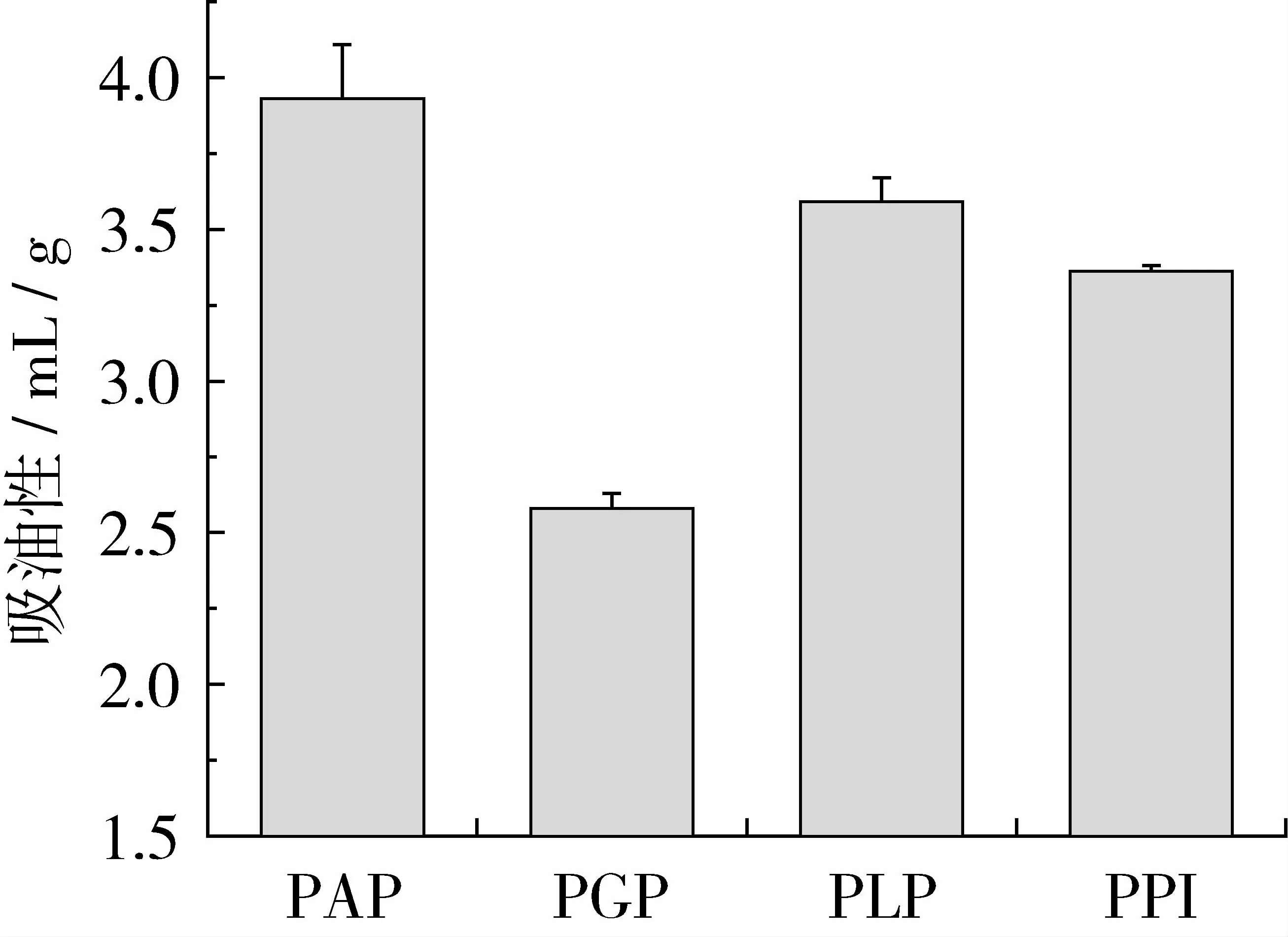
图8 PAP、PGP、PLP和 PPI的持油性
持油能力对乳化能力有直接影响,是非常具有实际价值的特性,例如在蛋黄酱制作中。由图8可知,PAP持油性最高为3.93 mL/g,这可能是因为相比于其他蛋白,具有更加开放的分子结构,PGP持油性为 2.58 mL/g,高于红小豆球蛋白 1.4 mL/g[29]和菜豆球蛋白1.87 mL/g[33]。PLP的持油能力为 3.59 mL/g,PPI的持油能力是3.36 mL/g,2种蛋白持油性均高于豇豆分离蛋白的1.10 mL/g[34]和蚕豆分离蛋白的 2.31 mL/g[35]。对比于其他植物蛋白,紫苏蛋白尤其清蛋白部分,持水性、持油性普遍高于其他植物蛋白,因此在食品加工体系添加用于改善食品的品质具有良好的前景,例如在炸面包圈、香肠、冰淇淋等食品的工过程中。
3 结论
本试验对比研究了Osborne法提取的清蛋白、球蛋白、谷蛋白与紫苏分离蛋白的功能性质,结果表明紫苏蛋白的功能性受pH因素影响较大。PAP的溶解性、持水性、持油性、乳化性较好;PGP的氨基酸组成较为合理,巯基含量相对较高,起泡稳定性最好;PLP的起泡性和乳化稳定表现最好,二硫键含量较高,PPI中包含了另3种蛋白的所有条带,并且所有性质均处在分级蛋白的范围之间,因此实际应用中可以根据不同性质的需要选择相应的蛋白。相对于其他植物蛋白,紫苏蛋白具有相对全面和较好的物理和化学性质,具备食品应用的开发潜质。
[1]Mukerjee SK.A revision of the Labiateae of the Indian Empire[J].Records of Botanical Survey,1940,14(1):186
[2]Park H-Y,Nam M-H,Lee H-S,et al.Isolation of caffeic acid from Perilla frutescens and its role in enhancingγglutamylcysteine synthetase activity and glutathione level[J].Food chemistry,2010,119(2):724-730
[3]Yi L-T,Li J,Geng D,et al.Essential oil of Perilla frutescens-induced change in hippocampal expression of brainderived neurotrophic factor in chronic unpredictable mild stress in mice[J].Journal of Ethnopharmacology,2013(3):177-180
[4]Ha T J,Lee JH,Lee M H,et al.Isolation and identification of phenolic compounds from the seeds of Perilla frutescens(L.)and their inhibitory activities againstα-glucosidase and aldose reductase[J].Food chemistry,2012,135(3):1397
[5]Ihara M,Umekawa H,Takahashi T,et al.Comparative effects of short-and long-term feeding of safflower oil and perilla oil on lipid metabolism in rats[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,121(2):223-231
[6]Chang H H,Chen C S,Lin JY.Dietary perilla oil lowers serum lipids and ovalbumin-specific IgG1,but increases total IgE levels in ovalbumin-challenged mice[J].Food and Chemical Toxicology,2009,47(4):848-854
[7]Yang SY,Hong C O,Lee H,et al.Protective effect of extracts of Perilla frutescens treated with sucrose on tert-butyl hydroperoxide-induced oxidative hepatotoxicity in vitro and in vivo[J].Food chemistry,2012,133(4):337-343
[8]郭新竹,宁正祥.保健食用油一紫苏油研究进展[J].食品科技,2001,4(1):6-7
[9]Longvah T,Deosthale Y.Effect of dehulling,cooking and roasting on the protein quality of Perilla frutescens seed[J].Food chemistry,1998,63(4):519-523
[10]谢超,朱国君,赵国华.紫苏饼粕浓缩蛋白的制备及理化性质研究 [J].中国粮油学报,2009,24(11):83-86
[11]朱淑云董英 陈晓东,等.水飞蓟粕蛋白氨基酸组成及加工功能特性研究[J].中国粮油学报,2011,26(8):71-74
[12]Beveridge T,Toma S,Nakai S.Determination of SH and SS groups in some food proteins using Ellman's reagnt[J].Journal of Food Science,1974,39(1):49-51
[13]Thannhauser TW,Konishi Y,Scheraga H A.Analysis for disulfide bonds in peptides and proteins[J].Methods in enzymology,1987,143(1):115-119
[14]Who J.Protein and amino acid requirements in human nutrition[J].World Health Organization technical report series,2007,12(1):935-939
[15]Laemm li U K.Cleavage of saturated proteins during the assembly of the head ofbacteriophage T4[J].Nature,1970,227(1):680-685
[16]Yemm E,Willis A.The estimation of carbohydrates in plant extracts by anthrone[J].Biochemical Journal,1954,57(3):508
[17]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究 [J].食品科学,2008,29(8):534-536
[18]Aluko R,Yada R.Structure-function relationships of cowpea(Vigna unguiculata)globulin isolate:influence of pH and NaCl on physicochemicaland functional properties[J].Food chemistry,1995,53(3):259-265
[19]Bradford M M.A rapid and sensitivemethod for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Analytical biochemistry,1976,72(1):248-254
[20]Sze-Tao K,Sathe S.Functional properties and in vitro digestibility of almond(Prunus dulcis L.)protein isolate[J].Food chemistry,2000,69(2):153-160
[21]Chau C,Cheung P.Functional properties of flours prepared from three Chinese indigenous legume seeds[J].Food chemistry,1998,61(4):429-433
[22]管斌,林洪,王广策.食品蛋白质化学 [M].化学工业出版社,2005
[23]Pedroche J,Yust M M,Lqari H,et al.Production and characterization of casein hydrolysates with a high amino acid Fischer's ratio using immobilized proteases[J].International dairy journal,2004,14(6):527-533
[24]Du Y,Jiang Y,Zhu X,et al.Physicochemical and functional properties of the protein isolate and major fractions prepared from Akebia trifoliata var.australis seed[J].Food chemistry,2012,133(3):923-929
[25]Ogunwolu S,Henshaw F,Hans-Mock P.Functional properties of protein concentrates and isolates produced from cashew(Anacardium occidentale L.)nut[J].Food and Chemical,2009,115(3):852-858
[26]Lawal O,Adebowale K,Ogunsanwo B,et al.On the functional properties of globulin and albumin protein fractions and flours of African locust bean(Parkia biglobossa)[J].Food chemistry,2005,92(4):681-691
[27]Khalid E,Babiker E,El Tinay A.Solubility and functional properties of sesame seed proteins as influenced by pH and/or salt concentration[J].Food chemistry,2003,82(3):361-366
[28]Pedroche J,Yust M,Lqari H,et al.Brassica carinata protein isolates:chemical composition,protein characterization and improvement of functional properties by protein hydrolysis[J].Food chemistry,2004,88(3):337-346
[29]Meng G,Ma CY.Characterization of globulin from Phaseolus angularis(red bean)[J].International journal of food science&technology,2002,37(6):687-695
[30]Fidantsi A,Doxastakis G.Emulsifying and foaming properties of amaranth seed protein isolates[J].Colloids and surfaces B:Biointerfaces,2001,21(1):119-124
[31]Hailing P J,Walstra P.Protein-stabilized foams and emulsions[J].Critical Reviews in Food Science&Nutrition,1981,15(2):155-203
[32]Mcwatters K,Holmes M R.Influence of pH and salt concentration on nitrogen solubility and emulsification properties of soy flour[J].Journal of Food Science,1979,44(3):770-773
[33]Mundi S,Aluko R.Physicochemical and functional properties of kidney bean albumin and globulin protein fractions[J].Food Research International,2012,48(1):299-306
[34]Ragab DM,Babiker E E,Eltinav A H.Fractionation,solubility and functional properties of cowpea(Vigna unguiculata)proteins as affected by pH and/or salt concentration[J].Food chemistry,2004,84(2):207-212
[35]Vioque J,Alaiz M,Giron-Calle J.Nutritional and functional properties of Vicia faba protein isolates and related fractions[J].Food chemistry,2012,132(1):67-72.
