微波辅助Osborne法提取米糠谷蛋白及对其性质的影响
2022-02-12肖志刚段庆松段玉敏朱旻鹏高育哲
肖志刚,段庆松,段玉敏,朱旻鹏,苏 爽,何 东,高育哲
(1.沈阳师范大学 粮食学院,沈阳 110034; 2.沈阳师范大学 学前与初等教育学院,沈阳 110034)
米糠是稻米加工过程的主要副产物,主要由果皮、种皮、胚乳和糊粉层组成[1]。米糠中蛋白质含量丰富,占10%~16%。米糠蛋白组成为清蛋白、球蛋白、谷蛋白和醇溶蛋白,含量分别为37%、36%、22%、5%[2],其中,谷蛋白作为米糠中主要的不溶性蛋白,较清蛋白、球蛋白和醇溶蛋白具有较高的必需氨基酸含量[3],研究米糠谷蛋白的提取对于探索其在食品领域的应用具有重要意义。
目前提取米糠谷蛋白的主要方法为Osborne法,该方法是根据蛋白质在不同pH条件下的溶解性不同且等电点处溶解度最低的特点,采取碱溶酸沉法将多种蛋白质分级提取出来,但Osborne法分离米糠谷蛋白的提取率较低[4]。提取前对米糠进行辅助处理有助于提高蛋白的提取率。微波可渗透分子内部,增加分子运动,对氢键、疏水键产生作用,从而改变蛋白质的构象与活性。本试验采用微波对米糠进行预处理后,利用Osborne法提取米糠谷蛋白,确定最优提取条件,并将微波、未微波处理提取的米糠谷蛋白结构及功能性质进行比较,为米糠谷蛋白的开发和应用提供理论支撑。
1 材料与方法
1.1 试验材料
龙粳31号大米米糠(水分含量11.92%),辽宁盛宝天隆米业。SDS-PAGE凝胶电泳试剂盒,考马斯亮蓝R-250,十二烷基硫酸钠,盐酸胍,5,5-二硫基-2,2-二硝基苯甲酸,其他试剂均为分析纯。
DWF-100型电动粉碎机,GL-21M高速冷冻离心机,Ntcolet 5DXC红外光谱仪,SU3500扫描电镜,DELTA320型pH 计,MAS-II PLUS常压微波萃取仪,SRD-200凯氏定氮仪,F97荧光分光光度计,J810圆二色谱仪。
1.2 试验方法
1.2.1 微波辅助Osborne法提取米糠谷蛋白
根据Osborne[2]的分级原理并加以修改。将新鲜米糠过0.28 mm(50目)筛,称取50 g于200 mL蒸馏水中,在一定的微波功率、微波时间和微波温度下对米糠进行微波处理,再根据Osborne法进行谷蛋白提取。采用GB 5009.5—2016凯氏定氮法测定谷蛋白含量,按公式(1)计算米糠谷蛋白提取率(Y)。
Y=m1/m×100%
(1)
式中:m1为提取液中谷蛋白含量;m为原料中谷蛋白含量。
1.2.2 米糠谷蛋白扫描电镜分析
将米糠谷蛋白冷冻干燥处理,并用扫描电镜对米糠谷蛋白进行形貌观察。将待观察的样品涂在导电胶带上,并涂上一层5 mm厚的金属,设置电压5 kV,于500×放大倍数下选择合适视野,拍摄米糠谷蛋白形貌特征。
1.2.3 米糠谷蛋白结构分析
1.2.3.1 红外光谱分析
将1 mg米糠谷蛋白样品与100 mg溴化钾混匀,压制成片进行红外光谱分析,光谱扫描范围为400~4 000 cm-1,分辨率为4 cm-1。
1.2.3.2 圆二色谱分析
参考文献[7]的方法并加以改进。取10 mg待测样品,加入10 mL磷酸盐缓冲溶液(pH 7.5,0.005 mol/L),充分混合之后,将溶液倒入吸收池,将其放在圆二色谱仪中扫描,以190~250 nm作为扫描范围,扫描速度100 nm/min,利用Spectra Analysis软件对图谱进行函数平滑,利用仪器附带Jasco二级结构估值程序估算待测样品的二级结构。
1.2.4 米糠谷蛋白的功能性质分析
1.2.4.1 溶解性测定
准确称取2 g的米糠谷蛋白溶于10 mL蒸馏水中,调pH为7.0,室温搅拌1 h,于8 000 r/min离心20 min,然后用凯氏定氮法测定上清液的含氮量。溶解性用氮溶指数表示,按公式(2)计算。
INS=x1/x×100%
(2)
式中:INS为氮溶指数值;x1为上清液含氮量;x为样品总含氮量。
1.2.4.2 持水性和持油性测定
称取0.1 g米糠谷蛋白溶于5 mL 0.05 mol/L磷酸盐缓冲溶液或大豆油中,室温下涡旋3 min,于5 000 r/min离心20 min,称取离心后沉淀的质量。按照公式(3)计算持水性(y1)或持油性(y2)。
(3)
式中:m为米糠谷蛋白的质量;m1为离心后沉淀的质量。
1.2.4.3 乳化活性及乳化稳定性测定
采用文献[8]方法进行测定。称取0.2 g米糠谷蛋白溶于20 mL 0.05 mol/L磷酸盐缓冲溶液,混匀,从中取15 mL与5 mL大豆油混合,以10 000 r/min均质3 min。将50 μL的底部乳液与5 mL 0.1%的SDS完全混合,然后在500 nm处测定吸光度(A0)(对照组为0.1%SDS)。静置10 min后再次从底部各取50 μL样品,用5 mL 0.1%SDS溶液稀释,测定吸光度(A10)。乳化活性(IEA)和乳化稳定性(IES)分别按公式(4)和公式(5)计算。
(4)
(5)
式中:N为稀释倍数;φ为体系中油相体积分数;C为样品溶液中蛋白质质量浓度;ΔT为两次间隔时间差。
1.2.4.4 起泡性及泡沫稳定性测定
采用文献[9]的方法进行测定,并加以修改。准确称量0.2 g米糠谷蛋白与20 mL 0.05 mol/L pH 7.0磷酸盐缓冲溶液于50 mL烧杯中混匀。使用均质机以10 000 r/min均质3 min,测均质后液面体积(V0),在室温下静置30 min后再读取液面体积(V30)。起泡性(H1)和泡沫稳定性(H2)分别按照公式(6)和公式(7)计算。
(6)
(7)
1.2.5 米糠谷蛋白表面疏水性的测定
参考文献[10]方法采用ANS探针法测定米糠谷蛋白的表面疏水性。用磷酸缓冲溶液(0.05 mol/L,pH 7.0)制备8 mmol/L ANS溶液,加入一定量的米糠谷蛋白,使其充分溶解,在8 000 r/min下离心20 min,除去沉淀,以Lowery法计算米糠谷蛋白质量浓度。通过磷酸缓冲溶液的稀释,得到质量浓度分别为0.05~0.15 mg/mL的米糠谷蛋白溶液,取40 μL ANS溶液滴加至不同质量浓度的米糠谷蛋白溶液中,避光静置15 min,然后进行测试。测试条件为激发波长390 nm,发射波长470 nm,扫描夹缝5 nm,扫描速率10 nm/s。将荧光强度与米糠谷蛋白质量浓度做线性图,以初始段的斜率值计为米糠谷蛋白的表面疏水性。
1.2.6 数据处理与分析
采用Origin软件进行数据分析和图表处理,采用SPSS.24软件进行显著性分析。
2 结果与分析
2.1 单因素试验
2.1.1 微波功率对米糠谷蛋白提取率的影响
在微波时间15 min、微波温度35℃条件下,考察微波功率对米糠谷蛋白提取率的影响,结果见图1。
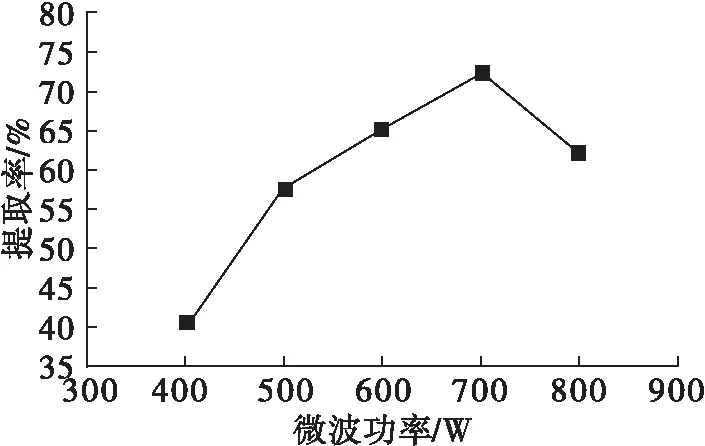
图1 微波功率对米糠谷蛋白提取率的影响
由图1可知,随微波功率的增加,米糠谷蛋白提取率不断增加,在微波功率为700 W时达到最高(72.5%)。这可能是在微波处理时,米糠细胞壁被破碎,内部氢键以及二硫键被破坏,蛋白质易于溶出,谷蛋白提取率升高。微波功率超过700 W后,米糠谷蛋白提取率降低。因此,选定微波功率为700 W。
2.1.2 微波时间对米糠谷蛋白提取率的影响
在微波功率700 W、微波温度35℃条件下,考察微波时间对米糠谷蛋白提取率的影响,结果见图2。
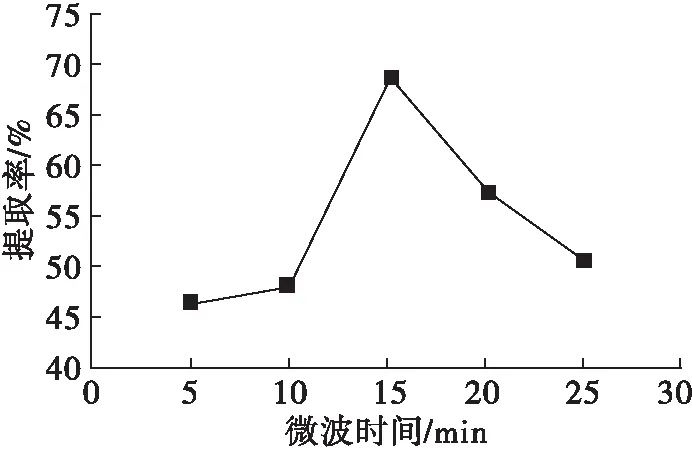
图2 微波时间对米糠谷蛋白提取率的影响
由图2可知,随微波时间的延长,米糠谷蛋白提取率呈现先增加后降低的趋势,在微波时间超过15 min后,米糠谷蛋白提取率不断降低。原因是在微波的作用下,微波时间过长,蛋白质分子氢键以及基团发生改变,内部疏水基团暴露出来,疏水残基相互作用形成网络结构,蛋白质难以溶出,使谷蛋白提取率降低。因此,选定微波时间为15 min。
2.1.3 微波温度对米糠谷蛋白提取率的影响
在微波时间15 min、微波功率700 W条件下,考察微波温度对米糠谷蛋白提取率的影响,结果见图3。
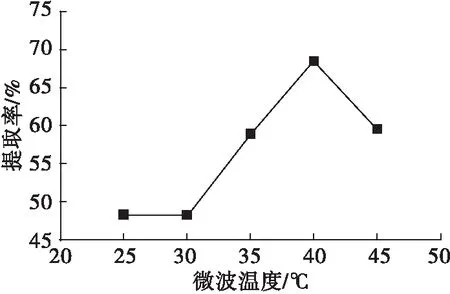
图3 微波温度对米糠谷蛋白提取率的影响
由图3可知,随微波温度的升高,米糠谷蛋白提取率呈现不断升高的趋势,在40℃时米糠谷蛋白提取率达到最大,之后继续升高温度,米糠谷蛋白提取率下降。在微波作用下,随着温度的升高蛋白质结构变得疏松,蛋白质中二硫键被破坏,促进蛋白质的溶解,从而提高了蛋白提取率。因此,选定微波温度为45℃。
2.2 正交试验
根据单因素试验结果,采用三因素三水平的正交试验对米糠谷蛋白提取参数进行优化,正交试验因素水平见表1,正交试验设计与结果见表2。

表1 正交试验因素水平
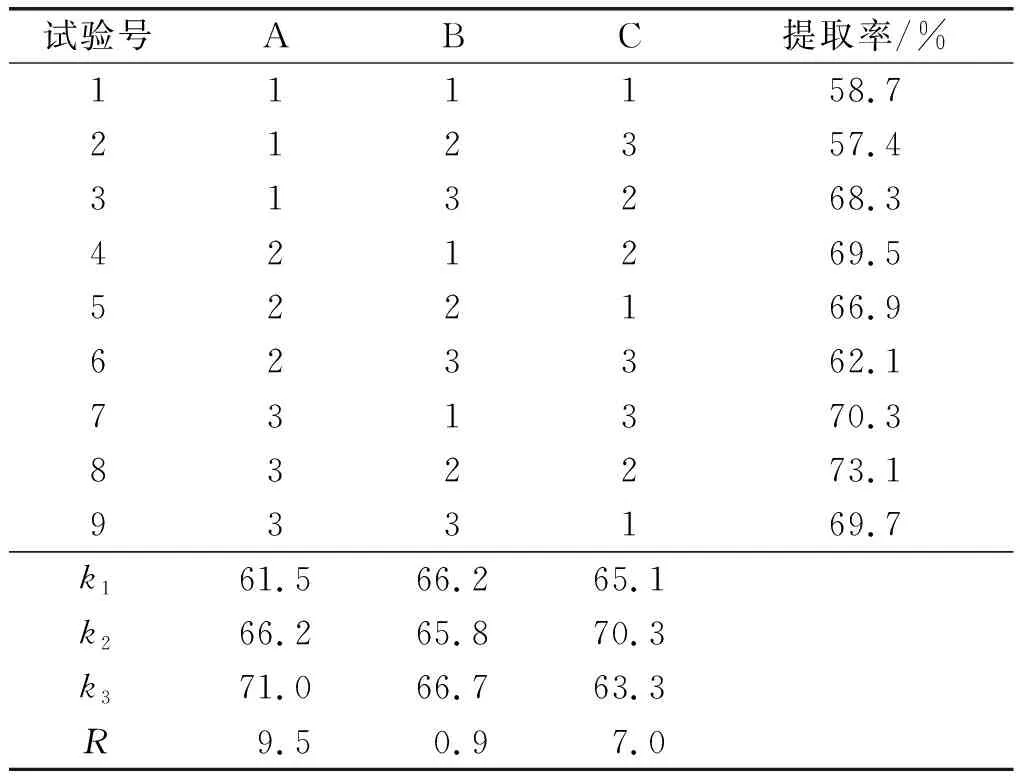
表2 正交试验设计与结果
由表2可见,各因素对米糠谷蛋白提取率影响大小依次为A>C>B,即微波功率>微波温度>微波时间,最优方案为A3B3C2。结合单因素试验结果,最终确定最优工艺方案为A3B2C2,即微波功率800 W、微波时间15 min、微波温度40℃。在最优方案下,米糠谷蛋白提取率为73.1%。
2.3 微波处理对米糠谷蛋白性质的影响
2.3.1 微波处理前后米糠谷蛋白的扫描电镜图
采用扫描电镜观察微波处理前后米糠谷蛋白表面形貌,结果见图4。

图4 微波处理前后米糠谷蛋白扫描电镜图
由图4可知,米糠谷蛋白表面多孔,经过微波处理后蛋白表面孔隙增大,其原因可能与微波处理后碱液提取的米糠谷蛋白非共价键的相互作用增强有关。
2.3.2 微波处理对米糠谷蛋白结构的影响
图5是微波处理前后米糠谷蛋白的红外光谱图,表3为米糠谷蛋白的圆二色谱测定结果。由图5可见,微波处理前后的米糠谷蛋白的红外光谱图走势相似,但在二级结构上存在很大差异。米糠谷蛋白在1 700 cm-1附近的振动峰是由C—N伸缩振动和N—H面内变形振动所形成的α-螺旋和β-折叠,在3 000 cm-1附近的振动峰均是由 —CH2和 —CH3伸缩振动引起的。蛋白的二级结构中α-螺旋和β-折叠是比较有序的蛋白结构,具有较高的稳定性[15]。由表3可知,微波处理后,米糠谷蛋白α-螺旋和β-转角向β-折叠转移,β-折叠含量明显提高,因此微波处理后的米糠谷蛋白有较高的稳定性。
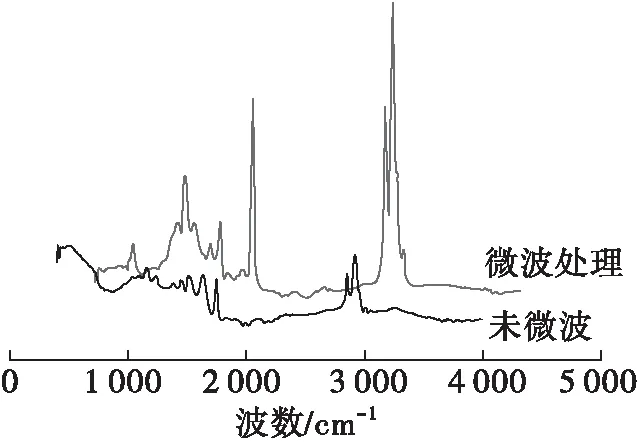
图5 微波处理前后米糠谷蛋白的红外光谱图

表3 米糠谷蛋白的圆二色谱测定结果%
2.3.3 微波处理对米糠谷蛋白功能性质的影响(见表4)
米糠谷蛋白是具有较大空间结构的大分子类物质,分子内的大量基团在受到外界影响时会发生某些变化,进而影响其功能性质[11]。由表4可知,米糠经过微波处理后所提取的米糠谷蛋白功能性质发生改变,溶解性提高了8.12百分点,持水性升高了0.89百分点,持油性降低了0.84百分点。郝天舒等[12]研究发现,微波处理提高了米糠蛋白的溶解性,可能是与蛋白氨基酸分布有关。米糠经过微波处理后,米糠谷蛋白二级结构被破坏,导致亲水基团暴露,加剧了蛋白质分子的氢键和离子基团的水合作用,蛋白持水性升高。微波处理后米糠谷蛋白起泡性增加了20.41百分点,泡沫稳定性则降低了21.66百分点。这可能是因为微波处理后,米糠谷蛋白结构展开,更易吸附到空气-水界面上,形成泡沫,这与Adam等[13]的研究结果一致。微波处理后,米糠谷蛋白乳化稳定性增加了5.50百分点,但乳化活性降低了4.61百分点,这可能是微波处理破坏了米糠谷蛋白结构,致使疏水基团疏远水相,从而降低了乳化活性[14]。

表4 微波处理对米糠谷蛋白功能性质的影响
2.3.4 微波处理对米糠谷蛋白表面疏水性的影响(见图6)
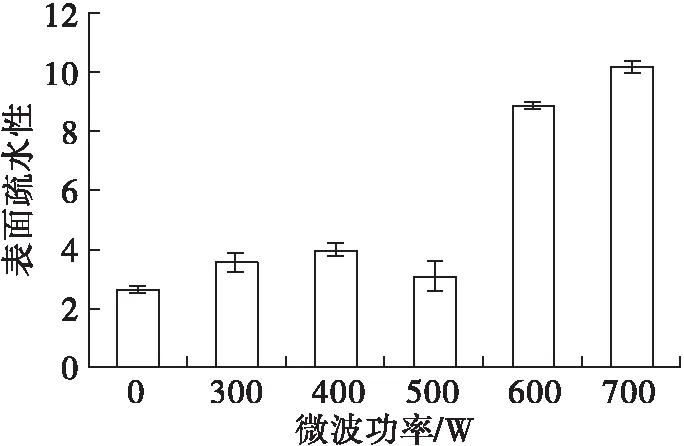
图6 微波功率对米糠谷蛋白表面疏水性的影响
由图6可知,随着微波功率的增加,米糠谷蛋白表面疏水性总体逐渐增加,且均高于未微波处理的。表明微波处理后,蛋白质结构展开,内部的疏水基团暴露于蛋白质分子表面。
3 结 论
本研究采用微波辅助Osborne法提取米糠谷蛋白,在微波功率800 W、微波时间15 min、微波温度40℃条件下,米糠谷蛋白提取率达到73.1%。微波处理后米糠谷蛋白α-螺旋和β-转角向β-折叠转移,β-折叠含量明显提高。微波处理后,米糠谷蛋白的溶解性提高了8.12百分点,持水性升高了0.89百分点,起泡性增加了20.41百分点,乳化稳定性增加了5.50百分点,持油性降低了0.84百分点,乳化活性降低了4.61百分点,泡沫稳定性降低了21.66百分点。米糠谷蛋白表面疏水性随微波功率增加总体逐渐增大。本研究可为米糠谷蛋白的工业化制备及在各种食品配方中的应用提供理论支撑。
