4种抗性淀粉的益生作用及结构变化
2014-03-14曾红华易翠平
谢 涛 曾红华, 汪 婕, 易翠平
(湖南工程学院化学化工学院1,湘潭 411104)
(长沙理工大学化学与生物工程学院2,长沙 410015)
微生态学研究发现,在健康人体消化道内有细菌约500多种,其数量达100兆以上,其中双歧杆菌是肠内最有益的菌群,可以预防便秘、防治心血管疾病,增强免疫力等[1]。由于益生元可以促进体内双歧杆菌等益生菌的增长,有益于人体肠道健康,因此对于益生元的研究也越来越多。抗性淀粉作为一种新型的益生元制剂,具有来源广泛、制备工艺简单、口感好等优点,在国外已被广泛研究[2-4]。Morais等[5]研究了抗性淀粉对猪肠道吸收钙、铁、锌离子的影响,结果表明,抗性淀粉明显促进了猪肠道对钙离子和铁离子的吸收。Bird等[6]证实抗性淀粉有助于短链脂肪酸的生成,影响肠道细菌的生长。Cummings等[7]研究抗性淀粉在人体大肠的消化和生理特性,结果表明抗性淀粉增加了粪便湿重,促进了短链脂肪酸的生成,而且大部分抗性淀粉在大肠内被消化吸收。Yamada等[8]研究富含抗性淀粉的面包对人体餐后血糖的影响,结果显示富含抗性淀粉的面包具有预防糖尿病,可以作为一个有效的食疗方法。本研究采用体外模拟试验对绿豆、马铃薯、锥栗和板栗抗性淀粉的益生作用及结构变化进行了研究,以期将这几种抗性淀粉成功开发为新一代益生元产品打下重要的理论与实践基础,填补国内在这方面的研究空白。
1 材料与方法
1.1 材料与仪器
选择性培养基:麦康凯琼脂培养基(大肠杆菌)、甘露醇氯化钠琼脂培养基(双歧杆菌)、LAMVAB琼脂培养基(乳酸杆菌)、麦芽糖琼脂培养基(粪肠球菌)、亚硫酸盐-环丝氨酸琼脂培养基(梭状杆菌)、甘露醇琼脂培养基(产气荚膜梭菌)、需氧-厌氧菌琼脂培养基:美国Life Tech公司;耐热α-淀粉酶、糖化酶:Sigma公司。
Flash GO自动菌落计数仪:西班牙IUL公司;UV-1800型紫外可见分光光度计:日本岛津公司;S-570型扫描电子显微镜:日本日立公司;D/max2500全自动X射线衍射仪:日本理学株式会社;DSC200型差示扫描量热分析仪:德国NETZSCH公司。
1.2 抗性淀粉制备
制备[9]:用蒸馏水配制30%的淀粉乳液,调节pH为6.0,沸水浴30 min后,121℃高温高压处理40 min。冷却,4℃放置24 h。重复高温高压和冷却步骤,80℃烘干,粉碎过100目筛得粗抗性淀粉。
纯化[10]:取粗抗性淀粉用耐热 α-淀粉酶在70℃水解1 h,加入过量糖化酶,55℃水解2 h,离心(3 000 r/min,30 min),水洗离心多次,最后用 95%乙醇清洗,干燥,粉碎,过200目筛,得纯抗性淀粉,供试验用。
1.3 培养基
MRS基础培养基:蛋白胨10 g,肉膏10 g,酵母膏5.0 g,柠檬酸氢二铵2.0 g,葡萄糖20.0 g,吐温-80 1.0mL,乙酸钠5.0 g,磷酸氢二钾2.0 g,MgSO4·7H2O 0.58 g,MnSO4·H2O 0.189 g,蒸馏水 1 000 mL,pH 6.2~6.6。
改良MRS培养基:以2%的抗性淀粉取代基础培养基中的葡萄糖作为碳源,不加抗性淀粉为对照。
选择性培养基:见1.1。
1.4 体外厌氧发酵
取年龄23~31岁健康男子(此前至少3个月以上未注射抗生素,没有预先服用已知的益生元或益生菌,没有胃肠病史)的粪便,将粪便用磷酸盐缓冲溶液(PBS)制成均匀的悬浮液。
取4×3个50 mL的锥形瓶,设3个平行,每个装入20 mL改良MRS培养基,于121℃,1×105Pa灭菌20 min后,每个锥形瓶接入等量已多次用MRS培养基活化的粪便培养物,密封,37℃厌氧培养至10、20、30 h分别取样,用于肠道微生物菌群组成和总酸度的测定分析。
1.5 肠道菌群组成分析
取样品液1 mL,用生理盐水稀释一定倍数后涂布于选择性平板上,于37℃需/厌氧培养48~72 h后,使用全自动菌落分析仪计数。
1.6 发酵液总酸度的测定
参照GB/T 12456—1990测定每份发酵液的总酸度,并以乳酸含量表示。
1.7 抗性淀粉及发酵残余物结构测定
取10mL发酵液,离心(15 min,3 000 r/min),沉淀用10 mL蒸馏水清洗3次后烘干,粉碎过100目筛,这些发酵残余物称为发酵抗性淀粉。采用碘吸收法[11]测定发酵前后抗性淀粉的平均聚合度,扫描电子显微(SEM)分析采用参考文献[12]的方法;X-射线衍射(XRD)分析采用参考文献[13]的方法。
所有数据为3个平行试验的平均值±标准差,且采用SPSS 20.0 for windows进行方差分析。
2 结果与分析
2.1 抗性淀粉对肠道菌群生长的影响
以不添加抗性淀粉为对照,在体外厌氧发酵至10、20、30 h取样,测定4种抗性淀粉对肠道菌群生长的影响,结果见表1。除大肠杆菌在取样的3个时刻都受到强烈的抑制外,其余6个菌株发酵至10 h时菌浓并未出现大的变化、当发酵至20 h时菌浓均达到最大。发酵至30 h时7个菌株的菌浓均比发酵至20 h时的低,这是由于30 h时细菌生长已达衰老期,导致活细胞数目减少。由表1还可知,4种抗性淀粉对双歧杆菌和乳酸杆菌都有较好的增殖作用,对大肠杆菌和产气荚膜梭菌有明显的抑制作用,对粪肠球菌、梭状杆菌、兼性细菌无明显影响。
值得注意的是,与参考文献[9]中报道的单菌培养试验结果相比,在肠道微生物混合培养试验中,4种抗性淀粉对其中益生菌的增殖作用出现明显降低,而对大肠杆菌均表现出较强的抑制作用。这些现象表明肠道微生物菌群之间会相互影响,抗性淀粉对某一细菌的增殖/抑制不代表在肠道中就一定会增殖/抑制此菌的生长,它们对肠道微生物菌群的影响与肠道中特定的微环境密切相关。

表1 几种抗性淀粉对肠道菌群生长的影响/lg CFU/mL
2.2 发酵液的酸度分析
发酵液的总酸度在一定程度上代表了益生菌尤其是双歧杆菌和乳酸杆菌的增殖情况,双歧杆菌和乳酸杆菌的增殖会促进丙酸、丁酸、乳酸等合成[14]。表2为添加不同抗性淀粉发酵10、20、30 h所测得的总酸度(以乳酸值表示)。随着发酵时间的延长,各种抗性淀粉的发酵液总酸度有所增大,且4种抗性淀粉的发酵液总酸度均比对照值要高,说明4种抗性淀粉被肠道益生菌发酵利用过程中产生的短链脂肪酸数量增多,这与文献[15]的报道一致。

表2 几种抗性淀粉发酵液的总酸度(以乳酸表示,g/L))
2.3 发酵后抗性淀粉的超微结构变化
图1为绿豆、马铃薯、锥栗和板栗抗性淀粉经肠道菌群发酵30 h后的扫描电镜图。比较图1a1与图1a2、图1b1与图1b2可看出,绿豆和马铃薯抗性淀粉表面的薄片大小不一,且分布稀散,表层以下的主体结构裸露;而发酵后绿豆和马铃薯抗性淀粉表面的片层结构大小变得更为均匀,且其堆积方式变得更加整齐,密度增大,完全覆盖在表面。同样,与发酵前的锥栗和板栗抗性淀粉(图1c1、图1d1)相比,由图1c2、图1d2也可看出,发酵后锥栗和板栗抗性淀粉的表面由原来单一的薄片层结构变为由片层、薄片与纤丝混合堆积的结构,但发酵后锥栗抗性淀粉表面结构中薄片比例较高,而发酵后板栗抗性淀粉的纤丝状结构比例较高。因此,经体外厌氧发酵后,抗性淀粉的微观结构发生了不同程度的变化,结构变得更加有序,比表面积增加。
2.4 发酵抗性淀粉的平均聚合度变化
4种抗性淀粉经肠道微生物发酵30 h后直链淀粉的含量及其平均聚合度见表3。从表3可以看出,与发酵前相比,发酵后抗性淀粉的直链淀粉含量稍有增加,而其平均聚合度有所降低,但不及抗性淀粉较之原淀粉平均聚合度的降幅明显。
2.5 发酵后抗性淀粉的结晶度变化
淀粉是主要由A型和B型晶体及少量V型晶体组成的混合物。Lopez-Rubio等[16]研究表明,A型晶体通常 2θ为 17.14°、18.14°、15.11°和 26.27°出现强的特征衍射峰,另外 2θ为 9.98°、11.19°、22.93°、23.68°、30.30°和 33.08°也有衍射峰;B型晶体2θ为5.51°、14.60°和 16.85°具有典型衍射峰,以及 2θ为 10.01°、11.02°、13.85°、22.30°、23.71°、26.16°、30.61°和 33.84°也出现衍射峰;V型晶体在2θ=19.80°处出现标志性衍射峰,有时2θ为7.40°和12.90°也有衍射峰。图2为绿豆、马铃薯、锥栗和板栗的抗性淀粉和发酵抗性淀粉的广角X射线衍射图谱,由图谱得到其结晶参数见表4。从图2和表4中可以看出,绿豆、马铃薯抗性淀粉为B型晶体,B型晶体所占比例较高;锥栗、板栗抗性淀粉的晶型为V型,V型晶体所占比例较高。绿豆、马铃薯、锥栗和板栗抗性淀粉经发酵后,它们的晶型均变为A型,以A型晶体为主,亚微晶比例基本稳定在17%左右(数据未列出),而微晶比例明显降低,说明发酵作用对抗性淀粉的微晶有较大影响。
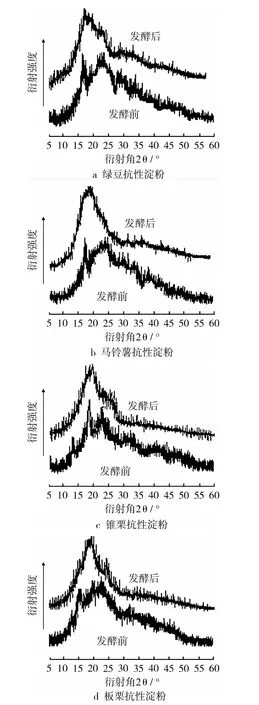
图2 几种抗性淀粉发酵前后的X-射线衍射图谱
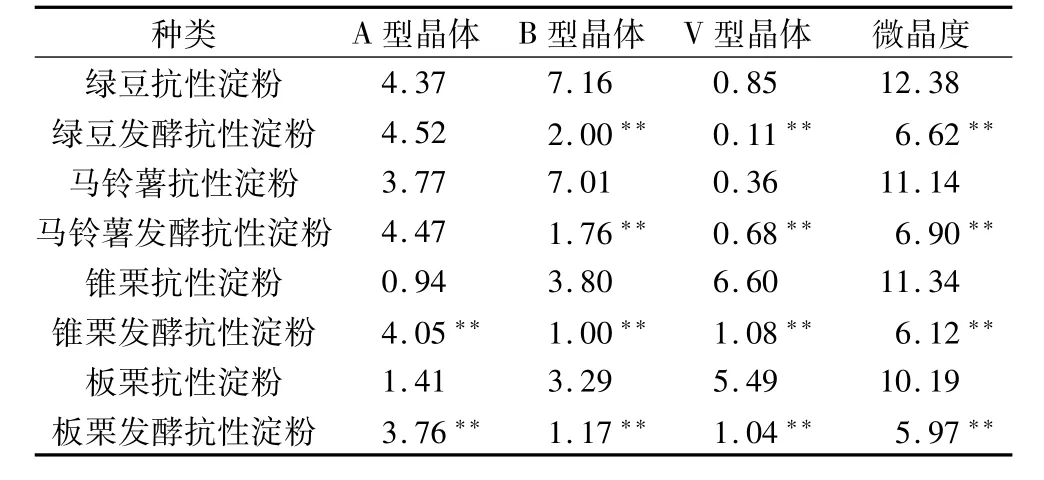
表4 几种抗性淀粉发酵前后的结晶参数/%
3 结论
3.1 4 种抗性淀粉对双歧杆菌和乳酸杆菌都有较好的增殖作用,对大肠杆菌有明显的抑制作用,对产气荚膜梭菌有较强的抑制作用,对粪肠球菌、梭状杆菌、兼性细菌无明显影响。4种抗性淀粉的发酵液总酸度增大,说明它们被肠道益生菌发酵利用产生了更多的短链脂肪酸。
3.2 发酵后绿豆和马铃薯抗性淀粉表面的片层结构大小变得更为均匀,且其堆积方式变得更加整齐,密度增大,完全覆盖在表面。同样,发酵后锥栗和板栗抗性淀粉的表面由原来单一的薄片层结构变为由片层、薄片与纤丝混合堆积的结构。
3.3 绿豆、马铃薯抗性淀粉为B型晶体,锥栗、板栗抗性淀粉的晶型为V型。发酵后4种抗性淀粉的平均聚合度有所降低,它们的晶型均变为A型,以A型晶体为主,微晶度降低。
[1]De-Souza-Oliverira R P,Rodrigues-Florence A C,Perego P,etal.Use of lactulose as prebiotic and its influence on the growth,acidification profile and viable counts of different probiotics in fermented skim milk[J].International Journal of Food Microbiology,2010,150(3):230-235
[2]Fuentes-Zaragoza E,Riquelme-Navarrete M J,Sanchez-Zapata E,et al.Resistant starch as functional ingredient:a review[J].Food Research International,2010,43(2):931-942
[3]Perera A,Meda V,Tyler R T.Resistant starch:a review of analytical protocols for determining resistant starch and of factors affecting the resistant starch content of foods[J].Food Research International,2010,43(5):1959-1974
[4]Anthony C D,Guilhem P,Robert G G,et al.Digestion of starch:in vivo and invitro kinetic models used tocharacterize oligosaccharide or glucose release[J].Carbohydrate Polymers,2010,80(2):599-617
[5]Morais M B,Feste A,Miller R G,et al.Effect of resistant and digestible starch on intestinal absorption of calcium,iron,and zinc in infant pigs[J].Pediatric Research,1996,39(5):872-876
[6]Bird A R,Brown IL,Topping D L.Starches,resistant starches,the gutmicroflora and human health[J].Current Issues in Intestinal Microbiology,2000,1(1):25-37
[7]Cummings JH,Beatty E R,Kingman SM,et al.Digestion and physiological properties of resistant starch in the human large bowel[J].British Journal of Nutrition,1996,75(5):733-747
[8]Yamada Y,Hosoya S,Nishimura S,et al.Effect of bread containing resistant starch on postprandial blood glucose levels in humans[J].Bioscience,Biotechnology,and Biochemistry,2005,69(3):559-566
[9]曾红华,谢涛,杨莉,等.几种薯类与豆类抗性淀粉的的抗消化性及其益生效应[J].中国粮油学报,2012,27(11):30-34
[10]Perera A,Meda V,Tyller R T.A review of analytical protocols for determining resistant starch and of factors affecting the resistant starch contentof foods[J].Food Research Interntational,2010,43:1959-1974
[11]Takeda C,Takeda Y,Hizukuri S.Physicochemical properties of lily starch[J].Cereal Chemistry,1983,60(1):212-216
[12]Sushil D,Ashok K S,Michael JG.Effect of cryo-milling on starches:functionality and digestibility[J].Food Hydrocolloids,2010,24(1):152-163
[13]谢涛,张淑远,王美桂,等.重结晶红薯淀粉体外消化前后益生作用与结构变化[J].农业机械学报,2013,44(8):203-208
[14]Marzorati M,Verhelst A,Luta G,et al.In vitromodulation of the human gastrointestinalmicrobial community by plantderived polysaccharide-rich dietary supplements[J].International Journal of Food Microbiology,2010,139(3):168-176
[15]谢涛,张儒.锥栗直链淀粉-脂肪酸复合物的体外消化及益生元活性[J].中国粮油学报,2012,27(8):20-23
[16]Lopez-Rubio A,Flanagan B M,Gilbert E P.Molecular rearrangement of starch during in vitro digestion:toward a better understanding of enzyme resistant starch formation in processed starches[J].Biomacromolecules,2008,9(7):1951-1958.
