单价阳离子对大豆果胶凝胶性质影响
2014-03-14李清华朱丹实何余堂
刘 贺 李清华 朱丹实 滕 璐 何余堂 马 涛
(辽宁省食品安全重点实验室 渤海大学化学化工与食品安全学院1,锦州 121013)
(辽宁省高校重大科技平台“食品贮藏加工及质量安全控制工程技术研究中心”2,锦州 121013)
果胶是一类复杂的线性多糖,主要由多聚半乳糖醛酸组成,广泛存在于高等植物的细胞壁中。果胶具有良好的乳化性和凝胶性,通常作为稳定剂和质构改良剂应用于果冻、果酱、糖果、乳制品等食品中。目前提取果胶的原料包括香蕉皮、苹果皮和柑橘皮等,与这些原料相比,大豆皮作为廉价的大豆加工副产物,具有很大优势。目前国内有关大豆皮开发和利用的相应研究还较少,只是将大豆皮用于饲料行业,附加值不高。亓盛敏等[1]、周艳红等[2]对大豆皮果胶的提取方法进行了研究,刘贺等[3]对大 豆果胶的持水力及力学、光学性质进行了研究。也有研究[4]表明低酯果胶可以在没有蔗糖的参与下,通过自由羧基与二价阳离子(钙离子)形成凝胶,但单价阳离子对大豆果胶凝胶性质的影响尚未见相关报道。本试验利用微波辅助草酸铵提取法提取的大豆果胶,研究不同浓度的单价阳离子锂、钠、钾,在不同果胶浓度条件下,对大豆果胶凝胶力学性质、持水力、透明度及流变学特性的影响,从而为大豆皮的利用提供理论基础,为工业化应用大豆果胶生产低糖产品提供参考。
1 材料与方法
1.1 材料与试剂
大豆果胶:自制,其中含总糖82.36%(单糖组成为鼠李糖、半乳糖、阿拉伯糖、葡萄糖、木糖及半乳糖醛酸,摩尔比为 3.01∶47.45∶3.78∶3.20∶15.07∶15.07),蛋白质5.21%,水分6.84%,灰分5.59%。氯化锂、氯化钠、氯化钾:天津市天力化学试剂有限公司。
1.2 仪器与设备
L-535R离心机:长沙湘仪离心机仪器有限公司;TA.XT-Plus质构仪:英国微讯公司;DISCOVERY HR-1流变仪:美国TA公司。
1.3 试验方法
1.3.1 果胶凝胶溶液的制备
将大豆果胶配制成质量浓度为4 g/100 mL的贮备液,按需要稀释为1 g/100 mL和2 g/100 mL。于80℃条件下,在果胶溶液中分别添加一定量的氯化锂、氯化钠或氯化钾固体粉末,同时进行加热搅拌以使盐充分溶解形成均匀的溶液。最后将蒸发掉的水分用80℃的去离子水进行补充。每个凝胶体系做3个平行样。
1.3.2 果胶凝胶力学性质测定
将不同浓度的果胶凝胶溶液倒入10 mL小烧杯中冷却,每组试验做3个平行样。利用TA.XT-Plus质构仪测定凝胶强度,探头为P0.5,参数设置如下:测试前速度为1.0 mm/s,测试速度为1.5 mm/s,测试后速度为1.5 mm/s,触发力为 3 g,下降深度为5 cm。
1.3.3 果胶凝胶持水力测定
将制备的凝胶溶液1 mL左右加入到2 mL塑料离心管中,待其凝胶后,于4 000 r/min下离心30 min,吸去上层水,测量重量差,计算持水能力,重复测定3次。持水能力计算公式如下:
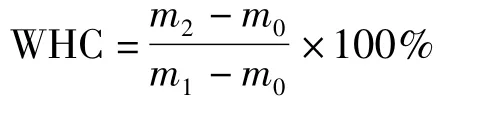
式中:m0为空离心管质量;m1为离心前装有凝胶的离心管质量;m2为吸去水分后离心管质量。
1.3.4 果胶凝胶透明度分析
取果胶凝胶溶液3 mL注入4.5 mL 1 cm×1 cm的比色皿中,室温静置24 h后,在波长490 nm处测定吸光度。每个凝胶体系做3个平行样,取平均值。
1.3.5 果胶凝胶流变特性分析
用移液管取10 mL不同浓度的果胶溶液于小烧杯中,加入不同质量的单价金属盐粉末,在80℃下将其混匀。取样加在流变仪测试平板上,温度控制在25℃,使用平行板,直径为40 mm,狭缝距离设置为500μm,频率扫描范围0.1~100 Hz,测量样品的流变特性。
2 结果与分析
2.1 单价阳离子对果胶凝胶强度的影响
大豆果胶的功能主要为增稠性、凝胶性。凝胶强度是凝胶应用于食品的一个重要指标,可根据凝胶强度选择应用对象。在试验条件下,锂离子与大豆果胶不能形成凝胶,钠离子与大豆果胶部分形成凝胶,但是凝胶强度都很弱,不同浓度的钾离子与不同质量浓度果胶形成的凝胶强度如图1所示。这种果胶凝胶强度的差别与所用单价阳离子的半径有关[5]。离子半径小的锂离子与水分子高度作用,与果胶表面的自由羧基的结合概率最小,不能防止果胶中阴离子聚合物的静电排斥作用,所以形成的果胶凝胶强度最弱,然而离子半径相对较大的钾离子与水分子作用较弱,从而更可能与自由羧基直接作用,形成缔合区,并能有效防止阴离子聚合物的静电排斥作用,保持果胶凝胶结构的稳定[6],所以钾离子形成的果胶凝胶强度最强,钠离子则介于两者之间。

图1 钾离子浓度及果胶质量浓度对果胶凝胶强度的影响
就钾离子而言,质量浓度为4 g/100 mL的果胶凝胶强度高于质量浓度为2 g/100 mL的果胶凝胶强度,原因在于果胶质量浓度尚未达到胶凝临界点,与金属离子的结合位点较少,适当增加果胶质量浓度可增加结合位点,形成更多的缔合区,从而提高果胶凝胶强度[7]。在同一果胶质量浓度条件下,果胶凝胶的凝胶强度呈现先升高后降低的趋势。当果胶质量浓度为4 g/100 mL,钾离子浓度为0.1 mol/L时,果胶凝胶的凝胶强度最高,为69.05 g。这可能是由于大豆果胶凝胶的形成是低酯果胶链中的自由羧基与金属离子形成类似蛋盒结构,适当提高金属离子的浓度使缔合区增加,在有限的空间内网络结构更加紧密,可提高果胶凝胶的硬度[8]。但当金属离子浓度过大时,会使凝胶变得不稳定,在短时间内发生质的变化,胶体分子内部脱水,导致硬度下降。
2.2 单价阳离子对果胶凝胶持水力的影响
果胶凝胶的持水力是指凝胶体系网状结构束缚水分能力的特性,持水力会影响产品的质构特性和加工损失[9]。添加不同单价阳离子形成的果胶凝胶持水力由高到低的顺序为钾离子、钠离子、锂离子。锂离子与果胶在各种条件下均未形成稳定的凝胶,在持水力测试中,出现明显的分层现象;钠离子在浓度为 0.3和 0.4 mol/L,果胶质量浓度为 4 g/100 mL的情况下,形成的凝胶持水力分别为67.43%和74.82%,钠离子浓度为0.4 mol/L,果胶质量浓度为3 g/100 mL时,果胶凝胶的持水力为65.9%,其余均未形成稳定的凝胶体系,离心后有大量水析出;钾离子与果胶形成凝胶的持水力如图2所示,原因在于离子半径不同,与自由羧基作用的机率不同,离子半径大的钾离子与羧基结合位点多,可形成较多的缔合区,从而提高了束缚水分子的能力。在钾离子浓度相同时,果胶质量浓度越大,持水性越好,这是由于果胶质量浓度未达到胶凝临界点,提高果胶质量浓度可增加缔合区,从而提高网状结构束缚水分的能力[10]。果胶质量浓度相同时,随着钾离子浓度的增加,果胶凝胶的持水力先增大,当果胶质量浓度为4 g/100 mL,钾离子浓度为 0.1 mol/L时,果胶凝胶的持水性最好,高达98.8%,离心后凝胶表面有极少量水析出。这可能由于当钾离子浓度增加时,果胶与钾离子的桥联位点增多,形成更多的缔合区和氢键,进而提高体系的持水能力[11]。之后呈现减小的趋势,原因可能是金属离子浓度过大时,会使凝胶变得不稳定,形成的网状结构较松散,从而使果胶凝胶体系的持水能力下降[12]。
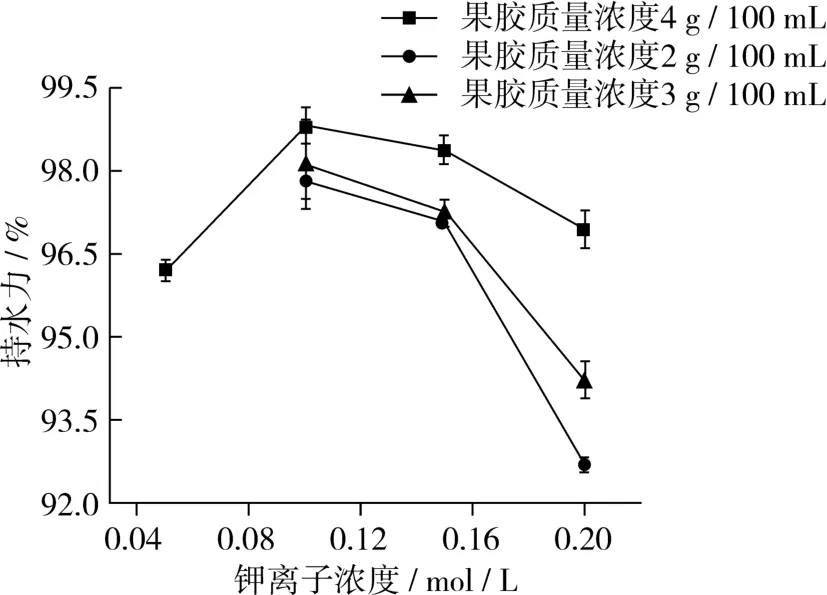
图2 钾离子浓度及果胶质量浓度对果胶凝胶持水力的影响
2.3 单价阳离子对果胶凝胶透明度的影响
果胶凝胶的透明度影响产品的感官性质,也是应用于食品中的一个重要指标。由图3可知,钾离子浓度相同时,果胶质量浓度越大,凝胶体系在490 nm处的吸光度值越大,凝胶透明度越低。原因可能是果胶质量浓度提高,形成的缔合区大且多,分散在果胶体系中导致凝胶浑浊,使凝胶的透明度降低[3]。果胶质量浓度相同时,钾离子浓度越小,凝胶体系的透明度越好。果胶质量浓度为2 g/100 mL,钾离子浓度为0.1 mol/L的果胶凝胶透明度最好。原因在于金属离子浓度升高,形成的缔合区增多,故可导致透明度降低。
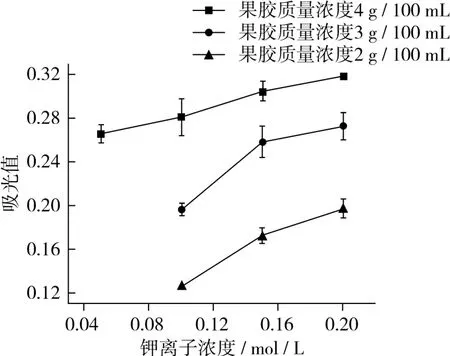
图3 钾离子浓度及果胶质量浓度对果胶凝胶透明度的影响

图4 钠离子浓度对果胶凝胶透明度的影响
由图4可以看出,钠离子形成的凝胶体系透明度均不好,其余的体系均未形成稳定的凝胶。与图3相比,钠离子凝胶体系的透明度比钾离子凝胶体系的透明度差,原因可能是形成稳定凝胶体系的钠离子浓度比钾离子浓度高,高离子浓度不利于大豆果胶形成均匀、有序的凝胶结构。在果胶质量浓度相同时,钠离子浓度越大,透明度越差。在钠离子浓度相同时,果胶质量浓度为3 g/100 mL的凝胶透明度小于果胶质量浓度为4 g/100 mL的果胶透明度。这可能是因为3 g/100 mL的果胶凝胶体系中钠离子浓度相对过高,屏蔽了果胶之间的电荷效应,从而使透明度降低[13]。
2.4 单价阳离子对果胶凝胶流变特性的影响
弹性模量是物体在变形过程中正应力和对应的正应变的比值。弹性模量的大小与缔合区的大小、数量以及网状结构有关[14]。由图5可知,随着频率的增加,钾离子与大豆果胶凝胶体系的弹性模量逐渐增大。弹性模量越大,说明果胶凝胶的固体性质越显著。在频率小于63 Hz时,果胶凝胶的弹性模量变化较小,这可能由于在反应初期,钾离子尚未和果胶交联形成网状结构,在外力作用频率较低时,果胶溶液完全跟得上外力的变化,溶液表现出高黏性[15]。当频率大于63 Hz时,果胶凝胶的弹性模量均大幅度上升,这可能是因为钾离子和果胶的网状结构形成,在外力作用频率较大时,表现出高弹性。

图5 频率对钾离子果胶凝胶体系弹性模量的影响
果胶质量浓度为4 g/100 mL的凝胶体系的弹性模量整体大于果胶质量浓度为2 g/100 mL凝胶体系的弹性模量,这可能由于果胶质量浓度的增加使缔合区增加,在有限的空间内网络结构更加紧密,从而提高了体系的弹性模量。当果胶质量浓度为4 g/100 mL,钾离子浓度为0.2 mol/L的凝胶体系形成的凝胶弹性模量较大,但是由图1可知,当果胶质量浓度为4 g/100 mL,钾离子浓度为0.1 mol/L时,果胶凝胶强度最大。这可能是由于弱凝胶的弹性模量与作用频率的依赖性较高,而凝胶强度大的体系弹性模量与频率的依赖性相对较低[16]。
由图6可以看出,随频率增大,钠离子与大豆果胶凝胶体系的弹性模量增大。与图5比较可知,同一条件下,钾离子-果胶凝胶体系的弹性模量与钠离子-果胶凝胶体系的弹性模量不符合Hofmeister序,即单价阳离子促进形成凝胶结构的有效性为钾离子>钠离子>锂离子,网状结构越紧密,弹性模量越大,这可能是由于每种离子促进形成凝胶结构的最佳浓度不同[14]。钠离子浓度相同时,果胶质量浓度越大,弹性模量越大。果胶质量浓度为2 g/100 mL时,钠离子浓度为0.3 mol/L的凝胶体系的弹性模量是最高的,但是当果胶质量浓度为4 g/100 mL时,钠离子浓度为0.2 mol/L的体系弹性模量最大。单价阳离子浓度对果胶凝胶弹性模量的影响没有规律性,与果胶凝胶强度也有出入,这可能是因为离子浓度与果胶质量浓度存在最佳比例,当比例小于最佳配比时,提高金属离子浓度可达到增稠进而形成凝胶的作用,当比例大于最佳配比时,过量的金属离子会使凝胶脱水,会使凝胶的弹性模量下降,但是凝胶强度和胶体硬度会增强[17]。

图6 频率对钠离子果胶凝胶体系弹性模量的影响
3 结论
在试验条件下,单价阳离子促进大豆果胶形成凝胶的能力由高到低依次为:钾离子、钠离子、锂离子。适当提高离子浓度和果胶质量浓度是增加凝胶体系凝胶强度、持水性和弹性模量的有效手段,但同时会使果胶凝胶的透明度降低。综合凝胶强度、持水力、透明度和流变学特性等指标,可以看出,当果胶质量浓度为4 g/100 mL,钾离子浓度为0.1 mol/L时,果胶凝胶的各项指标较好,凝胶强度为69.05 g,持水力为98.8%,透明度较好,可以用于开发低糖凝胶,提高产品的安全性和健康性。
[1]亓盛敏,朱科学,彭伟,等.大豆皮果胶不同提取方法的研究[J].食品工业科技,2012,33(12):306-308
[2]周艳红,金征宇.大豆皮果胶多糖的提取工艺研究[J].食品工业科技,2004,25(3):76-78
[3]刘贺,刘昊东,郭晓飞,等.大豆皮低酯-高酯复合果胶凝胶的持水能力及力学、光学特性[J].食品科学,2010,31(19):111-114
[4]刘贺,朱丹实,徐学明,等.低酯桔皮果胶凝胶全质构参数及持水性响应面分析[J].食品科学,2009,30(3):81-87
[5]YOO S,FISHMAN M,SAVARY B,et al.Monovalent salt-induced gelation of enzymatically deesterified pectin[J].Food Chemistry,2003,51(25):7410-7417
[6]MIYATA K,KANNO H,NIINO T,et al.Cationic and anionic effects on the homogeneous nucleation of ice in aqueous alkalihalide solutions[J].Chemical Physics Letters,2002,354:51-55
[7]PARKER D,SCHRAM B,PLUDE J,et al.Effect ofmetal cations on the viscosity of a pectin-like capsular polysaccharide from the cyanobacterium microcystis flos-aquae C3-40[J].Applied and Environmental Microbiology,1996,62(4):1208-1213
[8]刘贺,朱丹实,徐学明,等.低酯桔皮果胶凝胶的动力学分析及分形研究[J].食品科学,2008,29(2):76-81
[9]HUANG Y q,TANG Jm,SWANSON B,et al.Effect of calcium concentration on textural properties of high and low acylmixed gellan gels[J].Carbohydrate Polymers,2003,54(3):517-522
[10]LOFGREN C,HERMANSSON A.Synergistic rheological behaviour ofmixed HM/LM pectin gels[J].Food Hydrocolloids,2007,21(2):480-486
[11]PONGJANYAKUL T,PUTTIPIPATKHACHORN S.Xanthan-alginate composite gel beads:molecular interaction and in vitro characterization[J].International Journal of Pharmaceutics,2007,331(1):61-71
[12]SALBU L,BAUER-BRANDL A,THO I,et al.Direct compression behavior of low and high-methoxylated pectins[J].AAPSPharm Sci Tech,2010,11(2):405-413
[13]齐海萍,吴强,胡文忠,等.添加剂对明胶-多糖共混凝胶特性的影响[J].食品科技,2011,36(8):240-244
[14]OKAZAKIK,KAWAGUCHIM.Influence ofmonovalentelectrolytes on rheological properties of gelled colloidal silica suspensions[J].Dispersion Science and Technology,2008,29:77-82
[15]刘保江,闵洁.印花用瓜耳豆胶糊料流变性能研究[J].印染助剂,2008,25(6):28-30
[16]Clark A,SIMON B,Murphy R.Structural and mechanical properties ofbiopolymer gels[J].Advances in Polymer Science,1987,83:57-192
[17]汪海波.低酯果胶的凝胶质构性能研究[J].食品科学,2006,27(12):123-129.
