腰椎间盘营养扩散途径的 DCE-MRI 研究进展
2014-02-14陈春郭勇任爱军阮狄克
陈春 郭勇 任爱军 阮狄克
. 综述 Review .
腰椎间盘营养扩散途径的 DCE-MRI 研究进展
陈春 郭勇 任爱军 阮狄克
椎间盘退变是颈、腰椎病发生发展的根本原因,不同程度的影响患者的生活质量[1]。流行病学研究表明营养供应减少、细胞凋亡失衡、基质酶活性改变、生物力学机制及自身免疫反应等均可能是导致椎间盘退变的重要因素[2],营养物质缺乏被认为是诸多因素中导致椎间盘退变的首要影响因素并被体外研究所证实[3]。当某些病因引起营养椎体的血液供应减少时,影响了髓核营养的输送,最终导致椎间盘退变的发生。既往检测扩散途径的方法较多,但主要集中在离体研究上[4],如何无创检测活体对于早期预防和干预治疗具有重要意义。磁共振成像 ( magnetic resonance imaging,MRI ) 应用于医学领域已有 20 多年历史,动态增强磁共振扫描 ( dynamic contrast enhanced-MRI,DCE-MRI ) 通过 MRI 对比剂进入椎间盘的快慢及多少反映椎间盘的营养扩散过程,具有可重复、无创的优点,是一种新的分析椎间盘营养机制的方法,现将其机制进行综述。
一、DCE-MRI 的基本原理及方法
DCE-MRI 是一种无创性评价病变部位血流灌注情况的技术,当小分子顺磁性对比剂经高压注射器静脉团注后,对比剂通过血管迅速进入到组织内,使组织强化达到高峰,随着对比剂逐渐流出,进入相对平衡期,再随着对比剂的吸收排泄使组织内对比剂减少,组织信号强度逐渐降低。它是评价组织器官血流的新的成像方法,根据示踪剂来源不同,分为内源性和外源性两种[5-6]。临床中对于椎间盘病变的检测多采用外源性示踪法,应用外源性示踪剂 ( 如钆贝葡胺等 ),通过连续测量组织内示踪剂的浓度来获取相关的血流动力学参数,其成像方式根据血液灌注率的不同分为动态成像法 ( 团注期间快速成像 ) 和稳态成像法 ( 在恒定注射且于造影剂在血液中达到平衡浓度后成像 )[7-8]。椎间盘影像学信号的采集是通过静脉注射显影剂,显影剂进入毛细血管到达组织后,会改变组织的局部磁场,使组织质子经历的磁场均匀性降低,加速质子失相位过程,从而使组织 T1时间缩短,使用对 T1时间敏感的序列测量,在显影剂第一次通过期间重复、快速的扫描层面图像,就会观察到组织的信号强度增强,得到时间 - 信号强度曲线,并通过对曲线的处理获得参数[5],通过扫描出的动态图像观察造影剂的流向及流速间接判断组织功能。正常的椎间盘营养途径方向认为是从椎体依次向终板、髓核和纤维环[9],腰椎椎体、髓核、纤维环解剖部位在 T1WI 像和 T2WI 像上较为明显,通过造影剂增强后可以清晰的显示。软骨终板为附着于椎体上下缘的透明软骨,分软骨终板及骨性终板。在 MRI 影像中,终板的准确定位仍然不清[10],Rajasekaran 等[11]认为由于骨性终板的信号强度改变与椎体是一致的,因此可认为软骨终板区域增强信号改变即为终板改变。Rajasekaran 等[10]研究发现在T1WI 上软骨下骨和髓核之间有一个低信号区域,此区域与其它部位最大峰值信号的出现不一致,他把这种随时间增加,信号强度峰值延迟出现的特点定义为终板延迟,并认为正常情况下椎间盘具有终板信号增强延迟的特点可认为其形态学完整。研究发现终板结构的完整性对于椎间盘整个信号强度的改变具有重要的意义[9],通过 DCE-MRI研究认为是否具有正常的营养途径扩散方向,终板信号增强延迟的典型特点和髓核信号最大峰值的出现延迟可确定终板形态结构上是否保持完整。
二、椎间盘营养途径扩散机制的影响因素
1. 终板结构:目前认为椎间盘的营养有终板及纤维环虽有两种途径,但主要途径仍存在争议[12-13],Rajasekaran等[10]通过 DCE-MRI 研究发现前后纤维环在 10 min 时信号开始增强,可能是与外层纤维环的血管有关,此时髓核内并无强化信号,而终板区域信号峰值达到后,髓核的峰值信号才会缓慢出现,认为扩散主要来自于终板途径,在影像学上给出新的机制阐述。终板是脊柱单元中较为脆弱的桥接部分,并易受力学载荷等因素影响,脊柱载荷过大可导致椎体软骨终板破裂,导致椎间盘因营养供给不足出现退化、钙化,代谢产物积聚,造成基质破坏,细胞代谢障碍、死亡。有限元研究终板破裂可能是椎间盘退变的第一步[14],随后显微观察、标本及无创的 MRI 影像技术证实了此观点[15]。Nguyen-minh 等[16]在 0.5T MRI 对 15 例腰背部疼痛患者测量椎间盘增强前后信号强度,于 10 min 内注射 0.1 mmol / kg 的钆特醇,注射后 5 min 增补 0.2 mmol / kg 的注射量,结果发现相对于增强前,正常与退变间盘信号强度的增强幅度分别约 36% 和 21%,两者比较差异有统计学意义,提示终板破裂在信号改变方面起重要作用。此外,软骨终板的自身成分与营养通透也有关系,含水越多,则渗透率越高,渗透速度也越快,而胶原增多和软骨钙化则会降低滤过能力。
2. 溶剂性质:MRI 研究显示营养物质透过软骨终板的能力取决于溶质的形状、剂量、大小和电荷[11]。椎间盘的生化成分之一蛋白多糖是一类含有多聚负离子的化合物,对水、阳离子具有较大的亲和力,对阴离子则有排斥作用[17-18],因此,离子型对比剂 ( 马根维显 ) 在椎间盘的扩散要慢于中性对比剂 ( 钆特醇、钆双胺等 )。Ibrahim等[19]对 4 只兔子体内静脉注射马根维显和钆特醇,剂量均为 0.3 mmol / kg,注射后 2 h 对比二者的强化程度,发现注射钆特醇后椎间盘的强化明显高于马根维显组。椎间盘中的固有成分也是影响扩散功能的重要影响因素之一,Nguyen-minh 等[20]发现带有固有电荷的分子阻碍带电荷的造影剂分子的运动,带电荷的氨基葡聚糖在非成熟间盘中的含量明显高于成熟者,推测可能与髓核中带有较高的固定负电荷的蛋白多糖的代谢有关,但其作用机制尚待进一步研究。此外,对比剂分子质量的大小也决定其扩散的快慢,耦合效应形成的大分子溶剂阻止造影剂分子向髓核中扩散[11],Perlewitz 等[21]在对兔注射钆特醇 ( 分子量为 546 ) 和钆-聚赖氨酸 ( 分子量为 40 000 ),2 h 后观察两者的扩散效果,结果发现髓核中钆-聚赖氨酸的含量明显低于钆特醇,然而两者在肌肉组织中没有明显的区别,其机制原因仍需进一步研究。椎间盘的增强信号与造影剂剂量有很大的关联,Ibrahim 等[22]对不同造影剂量的注射后间盘的增强效果进行一系列的研究,通过向 11 只兔中注射不同剂量的造影剂 ( 0.1~2.8 mm / kg ),发现低于0.3 mm / kg 的剂量无法检测到椎间盘信号改变,高于此剂量可获得良好的信号。Akansel 等[23]先向人体静脉首次注射 0.1 mmol / kg,二次增补 0.2 mmol / kg,结果发现二次增补后临近终板区域信号强度较注射前增加了 25%,推荐0.3 mmol / kg 作为注射剂量,但更优化剂量仍需进一步实验证实。
三、扩散的评估方式及分析方法
注射造影剂后,通过 MRI 自带软件描绘出时间-信号强度 ( Time-SI ) 曲线是评估椎体、终板、纤维环及髓核营养途径的重要方式[10]。椎间盘的营养途径依赖于软骨终板,感兴趣区域 ( region of interest,ROI ) 的选择不当容易造成部分容积效应[13],因此适合 ROI 的选择对 SI 值的测量非常重要。Nguyen-minh 等[16]认为一个区域放置多个小正方形测量其 SI 值可以很大程度上减小误差。邓绍强等[24]研究也发现较大的 ROI 覆盖了部分软骨终板和纤维环,产生了部分容积效应,而较小的 ROI 主要集中在髓核中央区域,更能真实地反映髓核区域的扩散情况。但 Rajasekaran 等[20]采用的评估方式与之前学者研究有所不同,他们将包含椎体 80% 的区域面积的 ROI 放置于椎体,选择适合于软骨终板区域大小的长方形来测量其 SI值,对于髓核和纤维环,选用合适大小的椭圆形 ROI 分别测量前后纤维环和髓核的 SI 值,大约包含 50% 面积大小的长方形分别放置于髓核的上中下,他们认为较大的选择区域能够显著降低不同观察者之间的视觉误差,从而保证测量结果的准确性,也对比了不同形状 ROI 并测量其 SI值,也证实了以上的类似结果。
在 T1WI-DCE-MRI 图像上可以进行 ROI 信号强度的半定量分析,通过动态增强曲线、计算出的早期强化率、增强后最大强化率及达峰时间等参数,来反应血流动力学信息[25]。不同椎间盘区域内增强后的 SI 值可以进行增强百分率的定量分析。Rajasekaran 等[10]对 SI 划分成不同的阶段,SIBASE 表示为注射造影剂之前的基础信号值,SITP 表示为不同阶段内的 ROI 的信号强度值,增强后的 SI ( ROI )=SITP-SIBASE / SIBASE×100,SIMAX 定义为在整个某一时间点的峰值,TRISE 表示为介于 SIBASE和 SIMAX 之间,意为在一个时间段内 SI 开始增大的初始值,时间信号曲线 ( time intensity curve,TIC ) 表示为时间-信号强度曲线,为 SI 在不同时间点内绘制而成,表示某一个 ROI 在整个时间段内的变化趋势图形。通过不同时间点的峰值观察,可以间接分析组织内的形态结构及功能。
四、腰椎间盘增强后的 DCE-MRI 研究
1. 正常椎间盘内的扩散量化研究:正常椎间盘的扩散的具体量化机制研究仍比较少。有学者进行一系列退行性病变椎间盘与营养通道的关系研究[4,26]。韩志华等[27]对正常犬行持续 4 h 的动态增强后发现,注射对比增强剂后 5 min,1 h,1.5 h 腰椎椎体、终板区域、周围髓核、中央髓核分别达到第一个峰值,3.5 h 达到第二个峰值,而第二个峰值明显低于第一个峰值,差异有统计学意义( P<0.05 ),认为犬正常腰椎间盘动态增强核磁表现具有“终板延迟”现象及“双峰”特征。活体人正常椎间盘营养途径研究始于 21 世纪初期,Rajasekaran 等[10]于2004 年首次对正常人活体腰椎椎体、终板、纤维环及髓核的 24 h 扩散机制进行详细的研究,测量了椎间盘不同区域的增强百分比和增强峰值的百分率及达峰时间。TIC特点表现为椎体及骨性终板在 5 min 达到信号峰值,增强幅度分别为 ( 30.8%±15.4 ) %和 ( 32.6±17.5 ) %,增强后 2 h 边缘出现 2 条平行于终板的线样信号强化条带,峰值为 ( 32.2±21.0 ) %,此信号带的产生为终板扩散延迟特点所造成,随后整个 TIC 中持续维持较高的 SI,髓核在前 10 min 内无信号改变,增强后 2 h 可见 2 条与内髓核分界清晰并平行终板的信号带,增强后 6 h 出现内外髓核信号增强达到峰值,分别为 ( 46.0±24.3 ) % 和 ( 35.7± 20.6 ) %,随后开始下降,但 24 h 内未回到基线,而且发现髓核信号峰值与椎体及终板的信号峰值成正相关,认为信号从椎体、终板、纤维环及外髓核依次增强为正常椎间盘扩散方向途径。认为在 T1WI 上鉴别软骨终板和髓核的高信号区域是通过终板区域,研究发现在椎体与髓核之间有一明显的条带状低信号区,实际上此低信号区域为终板的功能性区域,在 TIC 上具有“信号丢失”的特点,可把这种弥散时间的延长定义为终板延迟,并认为在完整的终板形态至关重要[17]。以上可见,动物及人体椎间盘均具有“终板延迟”特征,可为研究人体终板功能提供动物实验模型,而两者达到峰值时间的不同可能是物种差异所致。
2. 退变椎间盘内的扩散量化研究:研究表明椎间盘的退变分级程度和终板的 Modic 改变影响椎间盘内的增强信号改变[28]。Niinimaki 等[28]通过向人体注射造影剂将椎间盘的各级退变程度进行量化分析,研究结果显示注射 90 min 后其 II~V 级的信号强度变化率分别为 ( 6.6± 5.5 ) %,( 8.8±11 ) %,( 32.0±29.0 ) %,( 72.0±19.0 ) %,认为发生 Modic 改变的退变椎间盘中,毛细血管芽生长进入软骨终板及外部髓核区域,改变了椎间盘的局部血流变化,导致其信号强度的显著改变。退变椎间盘经常发生在终板中央[29],终板破裂后,终板延迟效应消失,表现为邻近终板的周围髓核在 10 min 时快速达到峰值,软骨下骨也能达到高信号,并且在 2 h 时邻近终板周围髓核仍有局部高信号,而内髓核的信号才刚刚增加[9]。Rajasekaran等[10]研究发现不同程度退变间盘中央髓核区域信号强度峰值差别较大并给出量化结果,非严重间盘退变程度在 10 min,12 h,24 h 的信号强度增强率分别为 ( 2.76± 13.95 ) %,( 27.56±19.44 ) %,( 21.72±22.28 ) %,严重间盘退变程度分别为 ( 17.49±28.98 ) %,( 21.06±20.67 ) %,( 12.37±17.31 ) %,两者在 10 min 时对比差异有统计学意义,此为区分椎间盘的严重程度给出一个新的量化分析。终板血流灌注的改变及通透性改变导致延迟增加信号峰值[30]并被组织学证实[31]。为了解终板结构在椎间盘退变中的作用机制,Rajasekaran 等[9]对终板结构损伤程度进行了量化分析,提出终板损伤总分 ( total endplate damage score,TEPS ),认为 TEPS 与椎间盘的退变程度成正比,并为椎间盘的生物学治疗提供参考依据,累计 6 分是终板破裂与否的临界分数,超出意味椎间盘退变的机率增加两倍,建议低于临界分数可能适合于生物学和椎间盘再生治疗。
五、椎间盘的扩散分型研究
生物学及再生医学成为治疗退变椎间盘疾患的新方法[32-33],如何鉴别衰老及退变椎间盘仍有争议[34],以往主要集中在椎间盘形态学及组织学检查研究上,但未获得良好的结果[29]。研究发现,在衰老及退行性病变的椎间盘中,终板常见异常改变,如 Modic 改变,Schmorl 结节等,终板结构破裂等情况下改变了椎间盘的扩散特点[9]。DCE-MR 显示异常的扩散途径为椎体、终板及外髓核的信号同时在 10 min 时达到峰值,而正常的扩散方向及终板延迟途径已完全消失,邻近终板结构破裂的外部髓核初始发生异常信号增强,然后逐渐渐缓,可能为终板破裂后,造影剂逆流出髓核,导致髓核信号强度减少[13]。2008 年Rajasekaran 等[31]对 365 名人体腰椎间盘注射钆双胺观察衰老及退行性椎间盘的扩散途径及口服药物前后的扩散变化,系统性的研究椎间盘扩散营养通道特点,根据终板的信号改变程度、是否发生 Modic 改变、髓核与椎体的接触程度、终板的损伤范围和终板是否骨化分为 I~VI 损伤改变,并据此分为 5 种营养途径扩散类型,A:终板结构完整,MR 上有正常的双低信号带,无信号增强缺失和反常增强或降低。B:在图像上观察局部髓核和椎体近乎完全接触,但其它区域无明显的扩散特点改变,说明终板较薄弱,远期增加终板结构损伤概率。C:终板局部病灶处髓核外部信号呈高改变表现,但扩散信号带改变仅限于终板局部病灶,髓核内部无高信号改变,认为虽然终板已有破损,但远期退变几率仍较小。D:终板损伤处的髓核外部高信号改变并延及髓核内部。E:终板延迟及正常途径的营养扩散途径方向均改变,髓核内部有异常的高信号改变,该作者认为具有类型 D、E 类型特点可定义为退变性椎间盘。为研究椎间盘各区域的信号改变与时间的相关性,根据椎间盘营养途径的 TIC 特点对其营养改变类型分为 4 类[14]:( 1 ) TIC 曲线髓核最初有信号增强缓慢,6 h 时达到信号峰值,此为正常椎间盘信号改变特点;( 2 ) TIC曲线显示为增强信号减弱,峰值信号延迟,此为年老型椎间盘信号改变特点;( 3 ) TIC 曲线显示有信号增强双峰值,两个峰值分别代表了造影剂在血管内不同的流速时相和正常终板结构的扩散相,此模式常见于局部损伤的椎间盘退变;( 4 ) TIC 曲线出现较早的高信号 ( 约 1.6 h ) 并持续 12 h,此为退变性椎间盘。因此根据注射造影剂后观察椎间盘的结构改变、终板的损伤类似、扩散模式、TIC 曲线和 Pfirrmann 分级 5 个方面来鉴别健康、年老和退变的间盘[32]( 表 1 ),为鉴别椎间盘的损伤类型提供比较准确的方法。
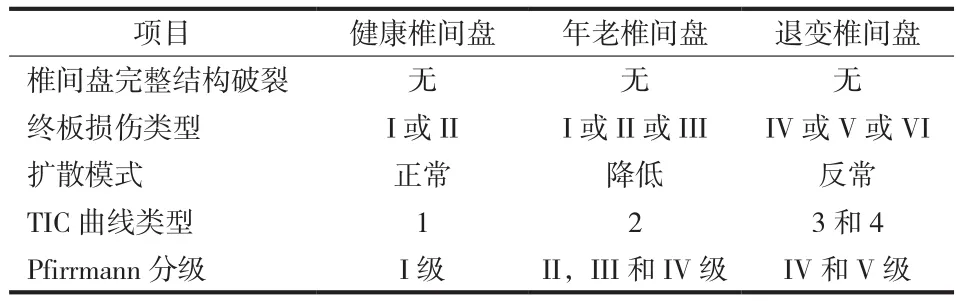
表1 不同类型椎间盘的 MRI 鉴别特点Tab.1 MRI characteristic of different tipes of interveitebral disc
六、腰椎血管改变及药物治疗后的椎间盘扩散 DCEMRI 研究
研究证实腰动脉狭窄与椎间盘的退变有一定的关联,血管造影术可以发现腰动脉狭窄后椎体内毛细血管网血流减少,营养物质供应缺乏[35]。然而,Niinimäki 等[28]研究发现腰动脉狭窄并不是绝对影响因素,分析原因其一是动脉狭窄不会直接影响椎间盘内血供减少,但可能会促进其它诸如终板等结构改变,二是椎间盘动脉血供较多,单根血供减少不会影响其它血液调节。然而对于腰椎间盘供应节段血管的全部狭窄会导致何种结果,并未进行研究。人体出生后即有小血管穿行于椎体软骨终板,中央多于四周,在青春期这些血管逐渐消失,椎间盘仅外侧纤维环浅部可见毛细血管,成为基本无血管供应的组织,Boost等[29]发现 10~16 岁时血管消失速度增快。终板与椎体间血管芽的多少决定了椎体骨-软骨终板-椎间盘界面的通透性,椎体髓腔血窦与软骨终板间有直接接触,营养物质通过血窦-软骨界面进行扩散,组织学检测显示髓核区终板内血管芽呈膨大交错,具有很大的接触面积,因而渗透性比较高,内层纤维环区的血管芽仅呈单一的襻状结构,其接触面小,则渗透性较低,外层纤维环区终板内无血管芽,软骨下骨板增厚,椎体血窦与软骨无直接沟通,无渗透能力[36]。Learman 等[1]DCE-MR 研究发现<11 岁组和>20 岁组两组之间的椎体及髓核信号峰值存在统计学差异性,11~20 岁组则与以上两组相比差异无统计学意义,此也说明青少年终板血管减少对髓核营养影响较大。动物实验证实尼莫地平可能会增加终板血管数量[37],终板区域的毛细血管网含有较多的感受器,接受刺激后能够调节血流,研究也证实口服药物后终板信号强度较前增加了11% 并使信号峰值提前,但药物的作用机制、治疗时期等机制仍需进一步研究[37]。
七、展望
及时有效地检测椎间盘营养通道对完善治疗计划、延长间盘生存期和改善生存质量具有非常重要的意义。DCE-MRI 成像的参数分析将更加准确,能够通过对椎间盘内部血流动力学及营养物质扩散信息的检测,为椎间盘是否退变的诊断与鉴别、合理治疗方案的选择和客观评价等多个临床重要环节,提供重要的参考指标。目前,制约DCE-MRI 发展的主要因素是椎间盘解剖结构的清晰显示( 尤其终板 ) 以及参数计算的精确化、程序化、简单化。尽管腰椎 DCE-MRI 的研究才刚刚起步,尚需要不断深入研究,但它将具有相当好的应用前景,并且,作为活体检测椎间盘营养途径,将在多种生物治疗及内固定优化设计中发挥更大的作用。
[1]Learman K, Ellis AR, Goode AP, et al. Physical therapists’clinical knowledge of multidisciplinary low back pain treatment guidelines. Phys Ther, 2014, [Epub ahead of print].
[2]Vadala G, Russo F, Di Martino A, et al. Intervertebral disc regeneration: from the degenerative cascade to molecular therapy and tissue engineering. J Tissue Eng Regen Med, 2013, [Epub ahead of print].
[3]Bendtsen M, Bunger CE, Zou X, et al. Autologous stem cell therapy maintains vertebral blood fow and contrast diffusion through the endplate in experimental intervertebral disc degeneration. Spine, 2011, 36(6):E373-379.
[4]Rinkler C, Heuer F, Pedro MT, et al. Infuence of low glucose supply on the regulation of gene expression by nucleus pulposus cells and their responsiveness to mechanical loading. J Neurosurg Spine, 2010, 13(4):535-542.
[5]Kanazawa Y, Miyati T, Sato O. Hemodynamic analysis of bladder tumors using T1-dynamic contrast-enhanced fast spinecho MRI. Eur J Radiol, 2012, 81(8):1682-1687.
[6]Tanabe JL, Yongbi M, Branch C, et al. MR perfusion imaging in human brain using the UNFAIR technique. Un-inverted flow-sensitive alternating inversion recovery. J Magn Reson Imaging, 1999, 9(6):761-767.
[7]Mross K, Drevs J, Muller M, et al. Phase I clinical and pharmacokinetic study of PTK/ZK, a multiple VEGF receptor inhibitor, in patients with liver metastases from solid tumours. Eur J Cancer, 2005, 41(9):1291-1299.
[8]Collins JM. Imaging and other biomarkers in early clinical studies: one step at a time or re-engineering drug development?J Clin Oncol, 2005, 23(24):5417-5419.
[9]Rajasekaran S, Venkatadass K, Naresh Babu J, et al. Pharmacological enhancement of disc diffusion and differentiation of healthy, ageing and degenerated discs: Results from in-vivo serial post-contrast MRI studies in 365 human lumbar discs. Eur Spine J, 2008, 17(5):626-643.
[10]Rajasekaran S, Babu JN, Arun R, et al. ISSLS prize winner: A study of diffusion in human lumbar discs: a serial magnetic resonance imaging study documenting the influence of the endplate on diffusion in normal and degenerate discs. Spine, 2004, 29(23):2654-2667.
[11]Rajasekaran S, Naresh-Babu J, Murugan S. Review of postcontrast MRI studies on diffusion of human lumbar discs. J Magn Reson Imaging, 2007, 25(2):410-418.
[12]Martin MD, Boxell CM, Malone DG. Pathophysiology of lumbar disc degeneration: a review of the literature. Neurosurg Focus, 2002, 13(2):E1.
[13]Virri J, Gronblad M, Savikko J, et al. Prevalence, morphology, and topography of blood vessels in herniated disc tissue. A comparative immunocytochemical study. Spine, 1996, 21(16):1856-1863.
[14]Natarajan RN, Ke JH, Andersson GB. A model to study the disc degeneration process. Spine, 1994, 19(3):259-265.
[15]Adams MA. Biomechanics of back pain. Acupunct Med, 2004, 22(4):178-188.
[16]Nguyen-minh C, Haughton VM, An HS, et al. Contrast media of high and low molecular weights in the detection of recurrent herniated disks. AJNR Am J Neuroradiol, 1998, 19(5):889-893. [17]Urban JP, Winlove CP. Pathophysiology of the intervertebral disc and the challenges for MRI. J Magn Reson Imaging, 2007, 25(2):419-432.
[18]Soukane DM, Shirazi-Adl A, Urban JP. Computation of coupled diffusion of oxygen, glucose and lactic acid in an intervertebral disc. J Biomech, 2007, 40(12):2645-2654.
[19]Ibrahim MA, Haughton VM, Hyde JS. Enhancement of intervertebral disks with gadolinium complexes: comparison of an ionic and a nonionic medium in an animal model. AJNR Am J Neuroradiol, 1994, 15(10):1907-1910.
[20]Nguyen-minh C, Riley L, Ho KC, et al. Effect of degeneration of the intervertebral disk on the process of diffusion. AJNR Am J Neuroradiol, 1997, 18(3):435-442.
[21]Perlewitz TJ, Haughton VM, Riley LH, et al. Effect of molecular weight on the diffusion of contrast media into cartilage. Spine, 1997, 22(23):2707-2710.
[22]Ibrahim MA, Jesmanowicz A, Hyde JS, et al. Contrast enhancement of normal intervertebral disks: time and dose dependence. AJNR Am J Neuroradiol, 1994, 15(3):419-423.
[23]Akansel G, Haughton VM, et al. Diffusion into human intervertebral disks studied with MR and gadoteridol. AJNR Am J Neuroradiol, 1997, 18(3):443-445.
[24]邓绍强, 杨汉丰, 杜勇, 等. 感兴趣区大小对正常腰椎间盘ADC值测量的影响. 实用医学杂志, 2012, 28(13): 2223-2225.
[25]Goh V, Schaeffter T, Leach M. Reproducibility of dynamic contrast-enhanced MR imaging: why we should care. Radiology, 2013, 266(3):698-700.
[26]Urban JP, Smith S, Fairbank JC. Nutrition of the intervertebral disc. Spine, 2004, 29(23):2700-2709.
[27]韩志华, 陈春, 吴剑宏, 等. 犬正常腰椎间盘的动态增强MRI特征研究. 中国脊柱脊髓杂志, 2014, 24(3):244-250.
[28]Niinimaki J, Korkiakoski A, Parviainen O, et al. Association of lumbar artery narrowing, degenerative changes in disc and endplate and apparent diffusion in disc on postcontrast enhancement of lumbar intervertebral disc. MAGMA, 2009, 22(2):101-109.
[29]Boos N, Weissbach S, Rohrbach H, et al. Classifcation of agerelated changes in lumbar intervertebral discs: 2002 Volvo Award in basic science. Spine, 2002, 27(23):2631-2644.
[30]Savvopoulou V, Maris TG, Koureas A, et al. Degenerative endplate changes of the lumbosacral spine: dynamic contrastenhanced MRI profiles related to age, sex, and spinal level. J Magn Reson Imaging, 2011, 33(2):382-389.
[31]Rahme R, Moussa R. The modic vertebral endplate and marrow changes: pathologic signifcance and relation to low back pain and segmental instability of the lumbar spine. AJNR Am J Neuroradiol, 2008, 29(5):838-842.
[32]Martin JT, Milby AH, Chiaro JA, et al. Translation of an engineered nanofibrous disc-like angle-ply structure for intervertebral disc replacement in a small animal model. Acta Biomater, 2014, 24(2):S1742-17061.
[33]Karajan N, Otto D, Oladyshkin S, et al. Application of the polynomial chaos expansion to approximate the homogenised response of the intervertebral disc. Biomech Model Mechanobiol, 2014, [Epub ahead of print].
[34]Takegami K, An HS, Kumano F, et al. Osteogenic protein-1 is most effective in stimulating nucleus pulposus and annulus fbrosus cells to repair their matrix after chondroitinase ABC-induced in vitro chemonucleolysis. Spine J, 2005, 5(3): 231-238.
[35]Tokuda O, Okada M, Fujita T, et al. Correlation between diffusion in lumbar intervertebral disks and lumbar artery status: evaluation with fresh blood imaging technique. J Magn Reson Imaging, 2007, 25(1):185-191.
[36]任先军, 彭城. 椎体终板形态与椎间盘营养的关系. 中国矫形外科杂志, 2002, 9(7):82-83.
[37]Melrose J, Smith SM, Little CB, et al. Recent advances in annular pathobiology provide insights into rim-lesion mediated intervertebral disc degeneration and potential new approaches to annular repair strategies. Eur Spine J, 2008, 17(9): 1131-1148.
( 本文编辑:马超 )
Research progress of nutrition diffusion pathway in lumbar discs by dynamic contrast enhanced-magnetic resonance imaging
CHEN Chun, GUO Yong, REN Ai-jun, RUAN Di-ke. Department of Orthopedics, Navy General Hospital of CPLA, Beijing, 100048, PRC
Intervertebral discs are the largest avascular structures in the body and depend entirely on the diffusion from blood vessels at the periphery for the supply of essential nutrients for cellular activity and the removal of metabolic wastes. Diffusion is the only source of nutrition to the intervertebral discs, and alteration of diffusion is considered to be the fnal common pathway for disc degeneration. Yet diffusion remains poorly understood due to the paucity of reliable methods to study noninvasive diffusion in human beings in vivo. In recent years, Dynamic Contrast Enhanced-Magnetic Resonance Imaging ( DCE-MRI ) has emerged as a powerful and reliable tool to analyze the diffusion in lumbar discs. Endplate structures have also been proved to have the function of controlling the process of diffusion, and can be identified by DCE-MRI. This review focuses on the current knowledge, methodology, various factors infuencing the diffusion properties of the discs and the quantitative analysis of the normal, aging or degenerative intervertebral discs of this promising technique.
Diffusion; Intervertebral disc degeneration; Spinal diseases; Magnetic resonance imaging
10.3969/j.issn.2095-252X.2014.08.012
R445.2, R681.5
国家自然科学基金 ( 81272044 )
100048 北京,海军总医院骨科 ( 陈春,阮狄克 );海军总医院放射科 ( 郭勇,任爱军 )
阮狄克,Email: ruandikengh@163.com
2013-09-05 )
