经皮内镜椎板间入路微创治疗游离脱垂型L5~S1椎间盘突出症
2014-02-14曾建成宋跃明孔清泉聂鸿飞王贤帝李柱海蒋虎山
曾建成 陈 果 宋跃明 孔清泉 聂鸿飞 王贤帝 李柱海 蒋虎山
. 脊柱微创外科 Minimally invasive spine surgery .
经皮内镜椎板间入路微创治疗游离脱垂型L5~S1椎间盘突出症
曾建成 陈 果 宋跃明 孔清泉 聂鸿飞 王贤帝 李柱海 蒋虎山
目的 探讨经皮内镜椎板间入路微创治疗游离脱垂型 L5~S1椎间盘突出症的手术技巧及临床疗效。方法2010 年 1 月至 2012 年 6 月,我科采用经皮内镜椎板间入路椎间盘切除术 ( percutaneous endoscopic interlaminar discectomy,PEID ) 微创治疗游离脱垂型 L5~S1椎间盘突出症 94 例。其中男 53 例,女 41 例,年龄 13~56 ( 平均 29.69 ) 岁。采用疼痛视觉模拟评分 ( visual analogue scale,VAS )、Oswestry 功能障碍指数 ( oswestry disability index,ODI )、改良 MacNab 评价临床疗效。结果平均随访 26.5 ( 12~37 ) 个月。平均手术时间 ( 66.4±8.4 ) min。每台手术术中平均透视时间 ( 0.5±0.2 ) s。所有患者术后腰腿痛、感觉肌力减退均有不同程度的缓解。术前、术后 1 天、术后 1、3、6、12 个月腰痛 VAS 评分分别为:( 5.40± 1.12 ) 分,( 3.36±0.96 ) 分,( 1.86±0.99 ) 分,( 1.18±0.83 ) 分,( 0.78±0.62 ) 分,( 0.58±0.64 ) 分;腿痛VAS 评分分别为:( 8.40±0.95 ) 分,( 2.66±1.53 ) 分,( 1.98±1.00 ) 分,( 1.20±0.81 ) 分,( 0.82±0.66 ) 分,( 0.68±0.62 ) 分。术前、术后 1、3、6、12 个月 ODI 指数分别为:51.88±8.88,33.22±10.33,23.46±7.47,15.10±5.72,10.38±5.93。术前与术后各时段腰腿痛 VAS 评分及 ODI 指数差异有统计学意义 ( P<0.01 )。末次随访时改良 MacNab 评价疗效,优良率 94.7%。结论经皮内镜椎板间入路椎间盘切除术微创治疗游离脱垂型 L5~S1椎间盘突出症具有创伤小、出血少、术中透视少、术后恢复快等优点,其近期疗效确切,远期结果有待进一步随访。
椎间盘移位;腰椎;外科手术,微创性;椎间盘切除术,经皮;椎板间入路
腰椎间盘突出症是脊柱外科最常见的疾病之一,游离脱垂型为腰椎间盘突出症的一种特殊类型。Yeung[1]发明了 YESS 系统,经后外侧椎间孔入路切除椎间盘髓核组织,成为最早的完全内镜腰椎间盘切除术 ( percutaneous endoscopic lumbar discectomy,PELD )。其最佳适应证为椎间孔型及极外侧型椎间盘突出症。但对于处理椎管内脱垂及游离的髓核组织效果不够理想。Ruetten 等[2]通过极外侧入路经椎间孔成功切除椎管内游离脱垂的髓核组织,使经皮内镜椎间孔入路腰椎间盘切除术 ( percutaneous endoscopic transforaminal discectomy,PETD )的手术适应证进一步扩大。但由于高髂嵴、肥大翼化的 L5横突及椎间孔骨性周界等的阻挡,使 PETD处理游离脱垂型 L5~S1椎间盘突出非常困难。Choi等[3]就曾采用 PEID 治疗游离脱垂型 L5~S1椎间盘突出症。PEID 以其特有的优势,在治疗游离脱垂型 L5~S1椎间盘突出症的过程中,取得了良好的效果。2010 年 1 月至 2012 年 6 月,我科对 94 例游离脱垂型 L5~S1椎间盘突出症患者行经皮内镜椎板间入路 L5~S1椎间盘切除术 ( percutaneous endoscopic interlaminar discectomy,PEID )。结合手术及随访情况,探讨游离脱垂型 L5~S1椎间盘突出症的临床特点,手术技巧、近期临床疗效及 PEID 治疗的适应证。现报告如下。
资料与方法
一、一般资料
本组共 94 例,男 53 例,女 41 例,平均年龄29.69 ( 13~56 ) 岁。病史 4 个月~ 3 年,均由术前影像资料证实为游离脱垂型 L5~S1椎间盘突出症。椎间盘髓核游离脱出侧别:左侧 58 例 ( 61.7% ),右侧 27 例 ( 28.7% ),后正中 9 例 ( 9.6% )。向椎间隙尾端游离脱垂 75 例,向椎间隙头端游离脱垂 18 例,髓核组织游离至硬膜囊后方 1 例。术前 VAS 评分:腰痛 ( 5.40±1.12 ) 分,腿痛 ( 8.40±0.95 ) 分;术前ODI 指数:51.88±8.88。76 例 ( 80.9% ) 直腿抬高试验阳性,其中 53 例 ( 56.4% ) 直腿抬高度数<30°。 75 例 ( 79.8% ) 有下肢相应支配区感觉障碍。72 例( 76.6% ) 有下肢肌力减退。9 例 ( 9.6% ) 有鞍区感觉减退或伴大小便障碍的马尾神经综合征表现。
纳入标准:( 1 ) 初次手术的游离脱垂型 L5~S1椎间盘突出;( 2 ) 腰痛伴一侧下肢放射痛明显,阳性体征与影像学资料基本一致;( 3 ) 影像学检查示单节段腰椎间盘突出不伴同侧侧隐窝狭窄者;( 4 ) 经正规保守治疗至少 6~8 周无效 ( 急性腰椎间盘突出伴马尾神经损伤者除外 )。脱垂型椎间盘突出指:在腰椎 MRI 上,突出的椎间盘髓核组织穿透纤维环全层,可穿破或不穿破后纵韧带,向头端或尾端移位超过椎间隙边缘 5 mm[4]。脱垂型椎间盘突出的髓核组织与椎间隙中的髓核组织仍有一定的联系。游离型椎间盘突出指:突出的髓核组织完全与椎间隙内的髓核组织分离,常常与椎间隙有一定的距离[5]。
排除标准:( 1 ) 椎间隙感染、结核、肿瘤等;( 2 ) 再次手术的复发型腰椎间盘突出症;( 3 ) 多节段腰椎间盘突出;( 4 ) 伴有广泛的腰椎管狭窄;( 5 ) 有腰椎不稳,如腰椎滑脱等。
二、手术方法
全身麻醉后,患者俯卧于俯卧垫上使腹部悬空。调整手术床,使患者腰前弓减小,尽量使椎板间隙张开,以利于工作管道进入。体表定位手术节段棘突,于相应节段后正中线旁开约 2.0~2.5 cm插入定位针,定位针深达关节突表面即可。C 型臂侧位透视确定手术节段。于定位手术节段棘突旁开5 mm 作一长约 7 mm 的纵行切口,切开深筋膜。置入铅笔头状的扩张管至黄韧带浅面,紧靠棘突根部。沿扩张管旋入工作管道,再次 C 型臂透视侧位,以确定其位置。取出扩张管,放入内镜。镜下以髓核钳清理黄韧带表面的纤维脂肪组织后,以 Ellman 双频射频电极紧贴 L5下关节突内侧缘在黄韧带上打 1 个孔,让冲洗的生理盐水沿黄韧带孔流入椎管内硬膜外,调整水压冲洗、松解粘连。将工作管道顺黄韧带开口紧贴 L5下关节突内侧缘旋入椎管。可见游离脱垂的髓核组织及受压的神经根( 图 1a )。以髓核钳夹除游离脱垂的髓核组织,双频射频电极消融絮状髓核并烧灼成形纤维环 ( 图 1b )。减压结束前,再次紧贴 S1神经根表面旋转管道,通过观察 S1神经根走行区域是否有残余的髓核组织及S1神经根活动度,来判断减压是否彻底,直至硬膜囊及神经根充分减压。经工作管道向神经根周围注入 40 mg 甲泼尼龙,拔出工作管道。1% 罗哌卡因切口局部浸润镇痛。可吸收线皮内缝合切口。
三、术后处理
术后根据患者腰腿痛缓解情况酌情口服非甾体类消炎镇痛药物 1~3 天,服药后 2 h 在腰围保护下下地活动,术后第 2 天出院。术后 1 个月在腰围保护下开始行腰背肌功能训练。术后 1 天记录患者腰痛及腿痛 VAS 评分。术后 1、3、6、12 个月门诊随访,记录患者腰痛及腿痛 VAS 评分、ODI 指数。术后 1 天复查腰椎 X 线片,术后 6、12 个月复查腰椎 MRI 及腰椎功能位 X 线片。末次随访时使用改良MacNab 评价疗效。
四、统计学分析
用单因素重复测量资料的方差分析比较术前及术后不同随访时间 VAS 及 ODI 变化情况。所有数据均经 SPSS 20.0 软件进行统计分析。P<0.05 为差异有统计学意义。

图 1 患者,男,41 岁,L5~ S1椎间盘左侧突出症 ( 游离脱垂型 ) a:游离脱垂的髓核组织 ( B ) 压迫神经根 ( A ),神经根表面有炎性增生血管;b:摘除游离脱垂髓核后,神经根 ( A ) 压迫解除。双极射频电极行纤维环成形术,纤维环及后纵韧带已皱缩成形 ( 黑色短箭头示 );c:术中减压时摘除脱垂的髓核组织Fig.1 Endoscopic view of a 41-year-old male patient with prolapsed and sequestrated disc herniation of L5-S1a: S1nerve root ( A ) was compressed by prolapsed and sequestrated nucleus pulposus ( B ), with infammatory vascular proliferation; b: After discectomy, the nerve root was decompressed ( A ). Annuloplasty had been made with bipolar probes with high-frequency current manufactured by Ellman. Annulus fbrosus and posterior longitudinal ligament shrink ( short black arrow ); c: The prolapsed nucleus pulposus was removed while decompression
表1 手术前后腰腿痛 VAS 评分比较 ( n = 94,±s )Tab.1 Comparison of the preoperative and postoperative VAS scores of low back and leg pain ( n = 94,±s )

表1 手术前后腰腿痛 VAS 评分比较 ( n = 94,±s )Tab.1 Comparison of the preoperative and postoperative VAS scores of low back and leg pain ( n = 94,±s )
项目 术前 术后 1 天 术后 1 个月 术后 3 个月 术后 6 个月 术后 12 个月腰痛 VAS 5.40±1.12 3.36±0.96 1.86±0.99 1.18±0.83 0.78±0.62 0.58±0.64腿痛 VAS 8.40±0.95 2.66±1.53 1.98±1.00 1.20±0.81 0.82±0.66 0.68±0.62
结 果
本组 94 例均顺利完成手术。手术时间 ( 66.4± 8.4 ) min,每台手术术中 C 型臂平均透视时间 ( 0.5± 0.2 ) s。住院时间 ( 5.5±1.3 ) 天。本组所有病例均获得随访。平均随访 16.5 ( 9~20 ) 个月。所有患者术后腰腿痛、感觉肌力减退均有不同程度的缓解,术后 1 年复查腰椎 MRI 显示手术部位神经根和硬膜囊压迫解除,椎间盘后缘瘢痕修复、塑形良好( 图 2 )。术后 6、12 个月两个随访时间点比较,腰痛及腿痛 VAS 评分、ODI 指数变化差异无统计学意义 ( P>0.05 )。其余所有随访时间点腰痛及腿痛VAS 评分、ODI 指数差异有统计学意义 ( P<0.01 ) ( 表 1,图 3~5 )。末次随访改良 MacNab 评价疗效,优 76 例,良 13 例,中 4 例,差 1 例,优良率94.7%。术后 33 例 ( 35.1% ) 下肢仍残留有轻微麻木、酸胀不适,末次随访时有 20 例完全恢复,其余患者下肢有轻微麻木症状但不影响生活,患者对手术效果满意。术后 12 例 ( 12.8% ) 患者出现腿部疼痛、麻木加重,伴有痛觉过敏,口服塞来昔布至术后 1 周,甲钴胺至术后 1 个月,疼痛麻木于术后1 周内明显缓解,术后 2~3 周逐渐消失,末次随访时 8 例腿部仍残留轻微麻木症状,患者对手术效果满意。1 例术后踝背伸、踝跖曲、趾背伸、伸膝肌力下降为 3 级,伴鞍区感觉减退及解小便费力加重。予口服塞来昔布、甲钴胺片、普瑞巴林至术后1 周,上述症状,于术后 3 个月基本消失。1 例下肢症状缓解后 6 个月,类似症状再次出现。行腰椎MRI 证实为手术节段髓核再次突出,予口服塞来昔布、甲钴胺保守治疗,下肢疼痛得到明显缓解而无需行翻修手术。本组无手术节段错误,无途中转开放手术,无感染、椎间盘炎或硬脊膜、神经根损伤病例。
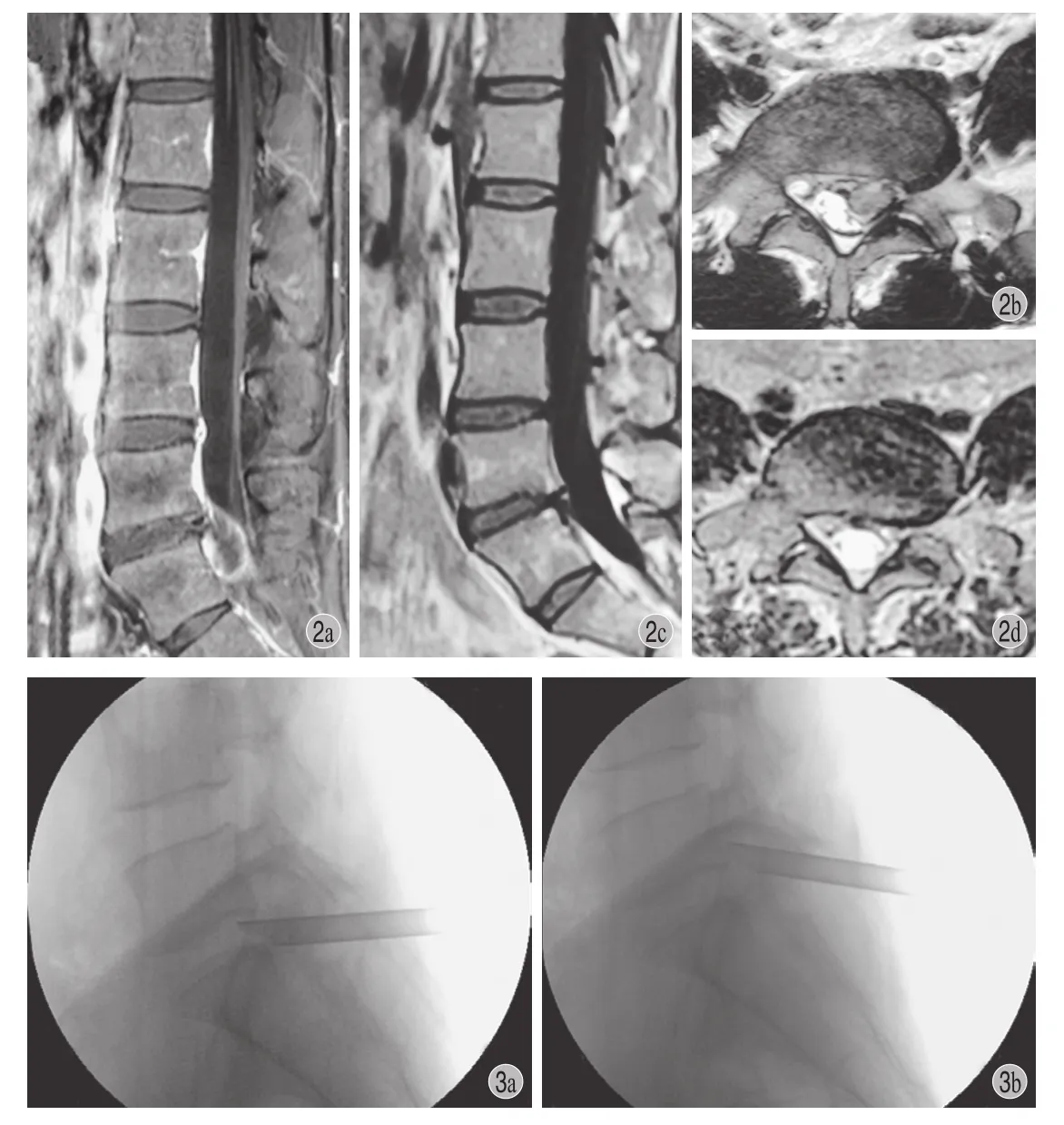
图 2 患者,男,41 岁,L5 ~ S1 椎间盘左侧突出症 ( 脱垂型 ),伴骶椎腰化,行 PEID a:手术前 MRI 矢状位,示突出的 L5 ~ S1 椎间盘髓核组织脱垂于 S1 后缘中份,硬膜囊及马尾神经受压;b:术前 MRI 横断面,S1 椎弓根平面可见脱垂的髓核组织。c:术后 1 年 MRI 矢状位可见突出髓核已被摘除,硬膜囊无受压;d:术后 1 年 MRI横断面显示硬膜囊及神经根受压解除,L5 ~ S1 椎间盘后缘瘢痕修复、塑形良好图 3 患者,女,45 岁,L5 ~ S1 椎间盘左侧突出症 ( 脱垂型 ),行 PEID a:术中见工作管道既可以在 S1 后上缘摘取向下脱垂的髓核组织;b:亦可以在 L5 后下缘摘取向上脱垂的髓核组织Fig.2 A 41-year-old male with L5-S1 prolapsed disc herniation and lumbarization underwent PEID a: The sagittal image of preoperative lumbar MRI showed disc herniation prolapsed to the medium part of S1 posterior edge with the dural sac and cauda equina being compressed; b: The axial image of preoperative lumbar MRI showed the prolapsed nucleus pulposus at the level of S1 vertebral pedicle; c: At 1 year after the operation, the sagittal image of lumbar MRI showed that the herniated disc was removed and the dural sac was decompressed; d: At 1 year after the operation, the axial image of lumbar MRI showed no signs of the dural sac or nerve root compression. Well-moulded scar tissue could be seen at the posterior edge of L5-S1 disc Fig.3 C-arm images of a 45-year-old female patient with prolapsed disc herniation of L5-S1 receiving PEID a: Caudally prolapsed nucleus pulposus could be removed from posterosuperior edge of S1 vertebral body throughworking channel; b: Similarly, cranially prolapsed nucleus pulposus could be removed from posteroinferior edge of L5 vertebral body through working channel

图 4 腰痛及腿痛 VAS 评分:术后 1 天腰痛、腿痛 VAS 评分与术前相比,差异有统计学意义 ( P < 0.01 )。术后 1 年随访腰痛、腿痛 VAS 评分与术后 1 天相比,又有进一步改善,差异有统计学意义 ( P < 0.01 )图 5 ODI 指数:术前与术后1、3、6 个月比较,差异有统计学意义 ( P < 0.01 )。术后 12 个月与 6 个月比较,差异无统计学意义 ( P > 0.05 )Fig.4 The VAS scores of lowback and leg pain. There were statistically signifcant differences between the preoperative VAS scores and that at 1 day after the operation. Further improvement was noticed at 1 year after the operation, and statistically signifcant differences existed when compared the scores at 1 day after the operationFig.5 There were statistically signifcant differences among the ODI scores preoperatively and at 1, 3, 6 months after the operation ( P<0.01 ). No statistically signifcant differences were found between the scores at 12 months after the operation and that at 6 months after the operation ( P>0.05 )
讨 论
游离脱垂型椎间盘突出患者往往有较长的慢性腰痛病史,因为一个诱因如久坐劳累,弯腰抬重物,打喷嚏咳嗽等,诱发急性的神经根性症状及进行性的神经功能损害加重。疼痛一般比较剧烈,患者常无法平卧而采取屈髋屈膝的强迫体位。疼痛在弯腰、长距离行走、咳嗽、打喷嚏、憋气时加重。本组病例下肢疼痛于咳嗽、打喷嚏时加重者占 84.0%。双下肢相应神经根支配区浅感觉减退,支配的肌肉无力,深反射减弱或消失。直腿抬高试验多为阳性 ( 本组 80.9% )。约 10% 的游离脱垂型椎间盘突出患者会出现马尾神经综合征[6],表现为鞍区感觉减退,大小便潴留或失禁,男性阴茎勃起不能。
游离脱垂型,特别是一些突出髓核游离至硬膜囊背侧的椎间盘突出需要与椎管内原发或转移瘤、滑膜囊肿、硬膜外脓肿或血肿等鉴别。仔细阅读术前 MRI 对鉴别诊断很有帮助。不同类型的肿瘤在MRI 上呈不同的表现,当 MRI 平扫鉴别困难时,还可以行增强 MRI 检查。MRI 增强扫描上,髓核组织周围常常有强化,而肿瘤内部往往有强化。这主要是髓核周围有肉芽组织增生及血管化,对比剂在血管化的肉芽组织内聚集的结果。
脱垂游离的物质主要是髓核,还包括纤维环和软骨终板。除引起神经压迫 ( 如最常见的坐骨神经痛主要是由脱垂游离的髓核压迫相应节段过往神经根及出行神经根所引起 ) 和椎管狭窄外,还会引起一系列由白介素 -6、白介素 -8、前列腺素 E2 等介导的免疫炎症反应[4]。脱垂游离的髓核在椎管内可以向头端、尾端,内侧、外侧移位,可以位于硬膜囊腹侧。游离型髓核还可以移位到硬膜囊背侧,甚至可能穿透硬膜囊至硬膜囊内直接压迫马尾神经。游离的髓核可以是一整块,也可以是多个碎块。文献报道[7],脱垂游离的髓核在椎管内如何移位,主要是由纤维环破口的位置及硬膜外腔结构所决定。由于受到后纵韧带及连于其上的纤维膜的限制,游离脱垂的髓核在椎管内向后方及后外侧移位最为常见。亦可向头端、尾端移位。如果纤维环破口位于椎间盘上终板,髓核主要向头端移位。如果纤维环破口位于椎间盘下终板,髓核主要向尾端移位。如果纤维环破口位于外侧靠近椎弓根,则髓核很容易沿椎弓根移位到侧方甚至是硬膜囊背侧。
PEID 在治疗腰椎间盘突出症有如下优势:穿刺定位快,术中透视 X 线暴露时间短 ( 本组每例手术平均透视 4~6 次 ),镜下硬膜囊、神经根等重要结构均清晰可见,便于保护,且可直接摘除椎管内突出或脱出的椎间盘组织,在完全直视下对椎管进行彻底减压,减压效果确切,有手术创伤小,恢复快,并发症少等优点[8-11]。而对于游离脱垂型 L5~S1椎间盘突出,PEID 相比于 PETD 更具有独到的优势。从 L1~L5,椎间孔的直径逐渐减小,又因部分椎间盘髓核组织游离脱垂于椎间隙以外,椎间隙内残余髓核脱水变性体积变小致椎间隙变窄,以及关节突关节增生肥大,使椎间孔可操作的范围更加狭窄[2]。高髂嵴、肥大翼化的 L5横突、椎间孔骨性周界的阻挡、背根神经节及由椎间孔出行的神经根限制了工作管道的充分移动,致摘除向头端或向尾端脱垂的髓核组织非常困难[3,12-13]。即便 Ruetten 等[2]介绍,经椎间孔极外侧入路能一定程度上摘除游离脱垂型椎间盘突出,但其处理的最大范围为:最远至脱垂游离的椎间盘髓核在头端椎体椎弓根下缘,在尾端椎体椎弓根中份之上。他们仔细阅读患者术前的标准腰椎 X 线正侧位片,对侧位片上髂嵴高于手术节段椎间孔上位椎体椎弓根中份者予以排除。其文中也明确提到,不是所有脱垂的髓核都可以通过椎间孔入路甚至极外侧入路摘除。对于不适合椎间孔入路的患者,Ruetten 选择椎板间入路。而 Choi等[14]介绍,其经椎间孔摘除向下游离脱垂的髓核组织,必须用环锯切除上关节突的外上缘,行椎间孔成形术。而对于髓核极度向下脱垂的情况,还须切除阻挡操作的椎弓根的上缘和中份。其一定程度上增加了手术时间、术中出血及术后腰椎不稳发生的可能性。
L5~S1椎间盘后缘在相应的椎板间隙以上者占26.7%,与椎板间隙上部相对者占 40%,与椎板间隙正相对者占 33.3%。故对于大部分向尾端脱垂的髓核组织,其刚好正对 L5~S1椎板间隙,工作管道突破黄韧带后即可见游离脱垂的髓核组织。另一些情况下,脱垂的髓核组织完全位于硬膜囊神经根前方,旋转工作管道至神经根肩部进行适当松解,旋转内倾管道,即可在 S1椎体后上缘看到游离脱垂的髓核组织 ( 图 3a )。Ruetten 等[15]和 Choi 等[3]提到,由于 L5~S1椎板间隙与椎间隙不平行,导致处理椎间隙内髓核组织时非常困难。笔者对此有不同的观点:术中全麻下患者取俯卧位,利于椎板间隙尽量张开。工作管道紧贴下关节突内侧缘进入椎管后,通过向头侧外侧旋转倾斜管道,同侧活动的关节突关节可为工作管道的移动让出空间,即所谓的“漂移技术”。文献报道[16],腰椎椎板有平均 14.92° 的向后下的倾斜角,如是使工作管道在椎管内可自如地向头端倾斜,方便摘除椎间隙内、向头端游离脱垂的退变的髓核组织 ( 图 3b )。对于向头端脱垂的髓核组织,还可以使用神经钩从髓核根部向椎管尾端钩取髓核,如“钓鱼”一般将髓核组织钩入工作管道内予以摘除。
PELD 以其创伤小,出血少,恢复快等优点,为椎间盘突出患者带来了福音。但其手术操作一定程度上须依靠术中 C 型臂透视,且过多的射线暴露会增加患者及医护人员罹患实体肿瘤、血液系统肿瘤及白内障等的几率[17-18],故患者及医护人员的术中射线暴露量成为一个广受关注的问题。尽管术中的透视时间与患者体重、病例的复杂程度、C 型臂仪器的设置、医师的手术技巧经验相关[19],但与 PETD 相比,术中透视少成为 PEID 的一个显著优势。PELD 手术可分为穿刺阶段和内镜下直视减压阶段,射线暴露主要发生在第一个阶段。Ahn等[19]所做前瞻性研究显示,每台 PETD 手术的平均透视时间为 2.5 min。PETD 治疗游离脱垂型L5~S1椎间盘突出症手术过程中由于髂嵴的阻挡,给穿刺定位造成较大的困难,术中需要反复透视。对于高髂嵴和髓核脱垂严重的患者,有时还须磨髂骨、行椎间孔成形术,极大地增加了术中的射线暴露时间。而 PEID 手术入路为脊柱外科医生所熟悉,术中穿刺至黄韧带表面,靠近下关节突内侧缘后即可置入内镜,在直视下突破黄韧带。故术中透视时间明显少于 PETD。本组 PEID 术中 C 型臂一般透视4~6 次,每台手术平均透视时间 ( 0.5±0.2 ) s。医护人员均在铅屏的保护下进行透视。
游离脱垂型椎间盘突出的患者往往病史较长,脱垂的髓核组织会引起一系列由白介素 -6、白介素-8,前列腺素 E2 等介导的免疫炎症反应,使椎管内大量炎性血管增生、瘢痕组织形成[20]。术中松解神经根粘连、摘除髓核时难免对神经根有一定牵扯激惹。且神经根长期受压会发生复杂的病理生理学变化,发生由异常 ( 异位 ) 神经元放电、病理性纤维联系、伤害性感受器超敏等复杂机制引起的神经病理性疼痛[21]。本组 1 例术后出现踝背伸、踝跖曲、趾背伸、伸膝肌力下降为 3 级,伴鞍区感觉减退、解小便费力加重。再次复习患者病史及术前影像资料,发现患者病史长,症状以麻木无力为主伴以解小便费力、鞍区感觉减退表现为马尾神经综合征,突出的髓核组织体积大,硬膜囊神经根受压明显且伴有一定程度的骨性椎管狭窄、黄韧带增厚。术中见椎管内炎性血管增生,突出髓核与神经根硬膜囊粘连重,且摘除髓核后未处理增厚的黄韧带。故在本身即非常狭窄的椎管内操作,对神经根硬膜囊牵扯挤压较重,致患者术后出现下肢肌力下降,麻木及解小便费力加重。同样予上述保守治疗,患者症状于治疗后 3 个月基本消失,提示术前需仔细询问病史、阅读影像学资料,对术后可能出现的神经功能损害一过性加重做好解释沟通工作。对经皮内镜初学者,应尽量选择病史较短 ( 3 个月内为宜 ),以疼痛为主要表现的患者。手术应在清晰的视野下进行,熟悉镜下突出髓核、纤维环、后纵韧带、神经根、硬膜囊等解剖结构的辨别。强调术中尽量创造有效的操作空间,在旋转工作管道致神经根肩部困难的情况下,先适当摘除可见的突出髓核组织,创造有效的操作空间,使神经根松弛。再根据具体情况,将工作管道旋转至神经根肩部,进一步摘除髓核组织。
椎间盘突出症术后复发被定义为:腰椎间盘突出症术后症状缓解至少 6 个月,其后出现同一节段同侧或对侧椎间盘再次突出。Kim 等[22]研究证实,高龄、高体重指数 ( BMI )、术前 MRI 突出节段椎体可见 Modic 改变、脱垂型椎间盘突出为 PELD 术后复发的高危因素。这可能是由于高龄患者本身椎间盘髓核退变更加严重,椎间隙内大量松散的髓核组织可能在术后更容易再次突出。椎间盘内残余的髓核组织可能因机械负荷过大而再次突出。故体重指数大的患者可能因体重过大致椎间隙内残余髓核负荷过大而再次突出。Modic 改变是在椎间盘炎症、退变下,椎体发生的反应性改变。其反映了该脊柱节段的不稳定性。这可能是那些术前 MRI 突出节段椎体可见 Modic 改变的患者,术后复发率高的原因。而对于脱垂型椎间盘突出患者,Kim 等[22]认为由于 PELD 术中操作视野有限,很可能会遗留一些小的髓核组织无法完全摘除。若干时间后,这些残留的髓核组织可能单独地或与再次突出的髓核组织一起引起症状。但由于复发患者术后均有一段时间的症状缓解期,并且术后未即刻行 MRI 检查,故无法准确的判断是术中减压不彻底还是术后复发。并且Kim 等所提出的脱垂型椎间盘突出症术中易残留小的髓核组织未彻底摘除,其也与手术医生的手术技巧及手术经验密切相关。本组 1 例经 MRI 证实为术后复发。该患者为 36 岁中年女性,MRI 体重指数为30.04 ( 肥胖 ),术中摘除脱垂的及椎间隙后份的髓核组织并行纤维环成形术,根据神经根活动度及术毕前镜下再次探查,判断减压彻底。患者术后出院前症状几乎完全缓解 ( 腿痛 VAS 评分由术前 8 分,降低到术后 24 h 的 1 分 )。但出院时患者未带腰围并坐长途车颠簸回家,回家后半个月即开始弯腰行轻体力劳动,术后 7 个月再次出现右下肢牵扯性疼痛,行腰椎 MRI 检查示 L5~S1椎间盘再次向右后方突出。上述提示为降低经皮内镜椎间盘切除术后复发风险,除提高手术技巧、积累手术经验,术中彻底减压,预防性地摘除椎间隙后份松散变性的髓核组织,行纤维环成形术外,围手术期告知患者注意事项,指导患者培养健康的生活方式也非常重要。
综上所述,PEID 治疗游离脱垂型 L5~S1椎间盘突出症具有创伤小,出血少,术中透视少,术后恢复快等优点,其近期疗效确切,远期结果有待进一步随访证实。
[1]Yeung AT. Minimally invasive disc surgery with the yeung endoscopic spine system (YESS). Surg Technol Int, 1999, 8:267-277.
[2]Ruetten S, Komp M, Godolias G. An extreme lateral access for the surgery of lumbar disc herniations inside the spinal canal using the full-endoscopic uniportal transforaminal approachtechnique and prospective results of 463 patients. Spine, 2005, 30(22):2570-2578.
[3]Choi G, Prada N, Modi HN, et al. Percutaneous endoscopic lumbar herniectomy for high-grade down-migrated L4-L5 disc through an L5-S1 interlaminar approach: a technical note. Minim Invasive Neurosurg, 2010, 53(3):147-152.
[4]Tsou PM, Yeung AT. Transforaminal endoscopic decompression for radiculopathy secondary to intracanal noncontained lumbar disc herniations: outcome and technique. Spine J, 2002, 2(1):41-48.
[5]Milette PC. Classification, diagnostic imaging, and imaging characterization of a lumbar herniated disk. Radiol Clin North Am, 2000, 38(6):1267-1292.
[6]Sarliève P, Delabrousse E, Clair C, et al. Intradural disc herniation with cranial migration of an excluded fragment. Clin Imaging, 2004, 28(3):170-172.
[7]Dösoğlu M, Is M, Gezen F, et al. Posterior epidural migration of a lumbar disc fragment causing cauda equina syndrome: case report and review of the relevant literature. European Spine J, 2001, 10(4):348-351.
[8]吕国华, 王冰, 刘伟东, 等. 完全内窥镜下经椎板间入路手术治疗腰椎间盘突出症. 中国脊柱脊髓杂志, 2010, 20 (6): 448-452.
[9]Ruetten S, Komp M, Merk H, et al. Full-endoscopic interlaminar and transforaminal lumbar discectomy versus conventional microsurgical technique: a prospective, randomized, controlled study. Spine, 2008, 33(9):931-939.
[10]曾建成, 王贤帝, 宋跃明, 等. 经皮内镜椎板间入路微创治疗青少年腰椎间盘突出症. 中国骨与关节杂志, 2013, 2(4): 199-203.
[11]张立岩, 张西峰, 肖嵩华, 等. 经椎板间孔入路间断内窥镜下治疗L5~S1椎间盘突出症疗效分析. 中国修复重建外科杂志, 2011, 25(10):1164-1167.
[12]李振宙, 侯树勋, 宋科冉, 等. 经椎板间隙入路完全内窥镜下椎间盘摘除术治疗 L5~S1 非包含型椎间盘突出症. 中国脊柱脊髓杂志, 2013, 23(9):771-777.
[13]陈果, 曾建成, 宋跃明, 等. 经皮内镜椎板间入路微创治疗腋下型腰5~骶1椎间盘突出症. 中国矫形外科杂志, 2014, 22(13):1169-1175.
[14]Choi G, Lee SH, Lokhande P, et al. Percutaneous endoscopic approach for highly migrated intracanal disc herniations by foraminoplastic technique using rigid working channel endoscope. Spine, 2008, 33(15):E508-515.
[15]Ruetten S, Komp M, Merk H, et al. Use of newly developed instruments and endoscopes: full-endoscopic resection of lumbar disc herniations via the interlaminar and lateral transforaminal approach. J Neurosurg Spine, 2007, 6(6):521-530.
[16]宗立本, 左金良. 腰椎椎板的解剖测量及临床意义. 中国矫形外科杂志, 1999, 6(11):872-873.
[17]Phan N, Boreham DR. Health effects from low dose occupational and medical radiation exposure and the role of adaptive response. Health Phys, 2011, 100(3):286-287.
[18]Mroz TE, Yamashita T, Davros WJ, et al. Radiation exposure to the surgeon and the patient during kyphoplasty. J Spinal Disord Tech, 2008, 21(2):96-100.
[19]Ahn Y, Kim CH, Lee JH, et al. Radiation exposure to the surgeon during percutaneous endoscopic lumbar discectomy: a prospective study. Spine, 2013, 38(7):617-625.
[20]Burke JG, Watson RW, McCormack D, et al. Intervertebral discs which cause low back pain secrete high levels of proinflammatory mediators. J Bone Joint Surg Br, 2002, 84(2):196-201.
[21]王建, 周跃, 李长青, 等. 经皮内镜椎间盘切除术治疗慢性椎间盘源性腰痛的初步研究. 中国修复重建外科杂志, 2009, 23(4):400-403.
[22]Kim JM, Lee SH, Ahn Y, et al. Recurrence after successful percutaneous endoscopic lumbar discectomy. Minim Invasive Neurosurg, 2007, 50(2):82-85.
( 本文编辑:王萌 李贵存 )
Percutaneous endoscopic interlaminar discectomy for prolapsed and sequestrated L5-S1lumbar disc herniation
ZENG Jian-cheng, CHEN Guo, SONG Yue-ming, KONG Qing-quan, NIE Hong-fei, WANG Xian-di, LI Zhu-hai, JIANG Hu-shan. Department of Orthopedics, West China Hospital of Sichuan University, Chengdu, Sichuan, 610041, PRC Corresponding author: SONG Yue-ming, Email: hx_sym@163.com
ObjectiveTo investigate the surgical techniques and clinical effects of percutaneous endoscopic interlaminar discectomy ( PEID ) in the treatment of prolapsed and sequestrated L5-S1lumbar disc herniation. MethodsA total of 94 patients with L5-S1prolapsed and sequestrated lumbar disc herniation were treated by PEID from January 2010 to June 2012. There were 53 males and 41 females, whose average age was 29.69 years old ( range: 13-56 years ). The Visual Analogue Scale ( VAS ), Oswestry Disability Index ( ODI ) and modifed MacNab criteria were used for the evaluation of clinical effects.ResultsAll the patients were followed up for a mean period of 26.5 months ( range: 12-37 months ). The mean operation time was ( 66.4±8.4 ) min. The average intraoperative fluoroscopy time was ( 0.5±0.2 ) s. Sensory disturbance, muscle weakness and low back and leg pain were alleviated in different degrees after the operation in all the patients. The VAS scores of low back pain were ( 5.40±1.12 ), ( 3.36±0.96 ), ( 1.86±0.99 ), ( 1.18±0.83 ), ( 0.78±0.62 ) and ( 0.58±0.64 ) point preoperatively and at 1 day, 1 month, 3 months, 6 months and 12 months after the operation. The VAS scores of leg pain was ( 8.40±0.95 ), ( 2.66±1.53 ), ( 1.98±1.00 ), ( 1.20±0.81 ), ( 0.82±0.66 ) and ( 0.68±0.62 ) point in the corresponding follow-up time. The ODI scores were 51.88±8.88, 33.22±10.33, 23.46±7.47, 15.10±5.72 and 10.38±5.93 preoperatively and at 1 month, 3 months, 6 months and 12 months after the operation. Statistically signifcant differences existed in the VAS scores and ODI scores of low back and leg pain preoperatively and in the corresponding follow-up time ( P<0.01 ). The excellent and good rate was 94.7%in the latest follow-up according to the modifed MacNab criteria. Conclusions PEID is a safe, effective and minimally invasive procedure in the treatment of prolapsed and sequestrated L5-S1lumbar disc herniation, with the advantages of less trauma, less blood loss, less intraoperative fuoroscopy and quick recovery. Its short-term results are satisfactory, while its long-term outcomes require further follow-ups.
Intervertebral disc displacement; Lumbar vertebrae; Surgical procedures, minimally invasive; Diskectomy, percutaneous; Percutaneous endoscopic interlaminar discectomy
10.3969/j.issn.2095-252X.2014.08.005
Th776.1, R681.5
卫生部行业科研专项基金 ( 201002018 )
610041 成都,四川大学华西医院脊柱外科
宋跃明,Email: hx_sym@163.com
2014-06-13 )
