益气养阴祛瘀方与性激素对NOD小鼠的整体疗效及免疫功能的干预作用*
2014-02-06黄绥心王新昌肖丽群吴启富范永升
黄绥心 王新昌 肖丽群 吴启富 范永升
(1.浙江中医药大学,浙江 杭州 310053;2.浙江中医药大学附属第二医院,浙江 杭州310005;3.南方医科大学附属南方医院,广东 广州 510515)
干燥综合征(SS)是一种临床较为常见的自身免疫性疾病。益气养阴祛瘀方是依据SS气虚阴亏的主要病机特点组方而成,前期的研究表明,该方具有较好的临床疗效[1]。本研究在前期研究基础上,采用益气养阴祛瘀方和性激素治疗非肥胖糖尿病自发性SS模型小鼠。现报告如下。
1 材料与方法
1.1 动物 8周龄雌性非肥胖糖尿病(NOD)小鼠60只,ICR 小鼠 10 只,体质量(20.0±2.0)g,由上海斯莱克实验动物有限责任公司提供。NOD小鼠动物合格证号 SCXK (沪)2007-0005;ICR小鼠动物合格证号SCXK(沪)2008-0016。
1.2 仪器和试剂 动物电子天平(常熟市双杰测试仪器厂,型号TC3KH);精密电子天平(赛多利斯科学仪器北京有限公司,型号BS124S);小鼠肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒 (上海西唐生物技术有限公司,批号:1207261);小鼠白介素-6(IL-6)ELISA 检测试剂盒(上海西唐生物技术有限公司,批号1207251)。
1.3 药物 益气养阴祛瘀方组成:生地黄24 g,玄参15 g,麦冬 15 g,石斛 12 g,白芍 12 g,黄芪 24 g,丹参30 g,益母草15 g。以上药材购自浙江中医药大学中药饮片厂;脱氢表雄酮(美国Sigma公司,批号D4000);戊酸雌二醇(拜耳医药保健有限公司,批号035A);硫酸羟氯喹片(上海中西制药有限公司,批号101106)。
1.4 分组与给药 NOD小鼠60只,ICR小鼠10只,先适应性饲养1周,然后NOD小鼠按随机数字表法分为6组:模型组、羟氯喹组、益气养阴祛瘀方组(中药组)、脱氢表雄酮(DHEA)组、雌二醇(E2)组、脱氢表雄酮加雌二醇(DHEA+E2)组,每组10只。10只ICR小鼠为正常组。正常组和模型组给生理盐水灌胃,羟氯喹组给予羟氯喹药液75mg/kg,中药组给予益气养阴祛瘀方药液27.4 g/kg;DHEA组给予脱氢表雄酮混悬液37.5mg/kg;E2组给予雌二醇溶液 0.375mg/kg;DHEA+E2组给予DHEA 37.5mg/kg,E20.375mg/kg。 所有实验小鼠均以0.2mL/10 g灌胃12周。
1.5 检测指标 (1)饮水量测定。实验开始第1日起,每日给药前称重并记录各组小鼠饮水瓶质量,计算各组小鼠日均饮水量。分别在第9周末、第15周末和第20周末统计结果。计算公式:小鼠日均饮水量(g)=[前1 日全组饮水瓶质量(g)-当日全组饮水瓶质量(g)]/全组动物数。(2)唾液分泌量测定。分别在NOD小鼠第9、15和20周龄时用湿重法测各组小鼠唾液分泌量。具体方法:捡取干棉球1个,称其干质量为M0,质量在4.5~5.0mg范围。然后将棉球置于小鼠口颊内,并用镊子将其固定,5min后取出,在电子天平上称其湿质量M,(M-M0)即为小鼠唾液分泌量。(3)胸腺、脾脏和颌下腺指数测定。灌胃饲养12周后,小鼠取血后并断颈处死,分离脾脏、胸腺和颌下腺并精确称质量,计算小鼠脾脏指数和胸腺指数。(4)小鼠血清细胞因子检测。小鼠取血后,将血浆置于室温中30min以上,以3000 r/min离心15min,分离血清,冻存于-80℃超低温冰箱。采用ELISA法测定血清中TNF-α、IL-6,按照试剂盒说明书操作,绘制标准曲线,读取样本含量。
1.6 统计学处理 应用SPSS17.0统计软件。计量资料以±s)表示,多组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠每日饮水量比较 见表1。第9周末,NOD各组小鼠每日饮水量相近(P>0.05),但高于正常组(P<0.05)。第15周末时,除中药组外,各给药组饮水量均较模型组和同组第9周末时减少(P<0.05);DHEA组比羟氯喹组、E2组和DHEA+E2组更低 (P<0.05);且与正常组比较无显著差异(P>0.05)。第 20周末时,各给药组饮水量均较第15周末时进一步减少(P<0.05);与正常组比较,羟氯喹组、E2组和 DHEA+E2组的饮水量仍偏高(P<0.05)。9周龄时,与正常组比较,中药组小鼠每日饮水量更高(P<0.05)。15周龄时,中药组每日饮水量较模型组和9周龄时明显减少(P<0.05),与正常组比较无显著差异(P>0.05)。 20周龄时,中药组饮水量较第15周末时略有减少,且明显低于羟氯喹组(P<0.05)。
表1 各组小鼠每日饮水量比较(g,±s)
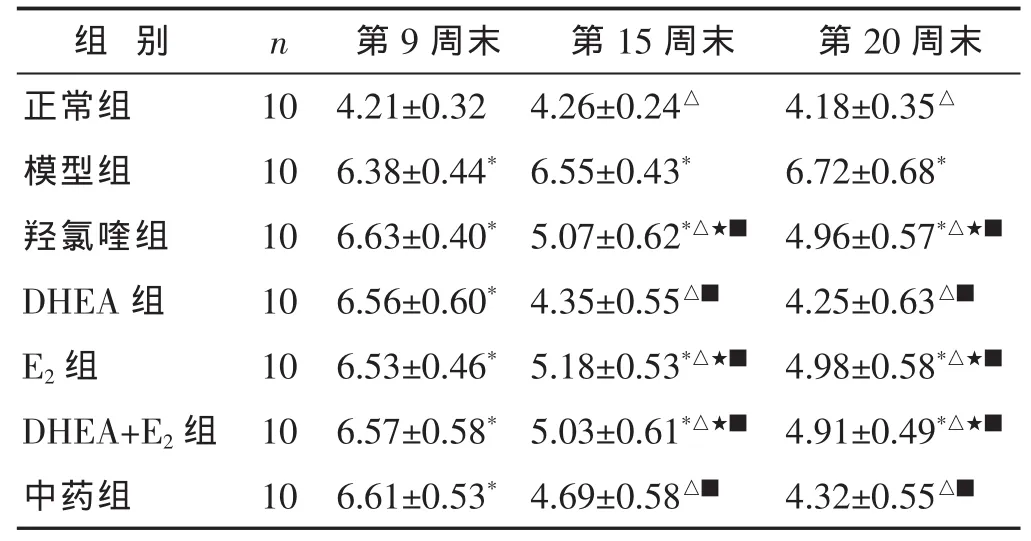
表1 各组小鼠每日饮水量比较(g,±s)
与正常组比较,*P<0.05;与模型组比较,△P<0.05;与 DHEA组比较,★P<0.05;与本组 9 周龄比较,■P<0.05。 下同。
第9周末 第15周末4.21±0.32 4.26±0.24△6.38±0.44*6.55±0.43*6.63±0.40* 5.07±0.62*△★■DHEA 组 10 4.25±0.63△■组 别 n 第20周末正常组 10 4.18±0.35△模型组 10 6.72±0.68*羟氯喹组 10 4.96±0.57*△★■6.56±0.60* 4.35±0.55△■E2组 10 6.53±0.46* 5.18±0.53*△★■ 4.98±0.58*△★■DHEA+E2组 10 6.57±0.58* 5.03±0.61*△★■ 4.91±0.49*△★■中药组 10 6.61±0.53* 4.69±0.58△■ 4.32±0.55△■
2.2 各组小鼠唾液分泌量比较 见表2。与正常组比较,模型组小鼠唾液分泌量明显减少(P<0.05)。第9周末时,NOD各组唾液分泌量相近(P>0.05),且明显低于正常组(P<0.05)。第15周末时,各给药组唾液分泌量比模型组明显增加(P<0.05);DHEA组唾液分泌量更高于羟氯喹组、E2组和本组第9周末(P<0.05)。第20周末时,各给药组小鼠唾液分泌量较15周末时稍有减少,但仍比模型组分泌量高(P<0.05);羟氯喹组、E2组、DHEA+E2组与同组 9 周末相近 (P>0.05),与DHEA组比较,DHEA+E2组分泌量与其有显著差异(P<0.05)。
表2 各组小鼠唾液分泌量比较(mg,±s)

表2 各组小鼠唾液分泌量比较(mg,±s)
第9周末 第15周末6.60±0.36△ 6.79±0.28△4.05±0.33*3.72±0.36*4.13±0.40* 4.54±0.33*△★DHEA 组 10 5.58±0.29*△■组 别 n 第20周末正常组 10 6.69±0.32模型组 10 3.71±0.18*羟氯喹组 10 4.49±0.37*△★4.06±0.30* 5.78±0.23*△■E2组 10 4.13±0.36* 4.52±0.26*△★ 4.47±0.25*△★DHEA+E2组 10 4.07±0.28*4.91±0.39*△ 4.77±0.38*△★中药组 10 4.11±0.33* 5.70±0.33*△■ 5.63±0.31*△■
9周龄时,中药组小鼠唾液分泌量低于正常组(P<0.05)。15周龄时,中药组唾液分泌量较9周末时增加明显,并显著高于模型组(P<0.05);与羟氯喹组比较,中药组唾液分泌量更高(P<0.05)。20周龄时,中药组唾液分泌量较15周末时略有减少,但仍高于模型组与羟氯喹组(P<0.05)。
2.3 各组小鼠胸腺、脾脏和颌下腺指数比较 见表3。与正常组比较,各组小鼠脾脏指数均升高(P<0.05);与模型组比较,羟氯喹组、DHEA组、中药组明显低于模型组(P<0.05);E2组、DHEA+E2组虽低于模型组,但差异无统计学意义(P>0.05)。与正常组比较,NOD各组胸腺指数均降低 (P<0.05),与模型组比较,DHEA组胸腺指数增高明显 (P<0.05);而羟氯喹组、E2组、DHEA+E2组与模型组相近(P>0.05)。与正常组比较,NOD各组小鼠颌下腺指数均降低,其中羟氯喹组、E2组和DHEA+E2组更低 (P<0.05);DHEA组与正常组相近(P>0.05),且高于模型组、羟氯喹组和 E2组(P<0.05)。与正常组比较,中药组胸腺指数仍偏低 (P<0.05),但高于模型组和羟氯喹组(P<0.05)。中药组小鼠颌下腺指数与正常组相近(P>0.05),但显著高于羟氯喹组(P<0.05)。
表3 各组小鼠胸腺、脾脏和颌下腺指数比较(mg/g,±s)

表3 各组小鼠胸腺、脾脏和颌下腺指数比较(mg/g,±s)
脾脏指数 胸腺指数3.02±0.34△ 1.68±0.15△4.08±0.29* 1.06±0.11*3.46±0.38△ 1.21±0.19*DHEA 组 10 0.69±0.13△★■组 别 n 颌下腺指数正常组 10 0.77±0.21△模型组 10 0.40±0.05*羟氯喹组 10 0.44±0.06*3.44±0.24△ 1.52±0.12△E2组 10 3.91±0.37* 1.22±0.11* 0.49±0.08*DHEA+E2组 10 3.83±0.20* 1.26±0.12* 0.53±0.10*中药组 10 3.52±0.45 1.45±0.15 0.66±0.08
2.4 各组小鼠血清TNF-α、IL-6水平比较 见表4。NOD各组小鼠血清TNF-α、IL-6水平均明显高于正常组(P<0.05);与模型组比较,羟氯喹组、DHEA 组和DHEA+E2组 TNF-α、IL-6 水平均降低明显(P<0.05)。中药组小鼠血清TNF-α、IL-6水平较模型组明显下降(P<0.05),比羟氯喹组降低更为明显(P<0.05);与正常组比较,中药组血清TNF-α、IL-6水平仍偏高(P<0.05)。
表 4 各组小鼠血清 TNF-α、IL-6 水平比较(mg/g,±s)

表 4 各组小鼠血清 TNF-α、IL-6 水平比较(mg/g,±s)
TNF-α IL-6 107.07±16.22△ 15.56±1.52△296.54±22.68* 34.62±6.42*230.95±17.98△ 25.59±3.15*DHEA 组 10 238.53±15.13△ 25.58±3.40△E2组 10 269.87±18.26* 29.47±4.16*DHEA+E2组 10 244.38±16.28* 27.83±5.65*中药组 10 193.61±12.32* 21.32±4.09*组 别 n正常组 10模型组 10羟氯喹组 10
3 讨 论
SS患者临床上常因涎腺和泪腺功能下降而出现口干、眼干症状,并伴有多器官、多系统的损害[2];其免疫病理本质是在遗传缺陷的基础上,局部非特异性感染导致局部和全身的免疫反应,进一步引发免疫机制的紊乱、炎症迁延,最终使得唾液腺、泪腺等外分泌腺受损,大量淋巴细胞、浆细胞及单核细胞浸润,腺管狭窄、萎缩和纤维化,从而导致唾液、泪液分泌减少出现口干渴、眼干症状[3]。
本研究采用的NOD小鼠是近年来实验研究应用较多的动物模型,其表现与人类SS相似,是动物实验研究SS 较为理想的模型[4-7]。
目前对SS尚无根治的疗法,临床主要应用的免疫抑制剂和糖皮质激素长期使用副作用较多。中医认为本病为先天禀赋不足,素体五脏羸弱,致气血不足而发病;先天阴精亏虚,津液生成减少,脏腑经络、筋骨百骸、四肢孔窍无以濡养而燥症外现。故本病辨证为气虚阴亏兼夹血瘀为本,燥热为标,治疗总则为益气养阴祛瘀。依此以黄芪、生地黄、玄参、麦冬、石斛、白芍、丹参、益母草等制方进行治疗。多数学者认为性激素在SS的发生、发展中应该起着重要作用,但调控机制和途径尚未能有明确的阐释[8]。本课题组前期研究发现[9],益气养阴祛瘀方对SS患者外周血雌、雄激素水平有较好的调整作用。
本研究应用益气养阴祛瘀方和性激素治疗NOD小鼠,从饮水量、唾液分泌量、胸腺、脾脏和颌下腺指数以及血清细胞因子等方面观察治疗作用,结果显示,益气养阴祛瘀方和DHEA可通过改善颌下腺的病理状态而缓解口干症状;DHEA提高唾液分泌量、改善口干的作用明显。
脾脏和胸腺均是机体内重要的免疫器官。通过检测胸腺指数和脾脏指数可以评价免疫器官的形态发育和免疫功能的状态。益气养阴祛瘀方和DHEA能改善脾脏指数和胸腺指数,抑制腺体萎缩,而达到调节机体免疫功能的作用。
研究已证实,SS外分泌腺的损害与淋巴细胞浸润及其中的细胞因子水平关系密切。由于多数浸润淋巴细胞为T细胞,因此T细胞被视为SS外分泌腺受损的关键因素。实验结果显示,NOD小鼠血清Th1型细胞因子TNF-α和Th2型细胞因子IL-6水平均较正常组明显增高,表明NOD小鼠存在高水平的Th1、Th2型细胞因子。应用益气养阴祛瘀中药和DHEA后,小鼠血清TNF-α、IL-6水平较模型组降低,表明益气养阴祛瘀中药和DHEA能降低血清TNF-α、IL-6水平,调节NOD小鼠免疫功能。
益气养阴祛瘀方和DHEA对NOD小鼠均有良好的疗效及改善免疫功能的作用,表明益气养阴祛瘀方具有类雄激素样的治疗作用。E2的治疗作用在本研究中未得到体现,可能是与实验的研究内容侧重于对唾液腺治疗观察有关,因此益气养阴祛瘀方与E2在治疗方面的比较是需要今后进一步探讨的问题。另外,笔者发现DHEA在合用E2后,其治疗作用均较单用DHEA疗效降低,原因是雄雌激素用药比例的问题抑或是存在不同的信号途径,其确切机理尚待深入研究。
[1] 王新昌,谢志军,温成平,等.益气养阴祛瘀法治疗原发性SS 的疗效观察[J].中国基层医药,2009,16(1):92-95.
[2] 中华医学会风湿病学分会.SS诊治指南(草案)[J].中华风湿病学杂志,2003,7(7):446-448.
[3] 颜淑敏,曾小峰.原发性SS诊治进展[J].实用医院临床杂志,2007,4(3):6-8.
[4] Szodoray P,Jonsson R.The BAFF/APRIL system in systemic autoimmune disease with a special emphasis on Sjogren′s syndrome[J].Scand JImmunol,2005,62(3):421-428.
[5] Yamamoto H,Sims NE,Macauley SP,etal.Alterrations in the secretory responseofnon-obese diabetic(NOD)mice tomuscarinic receptor stimulation[J].Clin Immunol Immunopathol,1996,78(2):245-255.
[6] Humphreys-Beher MG,Hu Y,Nakagawa Y,et al.Utilization of thenonobese diabetic(NOD) mouse as an animalmodel for the study of secondary Sjogren′s syndrome[J].Adv Exp Med Biol,1994,350(5):631-636.
[7] Yarnano S,Atkinson JC,Baum BJ,etal.Salivary gland cytokine gene expression in NOD and BALB/Cmice[J].Autoimmunity,1999,92(2):265-275.
[8] Laine M,et al.Segment-specific but pathologic laminin isoform profiles in human labial salivary glands of patients with Sj¨ogren’ssyndrome[J].ArthritisRheum,2004,50(12):3968-3973.
[9] 王新昌,谢志军,温成平,等.益气养阴祛瘀药对SS患者性激素水平影响的研究[J].浙江中医药大学学报,2009(1):48-50.
