HPLC法测定核桃楸叶中槲皮素、山奈酚含量
2014-01-24霍金海王伟明
谢 健 霍金海 王伟明
(黑龙江省中医药科学院·150036)
核桃楸叶为胡桃科胡桃属植物核桃楸(Julans Mandshurica Maxim.)的树叶。原植物核桃楸为胡桃科胡桃属落叶乔木,主要分布于中国东北、华北、河北等地区,其种子、青果,树皮均可入药[1-2]。
核桃楸叶作为核桃楸新的药用部位,现代药理学研究表明,其具有抗肿瘤[3]、抗氧化、抑菌[4]等活性,目前,学者已从核桃楸叶中分离出醌类、黄酮类、萜类、多酚类等多类型化合物,这些研究为核桃楸叶的开发提供了基础,但目未见关于核桃楸叶的质量控制的方法。
核桃楸叶中含有丰富的黄酮类成分,其中槲皮素和山奈酚是其典型代表化合物,现代药理学也表明槲皮素和山奈酚均具有抗肿瘤、抗氧化等活性[5],因此槲皮素和山奈酚可以作为控制核桃秋叶质量标准的指标性成分。本文采用HPLC法测定核桃楸叶中上述两种功效成分的含量,为核桃楸叶的开发提供研究数据。
1 仪器与试药
1.1 仪器
LC-2010CHT型高效液相色谱仪(日本岛津),BP211D型电子天平(Sartorius公司),DZG-303A超纯水机(颐洋企业发展有限公司),KQ-300DB型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
槲皮素对照品(100081-200406);山奈酚对照品(110861-200406)均由中国药品生物制品检定所提供;甲醇为色谱纯;水为超纯水;其他试剂均为分析纯。
核桃楸叶样品分别采于黑龙江省伊春市、五常市、宾县、方正、哈尔滨市,经黑龙江省中医药科学院初东君主任药师鉴定为胡桃科胡桃属植物核桃楸(Juglans mandshurica Maxim)的叶子,阴干后粉碎。
2 方法与结果
2.1 溶液的配制
2.1.1 对照品的配制 精密称取槲皮素,山奈酚对照品各2.53mg、3.71mg,置25mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成浓度分别为101.2µg·mL-1,148.4µg·mL-1溶液,0.45µmL滤膜过滤,得对照品溶液备用。
2.1.2 供试品的配制 取核桃楸叶约1.0g,精密称定,加甲醇25mL,称定重量,80℃回流1h,冷却,甲醇补足失重,过滤,微孔滤膜(0.45µmL)滤过,备用。
2.2 色谱条件
色谱柱DiamonsilC18(4.6mm×250mm,5µm);流动相:甲醇-0.2%磷酸(57:43),流速1.0mL·min-1,检测波长360nm,柱温:35℃,进样量10µL。
2.3 系统适应性试验
精密吸取对照品溶液和供试品溶液,按2.2项下色谱条件,分别进样10µL,记录色谱图,结果表明在此色谱条件下,槲皮素,山奈酚分离良好,分离度均>1.5,且理论塔板数均不低于4000。
2.4 线性关系考察
精密吸取槲皮素,山奈酚对照品溶液2.5、5.0、10、20、25µL,测定峰面积,以峰面积为横坐标,槲皮素、山奈酚量为纵坐标作标准曲线,测得回归方程:槲皮素Y=3423.3x+5.2652(r=0.9998),山奈酚Y=3313.1x+5.9435(r=0.9999)。结果表明,槲皮素在0.253µg~2.53µg范围内呈良好线性关系,山奈酚在0.371µg~3.71µg范围内呈良好线性关系。
2.5 精密度考察
分别精密吸取槲皮素,山奈酚对照品溶液连续进样5次,每次10µL,测定两种对照品的峰面积。结果,槲皮素,山奈酚峰面积的RSD分别为0.71%,0.65%,表明仪器精密度良好。
2.6 稳定性试验
分别精密吸取同一供试品溶液10µL,在0,2,4,6,8,10,12,24h进样,记录供试品溶液中槲皮素,山奈酚的峰面积,计算各成分含量。样品中槲皮素,山奈酚含量的RSD分别为1.26%,1.38%,表明样品样品溶液在24小时内稳定。
2.7 重复性试验
按2.1.2项下供试品处理方法平行处理6份样品,测定2种成分的峰面积,计算含量。结果样品中槲皮素,山奈酚含量的RSD分别为1.06%,1.24%,表明该方法重复性良好。
2.8 回收率试验
称取已知含量的核桃楸叶粉末0.5g,共6份。分别精密加入与药材相当量的槲皮素对照品(0.8 mg·mL-1)1mL,山奈酚对照品溶液(0.5 mg·mL-1)1mL,按2.1.2项下供试品制备方法制备,进样10µL,计算各对照品的平均加样回收率和RSD值,结果见表1、表2,测定槲皮素的平均回收率为98.62%、RSD值为1.45%;山奈酚平均回收率为99.02%、RSD值为1.11%。
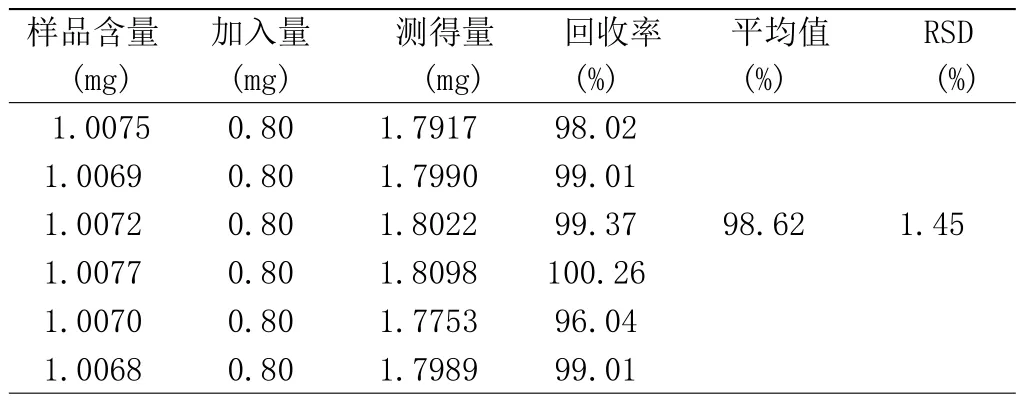
表1 槲皮素加样回收试验结果
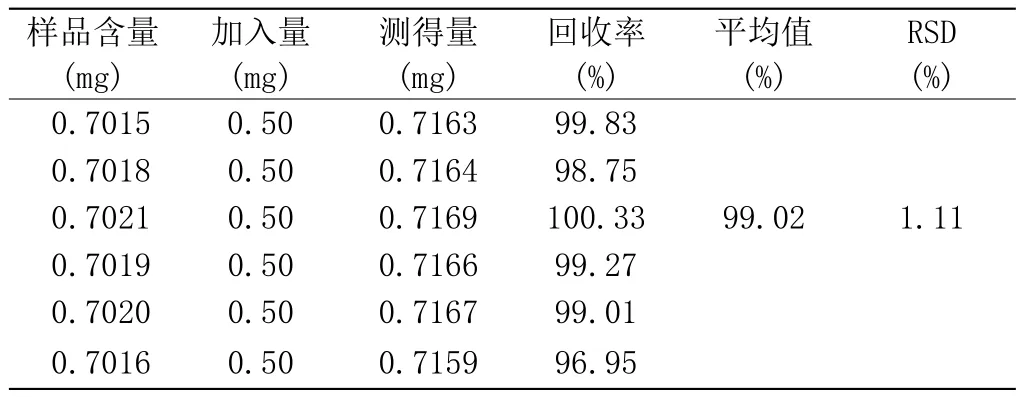
表2 山奈酚加样回收试验结果
2.9 样品含量测定
取五个产地样品,按2.1.2项下方法制备供试品溶液,采用2.2项下色谱条件进行两种成分的含量测定,结果见表3。
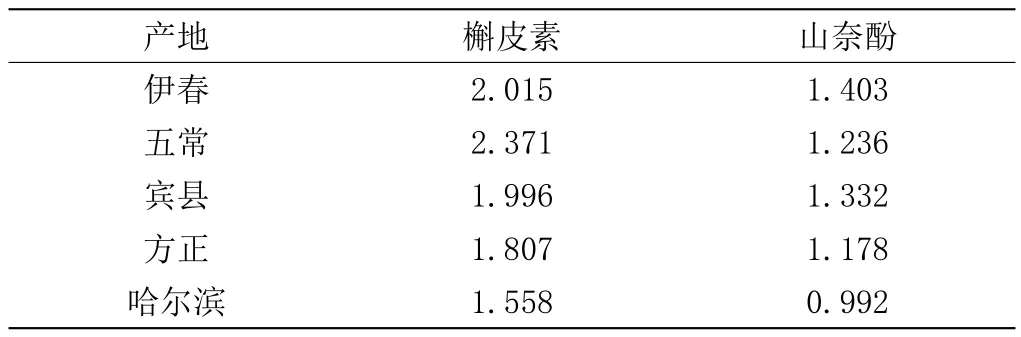
表3 五个产地核桃秋叶的槲皮素、山奈酚含量 (mg·g-1)
3 讨论
3.1 波长的选择
考察了250nm,265nm,280nm,360nm不同吸收波长的图谱,发现在360nm处,其吸收值达到最大,图谱特征性强,故以360nm作为检测波长。
3.2 流动相的选择
本实验采用甲醇-0.2%磷酸体系来分离,考察甲醇-0.2%磷酸57:43,55:45,53:47,50:50,最后确立了以甲醇-0.2%磷酸(57:43)为流动相分离度最好,确定流速为1.0mL/min。
3.3 提取条件的选择
在样品制备过程中,以超声和加热回流提取作对比,结果发现加热回流是超声提取的含量的一倍,后者提取效果比较好,另考察了提取时间,结果以每次1小时为最佳,最后以甲醇80℃回流1h为最佳。
本文建立了高效液相同时检测核桃秋叶中槲皮素和山奈酚的方法,简便快捷,容易掌握,对核桃秋叶质量标准的研究起到了一定的作用。
[1]吕海宁,折改梅,吕扬.核桃和核桃楸的化学成分及生物活性的研究进展.华西药学杂志[J].2010,25(4):489-493.
[2]孙墨珑,宋湛谦,方桂珍.核桃楸总黄酮及胡桃醌含量测定.林产化学与工业[J]. 2006,26(2):93-95.
[3]宋华,包永明,张红梅,等.核桃秋叶提取液对肿瘤细胞的抑制作用.大连轻工业学院学报[J].2001,20(2):109-111.
[4]髙岳芳,张丽,韩颖,等.核桃属植物叶的化学成分及生物活性研究进展.西北林学院学报[J].2010,25(4):165-169.
[5]周媛媛,王栋.核桃楸不同用药部位化学成分及药理活性研究进展.中华现代中医学杂志[J].2007,3(1):8-9.
[6]王树松,刘风云.不同生长期柿叶总黄酮和槲皮素的含量测定.药物鉴定[J].2007,16(9)22-23.
[7]林慧彬,谷延杰,林建强,等.HPLC法测定山东4种菟丝子槲皮素、山奈酚的含量.中成药[J].2003,25(8):649-651.
[8]浦锦宝,梁卫青,郑军献,等.HPLC法测定三青叶中槲皮素、山奈酚的含量.中国中医药科技[J].2011,18(2):134-135.
[9]余济海,邹盛勤.高效液相色谱法同时测定杜仲叶芦丁和槲皮素含量的研究.安徽农业科学[J].2006,34(10):2170-2171.
[10]李福荣,史卫锋,程国量.HPLC法测定青龙衣中胡桃醌的含量.药物研究[J].2007,4(12):164-165.
