山奈酚-铜配合物的合成、表征及抗氧化活性研究
2022-05-25陈天昱厉诗娴周坤鹏
陈天昱 张 雷 厉诗娴 周坤鹏 林 悦 李 婧
(黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆 163319)
黄酮类化合物具有良好的抗氧化活性,它能够清除人体内自由基、促进抗氧化因子再生、抑制自由基酶的产生、与金属离子螯合提高抗氧化酶的水平,是一种优良的天然抗氧化剂[1]。山奈酚是黄酮类化合物中比较有代表性的一种,具有抗氧化、抗炎、抗癌、止咳等作用[2]。它主要来源于山奈(一种姜科植物)的根茎中,广泛存在于各种蔬菜、水果中。根据中药配位化学理论,天然药物的药理学活性大都源于其内含有机物与矿物质之间形成配合物产生的协同作用[3]。山奈酚的化学结构中具有超离域度和大π键共轭体系,分子中的羰基氧和羟基具有很高的活性可与多种金属离子发生配位反应[4]。通过制备黄酮类化合物的金属离子配合物,观察其理化性质及生物活性的改变,以找寻提高其在生物体内作用效果的方法是近些年研究的热点[5]。本文将铜与山奈酚进行配位,制得山奈酚-铜配合物,并研究其在体外清除自由基的能力,为山奈酚金属配合物的进一步研究提供参考。
1 材料与方法
1.1 药品与试剂
山奈酚(上海麦克林公司),新戊酸铜(天津致远),溴化钾(天津光复),1,1-二甲基-2-三硝基苯肼(DPPH·上海阿拉丁试剂),Tris-base(Santa Cruz),邻苯三酚(上海阿拉丁试剂),30%H2O2(南京试剂公司),试剂、药品均为分析纯。
1.2 仪器
JENWAY 6715型超微量紫外分光光度计;Thermo Fisher Scientific Nicolet 380型红外光谱仪(KBr压片法),Vario Micro cube元素分析仪。
1.3 方法
1.3.1 配合物的合成
山奈酚2 mmol充分溶解于15 mL无水乙醇,新戊酸铜1 mmol(或0.5 mmol)充分溶解于15 mL无水乙醇;将二者混合,置于85 ℃水浴中冷凝回流60 min,冷却后10 000 r/min离心5 min,去上清,留固态沉淀自然挥干,用无水乙醇淋洗三次后干燥,得到黑色产物,为配合物1(或配合物2)。
1.3.2 待测样品溶液的配置
精密称量0.001 4 g山奈酚粉末,用无水乙醇溶解定容于10 mL容量瓶,制成浓度为500 nmol/mL山奈酚乙醇待测溶液,呈淡黄色;精密称量0.003 2 g铜配合物,以DMSO溶解,定容10 mL制成浓度500 nmol/mL待测溶液,呈橙黄色。将上述两种待测溶液按梯度稀释为250、125、62.5、31.3、15.6、7.8、3.9、2和1 nmol/mL共10个浓度。
1.3.3 清除DPPH自由基能力测定
精密称量0.002 g DPPH固体,用无水乙醇溶解并定容于10 mL棕色容量瓶,制得500 nmol/mL DPPH溶液;取1.5 mL EP管加入0.5 mL DPPH溶液和0.5 mL样品溶液,震荡均匀后于室温条件下用锡箔纸遮盖避光反应35 min,以无水乙醇为背景,在517 nm处测其紫外吸光度A1;将样品溶液替换为样液所用溶剂,重复上述过程,记录紫外吸光度A0;将DPPH替换为无水乙醇,仍加入0.5 mL样品溶液,重复上述过程,并记录紫外吸光度A2。
DPPH清除率(%)=[A0-(A1-A2)]/A0×100%。
精密称量0.605 7 g Tris-base固体,用双蒸水溶解定容于50 mL容量瓶,制成0.1 mmol/mL Tris溶液;量取浓盐酸4.3 mL,用双蒸水定容50 mL,制成1 mmol/mL的HCl溶液;精密称量0.006 3 g邻苯三酚固体,用0.01 mmol/mL HCl溶液溶解,并定容至100 mL,制成500 nmol/mL邻苯三酚溶液。
取1.5 mL EP管加入0.5 mL邻苯三酚溶液和0.2 mL Tris溶液,混匀后反应1.5 min,加入0.5 mL样品溶液,震荡均匀,反应5 min,最后加入0.125 mL HCl溶液(1 mmol/mL)终止反应,303 nm测紫外吸光度A1;将样品溶液替换为溶剂,重复上述过程,303 nm 处测紫外吸光度A0;测定各浓度山柰酚及其铜配合物试样溶液在303 nm处的吸光度A2。
2 结果与分析
2.1 山奈酚配合物的制备
黄酮类化合物的3′-OH,4′-OH,3-OH,4-C=O等均会参与金属配位,可形成多种配位化合物[6]。反应物中新戊酸铜的新戊酸根也具有配位能力。不同反应物用量可能形成多种配位化合物[7]。本实验采用两种配比反应,探索山奈酚的配位情况。在合成过程中两个配比反应情况相同,产物通过表征验证结构组成。
2.2 山奈酚及配合物红外光谱
山奈酚及配合物的红外光谱主要代表性基团分布见表1。红外图谱及特征峰比较结果显示,山奈酚的羰基振动频率υ(C=O)位置为1 655 cm-1,形成配合物后位于1 635 cm-1,向低波数方向位移了20 cm-1,可见山奈酚的4-C=O参与了配位,使羰基成键电子更加偏向氧原子。配合物在618 cm-1出现了υ(Cu-O)振动,说明有铜的配位键生成。配合物1和配合物2苯环π键共轭体系υ(C=C)为1 603 cm-1和1 602 cm-1,相对于山奈酚的1 625 cm-1,向低波数方向位移了22 cm-1和23 cm-1这是由于配合物中形成了一个稳定的新环而使共轭效应增强所致。在1 200~1 300 cm-1,υ(C-O)振动峰的强度明显减弱,并伴有蓝移,证明配体中有部分羟基参与了配位。山奈酚的酚羟基的υ(O-H)和芳醚键的υ(C-O-C)在形成配合物后变化不大。

表1 山奈酚及其铜配合物的主要吸收峰归属(cm-1)
2.3 山奈酚及配合物的紫外光谱
山奈酚是典型的黄酮类化合物,在200~400 nm存在两个主要的紫外特征吸收带[8]。如图1所示,山奈酚和配合物的紫外吸收谱图均有2个强吸收带,其中山奈酚的长波区带Ⅱ在365 nm处,属于π→π*电子跃迁;短波区带Ⅰ位于267 nm处,属于n→π*电子跃迁。而配合物1和的配合物2的主要吸收带分别是带Ⅰ281 nm,带Ⅱ420 nm,且两个配合物的吸收带位置相同。对比配体和配合物的两处紫外吸收带,两种配合物的吸收带均发生了红移,且吸收强度下降。这很可能是由于 Cu2+与配体中3-OH和4-C=O形成新环,使得整个分子的共轭体系增长,电子的离域程度增大,导致电子跃迁时所需的能量降低,故紫外吸收峰红移[9]。

图1 山奈酚、山奈酚铜配合物1、2的紫外光谱
综合红外与紫外结果,配合物1与配合物2的谱图及各主要基团的峰值极为接近。考虑到测量中一些不可避免的误差,二者差别可以忽略。因此推断配合物1和2在化学结构上相同,且酸根未参与配合物的形成。
对配合物进行元素分析,实际值C:55. 61%,H:2.97%;理论值C:55.13%,H:3.21%。综合多项实验结果,推断该配合物的结构如图2所示。
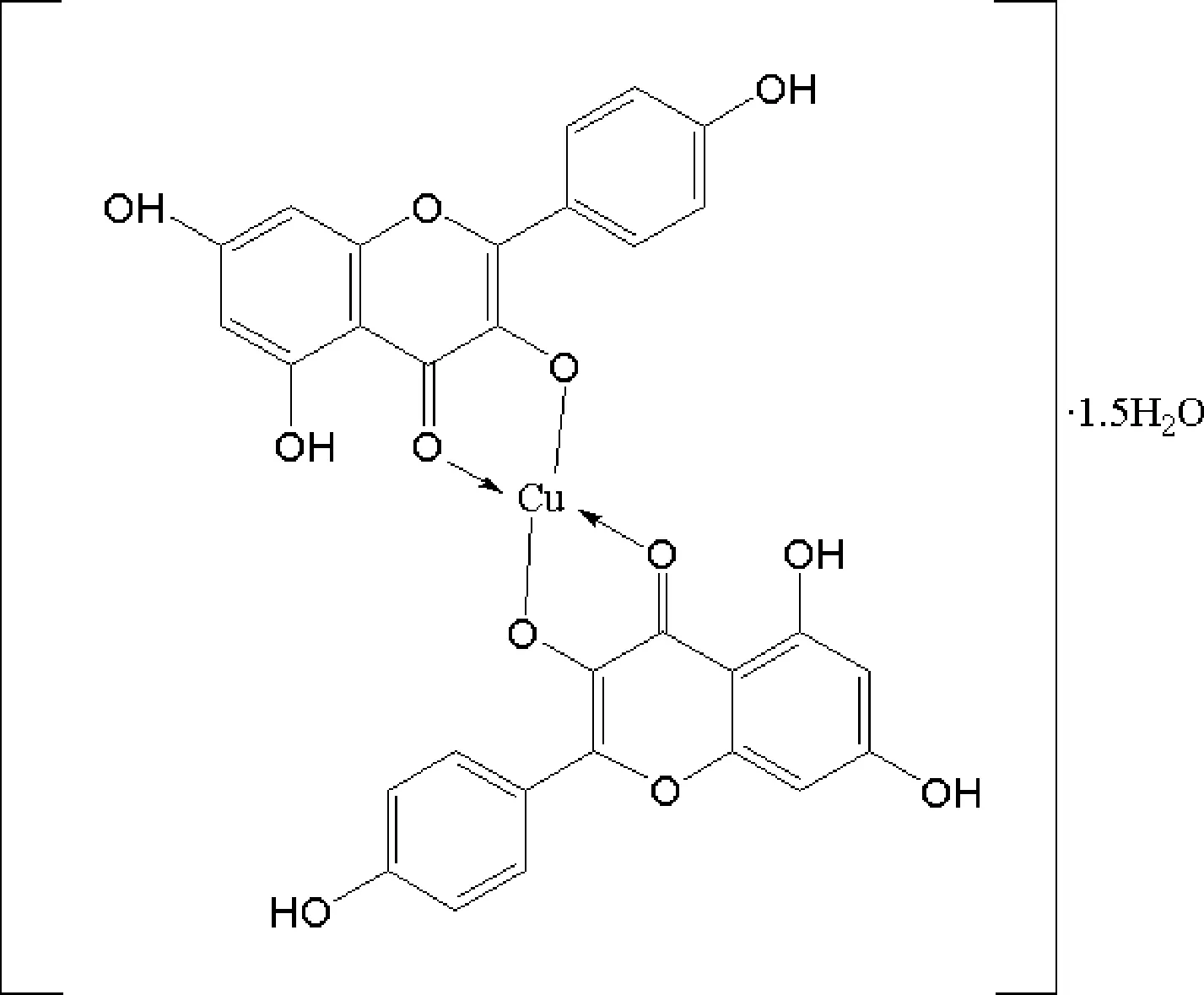
图2 山奈酚铜配合物的分子结构图
2.4 抗氧化活性测定
2.4.1 山奈酚及山奈酚-铜配合物对DPPH自由基的清除作用
由图3可以看出,山奈酚及其铜配合物清除DPPH自由基的能力都随着浓度的增加而增加。在试样浓度达到125 nmol/mL后基本达到完全清除的效果。在试样浓度小于2 nmol/mL时山奈酚清除DPPH自由基的效果略优于配合物。在浓度大于3.9 nmol/mL小于125 nmol/mL时,配合物的效果要略优于山奈酚。浓度大于125 nmol/mL后,两者基本都能达到完全清除的效果。整体上看,山奈酚-铜配合物清除DPPH自由基的效果要略优于山奈酚本身。
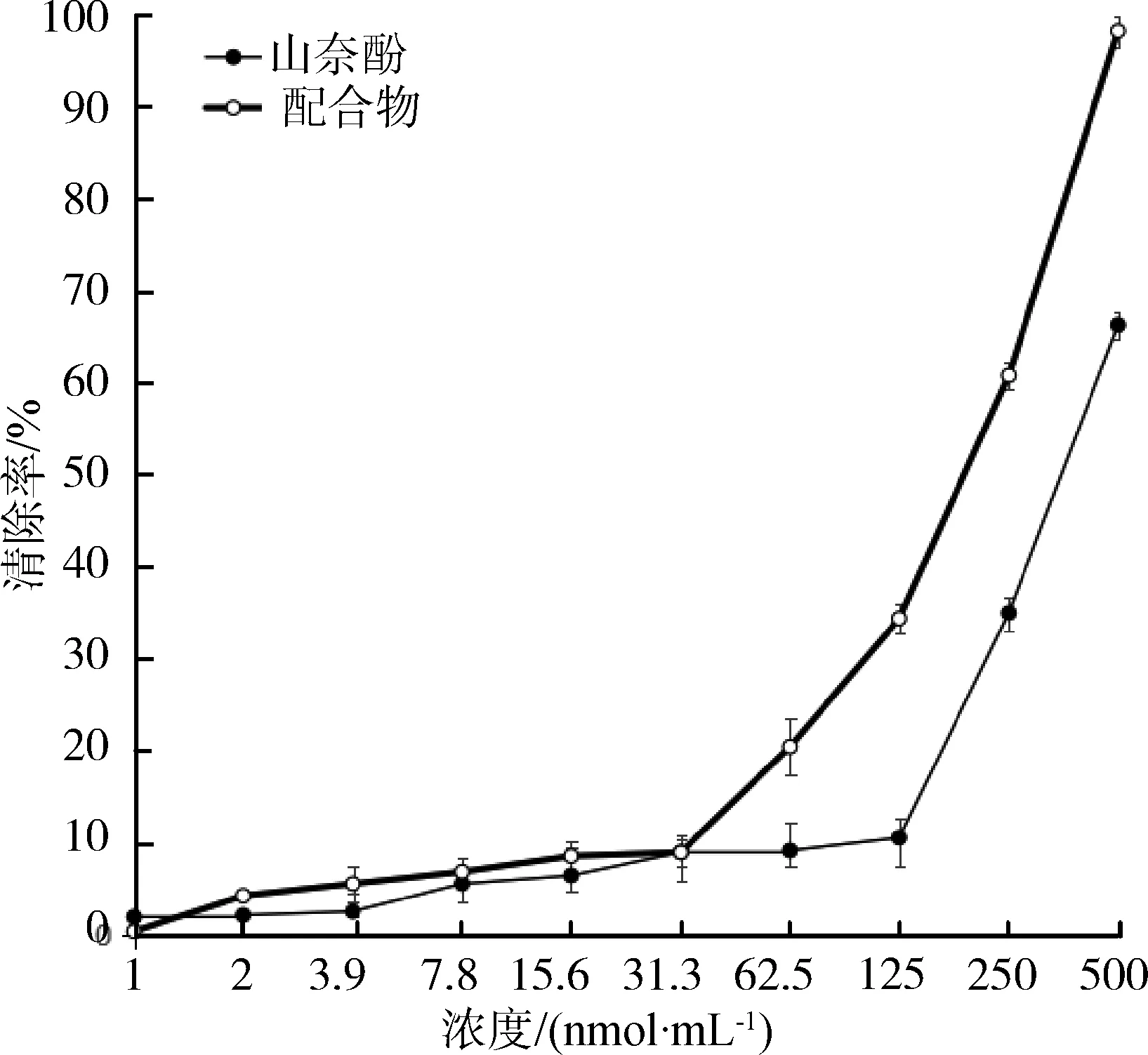
图4 山奈酚及其铜配合物对自由基的清除效果
3 结论