产葡萄糖异构酶细胞的固定化
2013-12-23邓辉,陈晟,陈坚,吴敬,*
邓 辉,陈 晟,陈 坚,吴 敬,*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学生物工程学院,工业生物技术教育部重点实验室,江苏 无锡 214122)
木糖异构酶(xylose isomerase,Xiase,EC 5.3.1.5),又称葡萄糖异构酶(glucose isomerase,GIase),在胞外可以催化D-葡萄糖至D-果糖的异构化反应,是食品工业生产上以淀粉为原料制备果葡糖浆的关键酶之一[1]。目前果葡糖浆的生产多采用固定化葡萄糖异构酶,即通过物理、化学的方法把GIase固定成具有高活力、水不溶性、颗粒状的固定化酶制剂,由此实现了生产的连续化、自动化、可控化,并使产品易于分离和精制,从而提高产品质量,降低生产成本,有力地推动了果葡糖浆生产的发展。
固定化酶制剂主要有两种,一种为固定化酶,另一种为固定化产酶细胞。由于天然来源的GIase几乎均为胞内酶,因此产GIase细胞的固定化相对GIase酶的固定化省去了酶的分离提取成本,同时减少了酶活损失,并且GIase的作用底物和产物都是小分子单糖,能自由进出细胞,所以细胞固定化技术是用来制作固定化GIase制剂的首选方法。
单位质量的酶活力是衡量固定化酶制剂的主要指标之一,单位质量细胞含量越多,相应的酶活力越高。针对吸附和包埋等方法所生产的酶制剂中载体含量比例高、单位质量酶活低、生产占用设备体积大等问题,絮凝法固定制备的酶制剂能有效地解决该类问题[2-7]。同时,天然存在的絮凝剂——壳聚糖,作为一种碱性阳离子絮凝剂,无毒、无味、无污染,其亲水性和生物相容性好,操作条件温和,化学性质稳定,具有能与细胞表面基团相作用的功能团,是絮凝和回收蛋白质的理想絮凝剂[8],而具有双功能基团的交联剂——戊二醛利用其羰基能同时与壳聚糖和酶分子上的氨基发生亲核加成反应生成Schiff碱,将物理吸附和化学交联相结合,形成壳聚糖、酶分子和戊二醛分子间的多重交联网络,不但使酶分子有效固定在载体上,而且使酶制剂的稳定性和耐压强度大大提高[9-10]。
目前国内市场所使用的固定化GIase制剂被诺维信公司垄断,在本实验室前期工作中,一种来源于嗜热菌Thermobifida fusca GIase的基因xylA在E. coli中被成功克隆表达,并对纯化酶进行了酶学性质分析,以葡萄糖为底物该酶的米氏常数(Km)和催化常数(Kcat)值分别为190mmol/L和28s-1,70℃条件下的半衰期为15h,高的催化活力和良好的热稳定性使该酶成为改进葡萄糖异构化食品工业过程中具有巨大潜力的选择。本实验拟采用壳聚糖絮凝加戊二醛交联的固定办法,对产Thermobifida fusca GIase的重组大肠杆菌细胞进行固定化过程研究,以期获得一种生产性能好、酶活回收率高、经济成本低的固定化酶制剂的方法,为实现我国固定化GIase制剂高效、低耗的工业化生产,提供一定的参考。
1 材料与方法
1.1 材料与试剂
菌株xylA/pT7-7/BL21(DE3)由本实验室保存和提供;高密度发酵液为本实验室发酵提供(光密度OD600nm≈140,菌体干质量为80~90g/L,pH7.2)。
壳聚糖(脱乙酰度≥98.0%)、硅藻土(食品级,60目)、25%戊二醛、冰醋酸、K2HPO4·3H2O、KH2PO4、活性炭、二氧化硅 国药集团化学试剂有限公司;所有试剂均为化学纯或分析纯。
1.2 仪器与设备
721型分光光度计 上海元析仪器有限公司;Hitachi himac CFl6RX高速离心机 日立工机株式会社;PHS-3C精密pH计 上海嘉鹏科技有限公司;JB90-D型强力电动搅拌机 上海隆拓仪器设备有限公司;120轴式挤压机 山东章丘市华祥机械厂。
1.3 壳聚糖絮凝
取250mL发酵液,添加硫酸镁至Mg2+终浓度为5mmol/L,经60℃热处理30min后冷却至25℃,在磁力搅拌器上,以800r/min转速搅拌,同时把100mL用醋酸溶解的壳聚糖溶液缓慢流加到发酵液中,室温条件下静置10min待絮凝颗粒下沉。絮凝效果以酶活回收率来评定,依照1.6.1节中发酵液酶活力的测定方法测定酶活力,酶活回收率按式(1)计算。

1.3.1 pH值对絮凝效果的影响
调节壳聚糖中醋酸的含量,使其与发酵液按比例混合后溶液的最终pH值分别为4.5、5.0、5.5、6.0、6.5。同时设定其他条件为壳聚糖终质量分数0.2‰、温度30℃。
1.3.2 壳聚糖质量分数对絮凝效果的影响
调节壳聚糖质量分数与发酵液混合,使得混合后溶液中的壳聚糖的最终质量分数为0.01‰、0.05‰、0.10‰、0.15‰、0.20‰、0.25‰、0.30‰。同时设定其他条件为pH5.5、温度30℃。
1.4 戊二醛交联
弃去絮凝后的上清液,取絮凝物加入100mL一定浓度和pH值的戊二醛溶液,在一定温度条件下,低速搅拌一定时间,经布氏漏斗过滤后,用去离子水浸泡清洗过滤交联产物2次,把滤饼用挤压机挤压成直径1mm的颗粒,在35℃的烘箱中鼓风烘至质量恒定,得到交联样品;如果絮凝物未经戊二醛交联,直接过滤挤压成颗粒后干燥,则为未交联样品。依照1.6.1节中固定化细胞酶制剂活力的测定方法测定等质量交联样品和未交联样品的酶活力,然后测定交联样品在75℃处理1h之前和之后的酶活。交联效果参照交联后酶活保留率和热处理后酶活保留率来确定,分别按式(2)、(3)计算。

1.4.1 戊二醛体积分数对交联效果的影响
调节戊二醛溶液的体积分数与絮凝物混合,使得混合后溶液中戊二醛的终体积分数为0.1%、0.25%、0.5%、1.0%、1.5%、2.0%、2.5%。同时设定交联温度25℃、时间3h、pH7.0,搅拌速率100r/min进行交联。
1.4.2 交联pH值对交联效果的影响
用50mmol/L的磷酸盐缓冲液调节戊二醛溶液的pH值与絮凝物混合,使得混合后溶液中的pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。同时设定交联温度25℃、时间3h、戊二醛体积分数0.25%、搅拌速率100r/min进行交联。
1.5 硅藻土改性
在絮凝前添加一定量的硅藻土到发酵液中后,按1.3节壳聚糖絮凝效果操作方法继续操作。考察壳聚糖溶液中硅藻土不同添加量0.2、0.4、0.6、0.8、1.0g/100mL对固定化细胞的耐压强度和传质性能的影响。
1.6 固定化细胞特性
1.6.1 酶活力测定
酶活力(U)单位定义为:在标准反应体系中,每分钟产生lμmol果糖所需的酶量,定义为1个酶活力单位。
发酵液酶活力的测定:异构化葡萄糖反应体系反应总体积2mL,体系中葡萄糖、MgSO4和磷酸盐缓冲液(pH7.5)的浓度分别为300、5、100mmol/L,发酵液添加量为0.2mL,反应在静置状态下、70℃水浴中进行10min,然后在100℃水浴10min中止反应,12000r/min离心5min后,取上清液适当稀释后用高效液相色谱(HPLC)测定果糖含量,确定反应体系的总活力,发酵液的酶活力按式(4)计算。

固定化细胞酶制剂活力的测定:固定化细胞异构化葡萄糖反应体系总体积100mL,体系中葡萄糖、MgSO4和磷酸盐缓冲液(pH7.5)的浓度分别为600、5、100mmol/L,固体酶制剂添加2.5g,固体酶制剂先在磷酸盐缓冲液(pH7.5)浸泡1h,各成分混合前分别在70℃预热,反应在70℃、150r/min水浴摇床中进行15min,12000r/min离心5min后,取上清液适当稀释后用HPLC测定果糖含量,确定反应体系的总酶活力,固定化细胞酶制剂酶活力按式(5)计算。
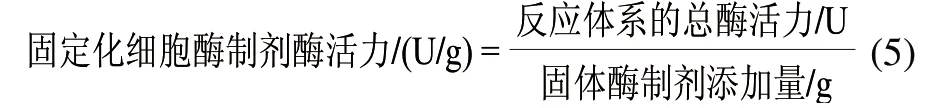
1.6.2 糖含量测定
样品稀释一定倍数后用0.45μm微孔滤膜过滤后用HPLC法测定葡萄糖和果糖含量[11]。色谱条件为:Agilent1200 HPLC色谱仪;色谱柱:Aminex HPX-87H ion exclusion cloumn(7.8mm×300mm);流动相:0.5mmol/L H2SO4溶液;流速:1mL/min;Waters2410示差折光检测器;柱温:50℃;池温(检测器) 30℃;进样量:10μL。实验设置3个重复。
1.6.3 动力学参数测定
配制不同浓度(20~800mmol/L)的葡萄糖溶液,分别取lg固定化酶和1mL游离酶液,在70℃和pH7.5条件下反应10min后迅速置于沸水浴中终止反应,测定反应产物的吸光度。根据标准曲线查得生成产物的浓度,求出酶反应初速率。以反应速率和底物浓度的双倒数作图,求得米氏常数Km及最大反应速率Vmax。直线回归采用Kaleida Graph软件分析[12]。实验设置3个重复。
1.6.4 耐压强度测定
参照国家标准GB/T 23533—2009《固定化葡萄糖异构酶制剂》,固定化酶用60℃蒸馏水浸没,然后缓慢搅动20h,再把样品放在20N/cm2的压强条件下挤压3min,释放压力后样品不成浆(或极少量成浆)仍硬,为合格。反之,为不合格。
1.6.5 操作稳定性测定
参照国家标准GB/T 23533—2009附录A,在工作温度(55~60℃)条件下恒速流加40%的葡萄糖底物溶液到反应柱中进行异构转化反应,使初始产物中葡萄糖的转化率在45%左右,间隔一定时间取样测定产物中的葡萄糖的转化率,计算残留酶活力,确定操作稳定性。
2 结果与分析
2.1 壳聚糖对产酶细胞的絮凝
壳聚糖对产酶细胞的絮凝效果由絮凝后溶液中的蛋白残留量决定,实际考察絮凝前后溶液中的酶活力以确定絮凝效果。絮凝效果与絮凝时的温度、水流的紊动程度、壳聚糖的质量分数、絮凝pH值等因素相关。通常温度越高,发酵液黏度越小,分子布朗运动越快,絮凝团越易形成,但过高的温度又会破坏絮凝团形成[13],本实验选择30℃进行操作。絮凝效果还与水流紊乱程度相关,在搅拌条件下,单位体积水体中颗粒碰撞的总次数会随水流紊乱程度的增加而增大,絮凝团直径会随水流紊乱程度的增加而减小[14],由于搅拌的方式和设备形状的不同,搅拌速率和方法应根据实际情况而定,本实验使用叶轮式电动搅拌机,以产生的絮凝团直径小于1mm为标准确定搅拌速率,以利于后续过程中戊二醛能对絮凝团进行均匀交联。确定以上条件后,对絮凝pH值和壳聚糖质量分数进行进一步考察。
2.1.1 pH值对絮凝效果的影响
电荷吸附作用是壳聚糖絮凝蛋白质的主要原因之一,在碱性和中性环境条件下,壳聚糖不被质子化,不能中和带负电的蛋白质,无法絮凝菌体细胞,所以要在酸性条件下溶解壳聚糖,但如果溶液pH值过低则会导致目的蛋白失活,因此设定pH值考察范围为4.5~6.5。由图1可知,絮凝效果(酶活回收率)在pH5.0~5.5时最高,达到98%,考虑到低pH值对酶活力的影响,选取最适絮凝pH值为5.5。
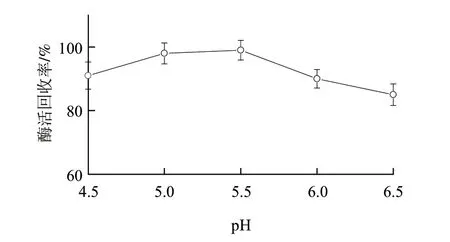
图 1 pH值对絮凝效果的影响Fig.1 Effect of pH on flocculation
2.1.2 壳聚糖质量分数对絮凝效果的影响
分子间的吸附是壳聚糖絮凝蛋白质的另一主要原因,过低的壳聚糖质量分数难以吸附足够的蛋白质,使吸附不充分,反之,当壳聚糖投加过量时,则蛋白质相对较少,壳聚糖聚合物伸展部分发生自身黏连,产生了包裹作用,吸附作用发挥不良。考虑到高密度发酵液菌体蛋白含量很高,故设定壳聚糖溶液终质量分数考察范围在0.01‰~0.3‰。由图2可知,酶活回收率在壳聚糖溶液终质量分数0.1‰~0.2‰时最高,考虑到生产成本和单位质量的酶活力,选取壳聚糖溶液终质量分数为0.1‰。
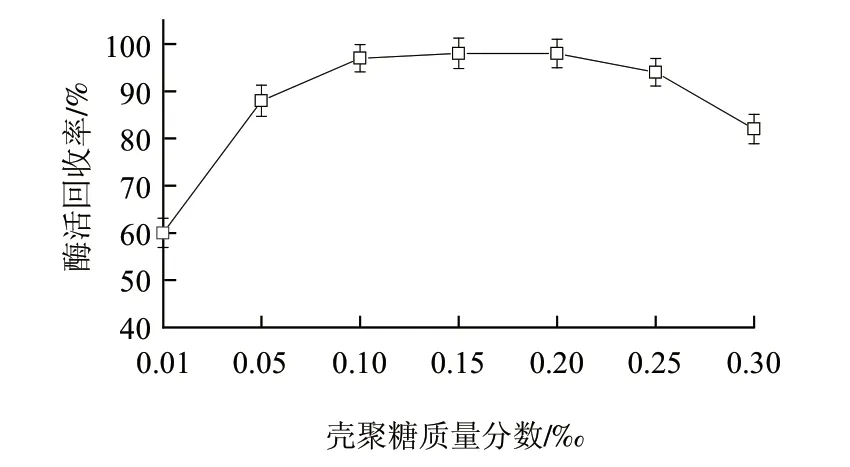
图 2 壳聚糖质量分数对絮凝效果的影响Fig.2 Effect of chitosan concentration on flocculation
2.2 戊二醛对絮凝物的交联
固定化酶制剂的生产性能由单位质量的酶活力和热稳定性共同决定,因此同时考察交联后固定化酶的活力和热稳定性以确定交联效果。交联效果与交联剂的体积分数、pH值、时间和温度等因素相关。
交联反应是吸热反应,交联反应速率在一定温度范围内会随温度上升而增大,但过于剧烈的交联反应一方面会降低酶活,另一方面会导致絮凝团内外交联程度不均匀,所以选择在室温或更低温度条件下交联3h。在此基础上,对戊二醛体积分数和交联pH值进行进一步考察。
2.2.1 戊二醛体积分数对交联效果的影响
戊二醛是一种交联剂,有2个醛基,可与蛋白质或壳聚糖的游离氨基发生Schiff碱反应生成亚胺键,使酶和壳聚糖交联,从而增加凝胶机械强度和酶的稳定性。戊二醛的体积分数对固定化效果影响较大,交联剂体积分数过低时,酶分子不能被有效固定,酶稳定性较低;当戊二醛体积分数过高时,交联反应会深入到酶分子内部,特别当活性位点氨基酸受到交联时,酶的催化活性将会受到影响[15]。将250mL发酵液得到的絮凝物用250mL的戊二醛溶液进行交联,设定戊二醛终体积分数的考察范围为0%~2.5%。由图3可知,随着戊二醛体积分数的增加,交联样品的活力迅速下降,而交联样品的热稳定性仅小幅增加,当戊二醛体积分数低于0.25%时,相对于未交联的样品(对照样品酶活力为100%),交联样品的酶活保留率在80%以上,综合考虑,选择0.25%为戊二醛最适交联体积分数。
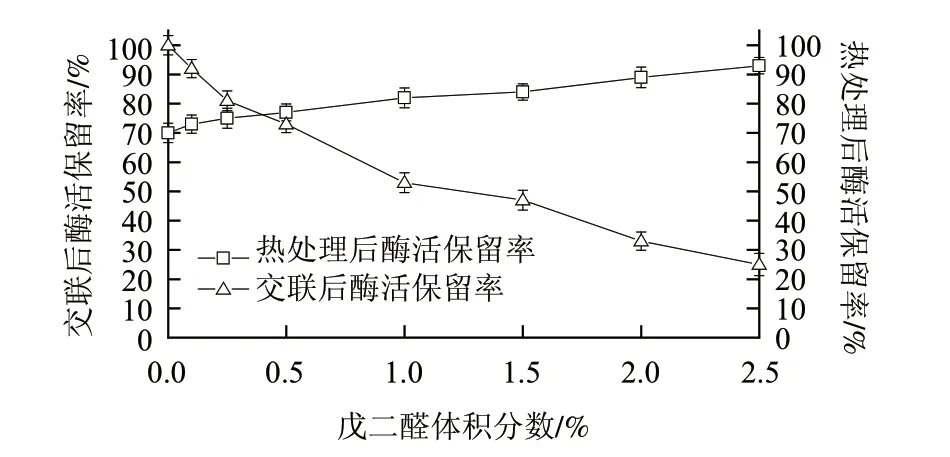
图 3 戊二醛体积分数对固定化效果的影响Fig.3 Effect of glutaraldehyde concentration on immobilization
2.2.2 交联pH值对交联效果的影响
当戊二醛与酶分子形成共价键时,特定pH值条件下酶分子的状态就会被不可逆地固定,所以通常应在酶的最适pH值条件下固定酶分子,本研究中GIase的最适pH值为10,在pH10条件下,壳聚糖分子难以溶解,亚胺键难以形成,导致其与戊二醛的交联程度低。因此实验设定交联时pH值的考察范围为5.5~9.0。由图4可知,在不同pH值条件下交联制备的固定化酶,其交联后的酶活保留率在pH8.0时最高,而75℃热处理1h后的酶活保留率在pH6.5~8.5范围内差别很小,但考虑到酸性条件下戊二醛与壳聚糖的交联程度更高,会使固定化酶的耐压强度更高,因此选取pH6.5为最适交联pH值。
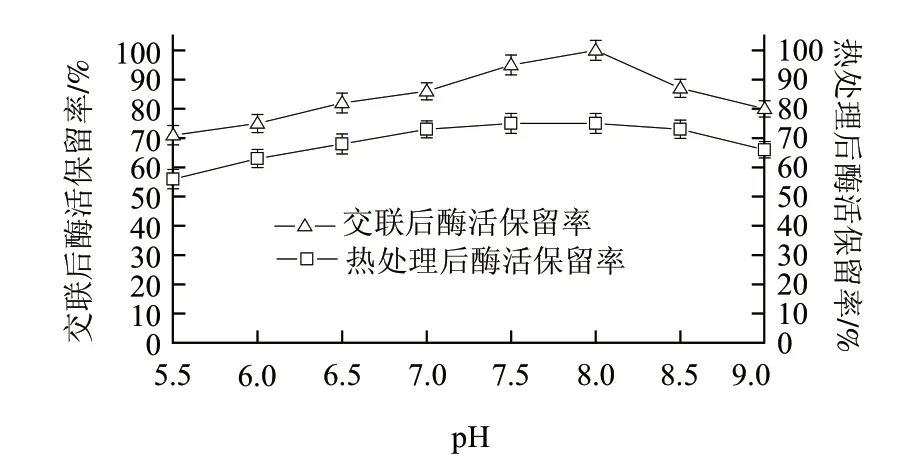
图 4 pH值对固定化效果的影响Fig.4 Effect of pH on immobilization
2.3 硅藻土改性研究
工业生产要求固定化酶制剂颗粒既要有较高的耐压强度,又要有较好的空隙以利于底物和产物进出,仅通过壳聚糖絮凝和戊二醛交联所制备的固定化GIase制剂颗粒干燥后质地十分致密,传质性能差,不利于异构反应进行。硅藻土粉末不仅具有吸附和抗溶胀效果,还有塑形、助滤和改善固定化颗粒传质特性的作用,并且价格相对二氧化硅、活性炭等较低,经综合考虑确定硅藻土作为添加物对固定化颗粒进行改性。考察发酵液中硅藻土不同添加量0%~1.0%(不添加硅藻土为对照组)对固定化细胞的耐压强度和传质性能影响。由表1可知,在硅藻土添加量为0.4%~0.6%时,固定化GIase制剂颗粒的耐压强度既能满足国家标准GB/T 23533—2009)要求又有较好的传质性,表现为等量产酶细胞制备的酶制剂的相对活力较高。综合考虑固定化GIase制剂颗粒单位质量的酶活力、耐压强度和传质性能等因素,选取硅藻土添加量为0.6%。

表 1 硅藻土添加量对固定化产物的耐压强度和传质性能影响Table 1 Effect of diatomite addition on pressure strength and mass transfer performance of immobilized products
2.4 固定化酶的性质
2.4.1 最适pH值
壳聚糖为阳离子絮凝剂,会在其表面结合大量OH-,形成弱碱性的微环境,造成H+和OH-在载体表面和溶液中的分配不同,使酶促反应的最适pH值向酸性方向偏移[16],由图5可知,固定化酶的最适pH值相对游离酶由pH10降低至pH9,最适pH值的降低可减少异构反应过程中副产物和色素的形成[17],符合生产需要。同时,固定化酶在pH5~11的较宽范围内相对酶活力较高,在pH7.5时为其最高酶活力的90%左右,为减少异构反应过程中副产物和色素的产量,所以仍然选择在pH7.5条件下进行葡萄糖异构反应。
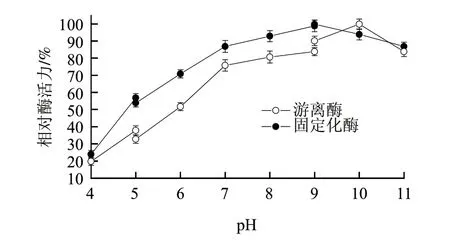
图 5 固定化酶和游离酶的最适pH值Fig.5 Optimal pH of immobilized enzyme and free enzyme
2.4.2 最适温度
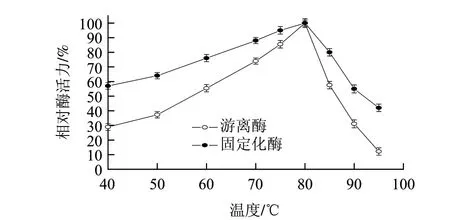
图 6 固定化酶和游离酶的最适温度Fig.6 Optimal temperature of immobilized enzyme and free enzyme
固定化后,GIase分子表面氨基通过戊二醛的醛基与自身或与壳聚糖分子表面氨基形成网络结构,其分子结构刚性增强,抗热变性作用能力增加[18]。由图6可知,固定化酶和游离酶的最适反应温度均为80℃,与游离酶相比,固定化酶在40~95℃范围内的相对酶活力较高,在60℃时仍保留最大酶活力的75%。由于高温条件下酮糖会发生分解并加快美拉德反应,并且固定化酶失活加快[17],所以仍然选择在55~60℃条件下进行葡萄糖异构反应。
2.4.3 动力学参数
以20~800mmol/L葡萄糖为底物,分别测定颗粒状固定化酶与游离酶的酶活力,用Lineweaver-Burk双倒数作图法求得Km。固定化酶和游离酶的表观Km分别为230、190mmol/L。与游离酶相比,固定化酶的表观米氏常数Km增大,这与Demirel[19]报道的包埋键合所构建的固定化GIase相对游离态GIase的Km值的变化相反,他们认为底物和载体间的静电引力造成Km值减小。这其中的可能原因一方面是交联反应对酶分子构象的影响,另一方面也可能是固定化颗粒的空间阻碍和扩散限制的影响。
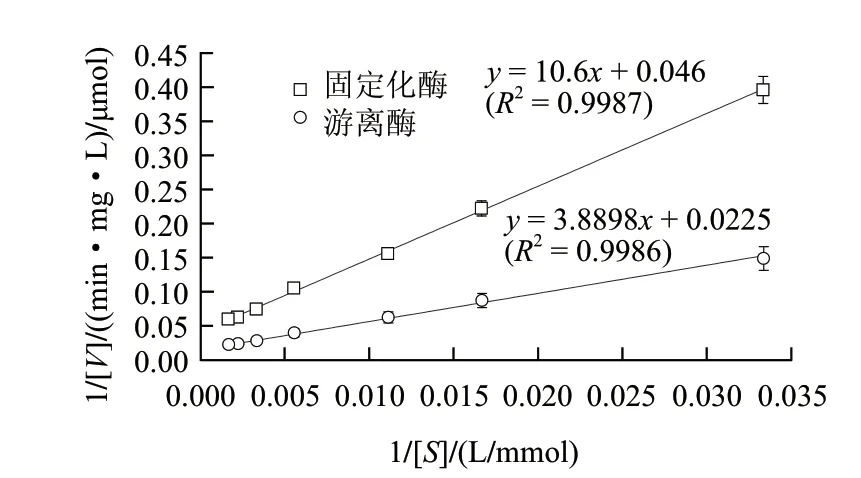
图 7 固定化酶与游离酶的Lineweaver-Burk曲线Fig.7 Double reciprocal plots for reaction curve of immobilized GIase and free GIase
2.4.4 操作稳定性结果
在60℃条件下恒速流加45%的葡萄糖底物溶液到反应柱中进行异构转化反应,确定操作稳定性。由图8可知,固定化酶初始酶活力为356U/g。连续操作30d,残留酶活力大于70%。参照酶失活一级动力学方程[20]:[E]=[E0]exp(kdt),t1/2=ln2/kd。
式中:t1/2为半衰期/d;kd为衰减常数;t为反应时间/d;[E0]为初始酶活力/U;[E]为中间过程酶活力/U。
对图中的数据进行线性拟合得到固定化酶的失活方程为ln([E]/[E0])=-0.0112t,则kd=0.01129、t1/2=ln2/kd=61d,即半衰期为61d,能满足工业生产要求。
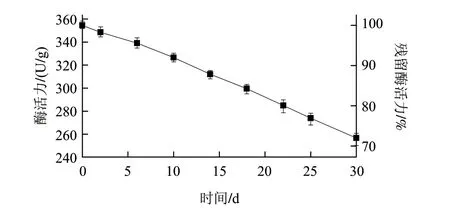
图 8 固定化酶制剂的操作稳定性Fig.8 Operation stability of immobilized enzyme preparation
3 结 论
本研究确定了最佳壳聚糖絮凝条件、最佳戊二醛交联条件和最佳的添加物种类和比例及固定化操作方法。所制得的固定化GIase与游离的GIase相比最适温度不变、最适pH值降低;其单位质量的活力远优于基于凝胶包埋和离子吸附等方法制备的固定化GIase制剂[21-28]。
[1] BHOSALE S H, RAO M B, DESHPANDE V V. Molecular and industrial aspects of glucose isomerase[J]. Microbiol Rev, 1996, 60(2): 280-300.
[2] KOVALENKO G A, PERMINOVA L V, TERENT’EVA T G, et al. Glucose isomerase activity in suspension of Arthrobacter nicotianae cells and adsorption immobilization of the microorganisms on inorganic carriers[J]. Prikl Biokhim Mikrobiol, 2008, 44(2): 193-201.
[3] PAWAR H S, DESHMUKH D R. Immobilization of D-xylose (D-glucose) isomerase from a Chainia species[J]. Prep Biochem, 1994, 24(2): 143-150.
[4] SCHAFHAUSER D Y, STOREY K B. Immobilization of glucose isomerase onto granular chicken bone[J]. Appl Biochem Biotechnol, 1992, 32: 79-87.
[5] SUEKANE M. Immobilization of glucose isomerase[J]. Z Allg Mikrobiol, 1982, 22(8): 565-576.
[6] CHEN W P, ANDERSON A W. Purification, immobilization, and some properties of glucose isomerase from Streptomyces flavogriseus[J]. Appl Environ Microbiol, 1979, 38(6): 1111-1119.
[7] KUMAKURA M, YOSHIDA M, KAETSU I. Immobilization of glucose isomerase-containing streptomyces phaeochromogenes cells in fine-particle form[J]. Appl Environ Microbiol, 1979, 37(2): 310-315.
[8] KRAJEWSKA B. Application of chitin- and chitosan-based materials for enzyme immobilizations: a review[J]. Enzyme and Microbial Technology, 2004, 35(2/3): 126-139.
[9] STANLEY W. Immobilization of glucose isomerase on chitin with glutaraldehyde and by simple adsorption[J]. Biotechnology and Bioengineering, 1976, 18(3): 439-443.
[10] AMOTZ S. Immobilization of glucose isomerase: US, 4208482A[P]. 1976-04-23.
[11] DISCHE Z, BORENFREUN E. A new spectrophotometric method for the detection and determination of keto sugars and trioses[J]. The Journal of Biological chemistry, 1951, 192(2): 583.
[12] NINI L. Lipase-catalysed hydrolysis of short-chain substrates in solution and in emulsion: a kinetic study[J]. Biochim Biophys Acta, 2001, 1534(1): 34-44.
[13] 程丽, 梁金钟. 絮凝法预处理大豆蛋白活性肽发酵液的研究[J]. 大豆通报, 2004, 31(2): 17-19.
[14] 花蓉蓉, 周恭明, 曹大伟. 壳聚糖的絮凝性能研究进展[J]. 化工进展, 2008, 27(3): 335-339.
[15] MIGNEAULT I. Glutaraldehyde: behavior in aqueous solution, reaction with proteins, and application to enzyme crosslinking[J]. Biotechniques, 2004, 37(5): 790-806.
[16] 李志国. 固定化脂肪酶的动力学研究[J]. 华东理工大学学报: 自然科学版, 2004, 30(1): 107-110.
[17] CHOU C, LADISCH M, TSAO G. Studies on glucose isomerase from a Streptomyces species[J]. Appl Environ Microbiol, 1976, 32(4): 489-493.
[18] 纵伟, 刘艳芳, 赵光远. 磁性壳聚糖微球固定化脂肪酶的研究[J]. 食品与机械, 2008, 22(1): 13-15.
[19] DEMIREL G. Semi-interpenetrating polymer networks (IPNs) for entrapment of glucose isomerase[J]. Reactive and Functional Polymers, 2006. 66(4): 389-394.
[20] 罗贵民, 曹淑桂, 张今. 酶工程[M]. 北京: 化学工业出版社, 2001: 101-105.
[21] 安志法, 翟丽莉. 固定化葡萄糖异构酶的研究[J]. 河南科学, 1986, 18(1): 32-34.
[22] 刘建忠, 陈石明. 大孔树脂固定化葡萄糖异构酶及其动力学研究[J]. 中山大学学报: 自然科学版, 1997, 36(5): 119-122.
[23] 葛玉斌, 沈家骢. 葡萄糖异构酶的固定化及其性质研究[J]. 高等学校化学学报, 1996, 25(3): 24-25.
[24] 辛嘉英, 黄友梅, 刘文圣. 葡萄糖异构酶的固定化及其稳定性的研究[J]. 甘肃科学学报, 1994, 6(2): 23-25.
[25] 袁建国. 固定化葡萄糖异构酶及其生产果葡糖浆的研究[C]//全国玉米深加工交流展示会论文集. 北京: 中国科学技术协会学会工作部, 1988: 388-397.
[26] 杨惠英, 黄亚冰. 短乳杆菌葡萄糖异构酶固定化的研究[J]. 工业微生物, 1998, 28(2): 15-19.
[27] 李振华, 唐晓松. 明胶: 戊二醛固定化双酶体系的研究[J]. 四川大学学报: 自然科学版, 1990(1): 21-23
[28] 贺家明. 嗜热链霉菌变株M1033-9葡萄糖异构酶的研究.Ⅰ. 酶的性能与工业应用[J]. 微生物学报, 1993(3): 187-191.
