木糖异构酶序列结构特点、耐热机理及分子改造研究进展
2011-02-09许伟严明欧阳平凯
许伟,严明,欧阳平凯
1 盐城工学院 化学与生物工程学院,盐城 224051
2 南京工业大学 生物与制药工程学院,南京 210009
木糖异构酶 (Xylose isomerase,Ⅺ) (EC 5.3.1.5)可以催化五碳糖D-木糖转化为D-木酮糖,在微生物体内的糖代谢过程中起着重要的作用;在体外亦能催化D-葡萄糖到D-果糖的异构化反应,所以又称为葡萄糖异构酶 (图 1)。木糖异构酶具有极其重要的工业应用价值,和蛋白酶、淀粉酶等并称为重要的工业用酶[1],引起研究人员的关注并对其开展了较为广泛的研究。在基础研究方面,发现该酶的结构非常稳定,是研究蛋白质结构与功能关系优良模型之一[2]。近年来,随着发展低碳经济的迫切需要,可再生资源利用研究方兴未艾,其中,利用木糖异构酶构建发酵半纤维素水解产物木糖生产乙醇的重组菌成为研究热点[3-4]。研究发现来自嗜热细菌及真菌的木糖异构酶能够在酿酒酵母中表达出活性,参与了酿酒酵母木糖代谢途径的构建[5-7]。因此,深入了解木糖异构酶独特的结构机理并通过酶分子改造提高其活性,对构建新型高效利用木糖的重组酿酒酵母具有重要的理论及应用意义[8-9]。
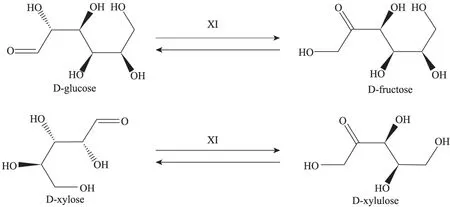
图1 木糖异构酶催化的反应Fig. 1 Reactions catalyzed by xylose isomerase.
1 木糖异构酶的酶学性质及序列和结构特点
1.1 木糖异构酶的酶学性质
1957年,美国研究人员先后在嗜水假单胞杆菌、短乳杆菌、戊糖乳酸菌中发现木糖异构酶,从此拉开了木糖异构酶研究的序幕。迄今为止,已经在细菌、真菌和放线菌等多种微生物中以及植物中鉴定出木糖异构酶[10-12]。
不同来源的木糖异构酶最适反应温度一般为60 ℃~90 ℃。这取决于缓冲液、底物浓度、激活剂、稳定剂及反应时间等多种因素。其中乳酸杆菌和埃希杆菌木糖异构酶的热稳定性较差。链霉菌、枯草芽胞杆菌以及某些嗜热菌中的木糖异构酶在高温下相当稳定。
木糖异构酶的最适pH偏碱性,通常在7.0~9.0之间。在偏酸性的条件下,大多数种属的木糖异构酶活性较低。表1中列出了文献报道的一些重要木糖异构酶的基本性质。木糖异构酶的活力及稳定性跟二价金属离子有着非常密切的关系。二价阳离子Mg2+、Co2+及 Mn2+可以稳定和激活木糖异构酶的活性[13];而Ag+、Hg2+、Cu2+、Zn2+、Ni2+和Ca2+等离子通常抑制其催化活性。金属离子还影响木糖异构酶对不同底物的活性,如凝结芽胞杆菌木糖异构酶和 Mn2+结合时对木糖的活性最高,和Co2+结合时对葡萄糖的活性最高。不同来源的木糖异构酶可能需要不同的金属离子使其保持较高的活性,如Mg2+对7号链霉菌M1033所产木糖异构酶的激活作用最大。
木糖异构酶以D-木糖作为天然最适底物,其对D-葡萄糖的Km值通常是D-木糖Km的几十倍甚至上百倍。木糖异构酶除催化D-葡萄糖和D-木糖的异构化反应外,据文献报道其还能以D-核糖、L-阿拉伯糖、L-鼠李糖、D-阿洛糖等单糖以及葡萄糖的C3、C5、C6的修饰衍生物为催化底物[24]。表2中列出了几种重要的木糖异构酶的反应动力学常数。
1.2 木糖异构酶的序列及结构特点
1.2.1 木糖异构酶的序列特点
迄今为止,Swiss-Prot/TrEMBL数据库中已经公布了来源于近百种微生物木糖异构酶的氨基酸序列[29-30]。其中大多数来自于细菌,少部分来自于真菌。
根据氨基酸序列同源性,Ⅺ可分为两大类[31],Class Ⅰ (约390个残基) 主要来自于链霉菌属 Streptomyces sp.、密苏里游动放线菌A. missouriensis、小瓶菌属Ampullariella sp.、节杆菌属 Arthrobacter sp.和栖热菌属 Thermus sp.等菌种,一般序列同源性超过 50%。Class Ⅱ (约 440残基) 主要来自大肠杆菌Escherichia coli、枯草芽胞杆菌Bacillus subtilis 和栖热袍菌属Thermotoga sp.。与 Class Ⅰ相比,它们在 N-末端明显延长了约 50个氨基酸残基。PROSITE 数据库中[32]也根据Ⅺ序列的保守性给出了2个信号模式:[LI]-E-P-K-P-x (2)-P (PS00172) 其中Glu (E) 残基稳定辅因子,而Lys (K)残基参与催化过程[33];[FL]-H-D-{K}-D-[LIV]-x-[PD]-x-[GDE] (PS00173) 来自于 N-末端的保守区域,其中His残基参与催化过程[34]。
1.2.2 木糖异构酶三维结构特点
迄今为止,PDB数据库中已经公布约100个木糖异构酶的野生型或突变体的晶体结构。通过对数据的分析发现,共来自 12种微生物 (表 3)。2000年,中国科技大学朱学勇等通过X-射线衍射方法测定了7号淀粉酶链霉菌M1033菌株木糖异构酶的晶体结构[35],这是国内研究人员对木糖异构酶结构研究的重大贡献。
研究表明,木糖异构酶绝大多数是同源四聚体或二聚体,亚基间不存在二硫键。从表 3中可知,木糖异构酶 Class Ⅰ的结构报道较多,也为其分子改造奠定了坚实的基础。相对来说,Class Ⅱ的木糖异构酶研究较少。
图2中给出了两类木糖异构酶的三维结构。嗜热栖热菌木糖异构酶 (图 2A) 属于 Class Ⅰ,是同源四聚体,每个亚基由 2个结构域构成:催化结构域折叠成αβ桶;C-末端小结构域无β-片层,由环链区和螺旋组成并且与相邻亚基的催化结构域广泛接触;Class Ⅱ木糖异构酶 (图2B) 具有明显延伸的 N-末端。两类木糖异构酶折叠的核心结构是折叠成桶状的平行 β片层,其中的 β片层被位于桶外沿的 α螺旋连接。活性中心处于连接 β片层羧端与 α螺旋羧端 8段环链构成的一个漏斗状空腔的底部[42]。
1.2.3 木糖异构酶的活性中心特点
木糖异构酶的单亚基都有一个深陷的口袋状的活性中心,每个活性中心包含两个二价金属离子结合位点,以及与底物结合和催化过程相关的保守残基。通常位点Ⅰ (图3 Mn1位置) 的金属离子称为结构离子,位点Ⅱ (图3 Mn2位置) 的金属离子称为催化离子。

表3 PDB数据库中不同来源的木糖异构酶晶体结构Table 3 Xylose isomerase from different microorganisms in PDB database

图2 木糖异构酶的三维结构Fig. 2 Three-dimension structure of xylose isomerase. (A) TthXI (PDB ID:1BXB) included in Class I. (B) B. stearothermophilus XI (PDB ID:1A0D) included in Class II. The N-terminus labelled in red.
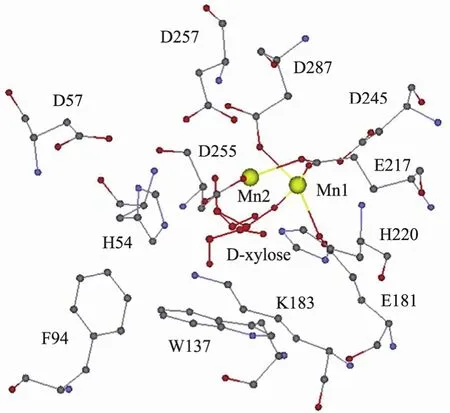
图3 S. rubiginosus木糖异构酶的活性中心Fig. 3 Active site of xylose isomerase from S. rubiginosus.
研究人员通过对 S. rubiginosus Ⅺ (PDB ID:1XIC) 进行深入研究,探讨了活性中心重要残基的功能。1XIC单亚基具有387个氨基酸残基,晶体结构活性中心给出了金属离子及D-木糖的位置 (图3)。残基H54、D57和K183主要用于底物的结合,残基E181、E217、D245和D287的羧基氧原子与结构离子Mn1形成配位键。催化离子Mn2主要与残基E217、H220、D255和D257形成配位键参与催化反应。
1.3 嗜热木糖异构酶耐热分子机理
1.3.1 嗜热木糖异构酶的残基组成
T. thermophilus Ⅺ (TthXI) 单亚基含有 387个氨基酸残基,分子量为43 907 Da,残基组成如表4所示。其中,带负电荷 (Asp和 Glu) 的氨基酸残基数目占 16.3%;带正电荷 (Arg和 Lys) 的氨基酸残基占13.0%。TthXI的Arg、Glu和Val等残基的比例高于常温菌木糖异构酶。这种在氨基酸组成上的差异可能是嗜热木糖异构酶具有高热稳定的原因之一[43]。
通过多序列比对及分析发现[2](残基标号以1BXB为例),在所有已知序列木糖异构酶中W15、D23、F25、G26、H53、D54、W136、G138、R139、E140、G141、E180、P181、K182、P183、E185、P186、N214、E216、H219、A234、D244、N246、F285和R291共25个残基是严格保守的。这些残基主要负责底物及辅因子的结合及催化。
1.3.2 嗜热木糖异构酶高热稳定性的结构基础
Chang等[23]对来自常温菌和嗜热菌的木糖异构酶的结构进行了比较和分析,发现来自 T. thermophilus和T. caldophilus木糖异构酶具有高热稳定性的主要因素为:1) 离子对和离子对网络增加;2) 亚基之间的空隙减小;3) 酰氨基的脱氨作用减少;4) Loop区的长度缩短。
作为同源四聚体,TthXI亚基的紧密包装及亚基间的相互作用对其热稳定性起着非常重要的作用[44]。作者运用结构分析软件研究发现,TthXI亚基之间存在着广泛接触,亚基之间的三种作用形式如图4所示[45]。
表5中统计了3个不同菌属木糖异构酶的亚基相互作用情况。其中TthXI、TcaXI和AmiXI分别代表来自 T. thermophilus、T. caldophilus和 A. missouriensis的木糖异构酶,AB、AC和AD分别代表不同的亚基界面。TthXI、TcaXI和AmiXI单亚基分别具有387/387/393个氨基酸残基,最适反应温度分别为85 ℃ /90 ℃ /75℃。表5中可以看出,与AmiXI相比,TthXI和TcaXI的AB和AD界面离子对数目显著升高。研究表明,与常温菌相比,TthXI亚基界面上增加了部分起到稳定长loop区域的离子对。在TthXI亚基AB界面上,Arg249和Arg252与来自另外亚基的Asp189形成离子对,Asp27与另一亚基的Arg60形成离子对。在亚基AD界面上,Arg258与来自另一亚基的Glu372和Asp375形成离子对[23]。亚基界面上的这些特殊的离子对可能对增强木糖异构酶的热稳定性非常重要。

表4 TthXI的氨基酸组成Table 4 The amino acids composition of TthXI

图4 TthXI亚基之间的三种作用模式[45]Fig. 4 Three interaction patterns among subunits of TthXI (PDB ID:1BXB)[45]. Subunit A, B, C and D are shown in red, yellow, blue and green, respectively. The interaction patterns of subunit AB, AC and AD shown in (a), (b) and (c), respectively[45].
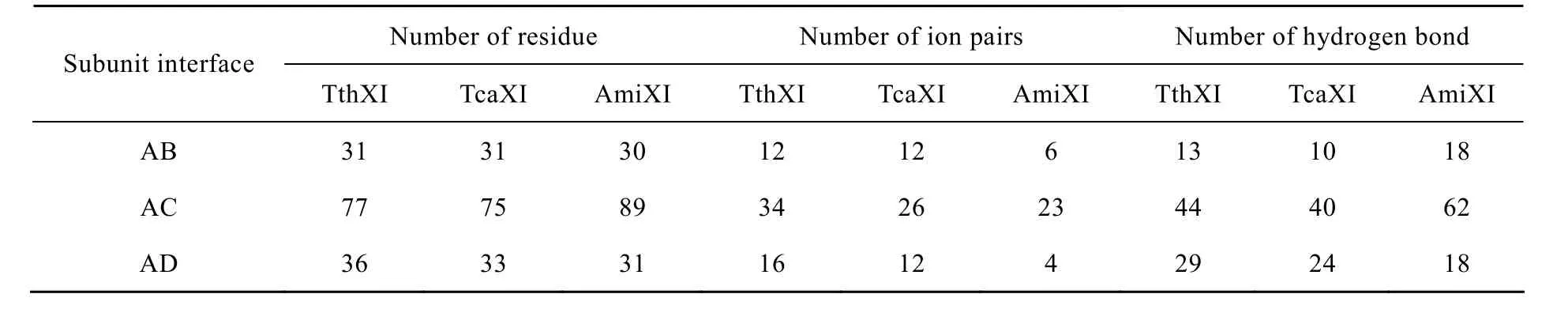
表5 木糖异构酶亚基界面分析Table 5 Analysis of subunit interfaces in xylose isomerases
2 木糖异构酶的分子改造
2.1 木糖异构酶的底物特异性改造
酶的催化作用主要是通过酶活性中心残基与底物相互作用完成。因此,酶活性中心残基对酶的底物特异性起着决定性的作用[46]。Meng等[47]对T. thermosulfurigenes木糖异构酶活性中心附近的残基W138用Phe取代,发现突变酶对葡萄糖的亲合力增加,并且催化效率比野生酶上升了 2.6倍。同时,突变酶在 85 ℃的半衰期延长了一倍。Sriprapundh等[48]对 T. neapolitana木糖异构酶进行了V185T突变,突变酶对葡萄糖的催化效率提高了3.1倍,究其原因是由于突变增加的氢键稳定了葡萄糖C6上的羟基。Santa等[49]将AmiXI活性中心靠近底物C5羟基的残基V135突变为Asn,突变酶对L-核糖的催化效率提高 3倍。分子模拟结果表明,突变酶残基N135与E181形成氢键,同时L-核糖O4与活性中心金属Ⅰ形成配位键,从而稳定了底物的构象。为改善 AmiXI对 L-阿拉伯糖的催化活性,Karimaki等[50]设计了F26W和Q256D突变,结果突变酶催化效率分别增加了2倍和3倍,分析表明前者是由于 Kcat的变化导致,而后者可能是突变导致酶活性中心静电环境发生改变。
2.2 木糖异构酶热稳定性的改造
工业上酶的催化过程通常在较高温度下进行,因为高温具有增加溶解度和反应速率以及降低溶液黏度、防止微生物污染等优点。提高酶的热稳定性也是木糖异构酶改造的热点之一。
伍传金等[51]对S. diastaticus木糖异构酶进行了K253R和N184V突变发现热稳定性都有所下降,其中K253R活性为野生酶的1.5倍,而突变酶N184V活性远低于野生酶。肖亚中等[18]对S. diastaticus木糖异构酶进行A198C突变,突变酶的最适温度提高了8 ℃。一般来说,由于Pro的转动自由度较小,Pro的吡咯烷环使得 β-转角或无规卷曲结构更加稳定,从而提高蛋白质的热稳定性。朱国萍等[52]在S. diastaticus木糖异构酶中引入了G138P突变,突变酶的热失活半衰期约是野生酶的2倍并且最适温度提高了10 ℃~12 ℃。分析表明由于突变酶引入了一个吡咯烷环,该侧链刚好充填由于G138无侧链基团而留下的空洞使蛋白质空间结构更具刚性,从而提高了热稳定性。Sriprapundh等[48]对T. thermosulfurigenes木糖异构酶的热稳定性进行了研究,分别引入A62P和Q58P/A62P突变都使得突变酶热稳定性明显下降;而引入 Q58P后突变酶热失活半衰期比野生酶增加了43%。
2.3 改善嗜热木糖异构酶低温下活性的研究
由于嗜热酶 TthXI在常温下活性较低,这严重限制了利用该酶所构建的重组酿酒酵母发酵木糖生产乙醇的能力。提高嗜热木糖异构酶在低温下的活性,已成为开发新型重组乙醇产生菌的关键技术之一。
Lonn等[25]对TthXI进行随机突变,获得突变酶E372G/V379A、E372G/F163L及E372G低温下的活性均有提高,其中低温下活力提高最多的是突变酶E372G/V379A。在60 ℃下,3个突变酶对D-木糖的Kcat比野生酶提高了 9倍,但催化效率 Kcat/Km没有上升,并且较野生酶相比三者的热稳定性都显著下降。研究人员对突变酶已经申请了专利[53],限制了对突变酶的进一步应用。郭亭等[54]利用重叠延伸法对TthXI进行P137G突变,获得了中温下活性有所提高但热稳定性显著下降的突变酶,结果表明该处的 Pro对维持其热稳定性起到重要的作用。Sriprapundh等[55]在T. neapolitana木糖异构酶V185T突变体的基础上,通过定向进化的方法获得了两种低温及低 pH 条件下活性增高的突变酶V185T/L282P和 V185T/L282P/F186S。结构分析表明,F186S突变破坏了F186、Y184、F228和F262四个残基芳香环间的相互作用,增加了结构的柔性,导致其低温下活性升高。
本文作者对木糖异构酶也进行了较深入的研究[56-58],通过对 TthXI与底物木糖的复合物在不同温度下进行纳秒级的分子动力学模拟,揭示了温度对该酶结构柔性的影响,指出高温下该酶的柔性部位主要位于亚基界面以及由残基 55~80组成的helix-loop-helix区域 (图5)。
基于嗜热木糖异构酶与其相应常温酶保守残基的差异,结合对亚基界面保守残基相互作用模拟分析,我们首次提出定点突变嗜热酶的保守残基降低亚基间相互作用,来改善TthXI低温下活性的策略。在大肠杆菌中高效表达了具有 N91D突变的 TthXI[59],并获得了 4种低温下活性明显增加的重组突变酶 D375G/V385A、D375G、K355A和V144A (图6)[60]。结果证明通过对TthXI亚基界面保守残基的定点突变,降低亚基间相互作用能有效地改善其冷适应性。该策略对其他嗜热菌中木糖异构酶的冷适应性改造具有积极的借鉴意义。

图5 高温86.85 ℃与26.85 ℃相比柔性增加的区域及重要残基在TthXI结构上的定位[56]Fig. 5 The important regions and residues with higher flexibility at 86.85 °C compared with 26.85 °C[56]. C- terminal domain shown in blue and helix-loop-helix region (residues 55−80) shown in yellow.
3 展望
综上所述,由于 TthXI在酿酒酵母中成功表达出活性,为重组酿酒酵母发酵木糖生产乙醇开辟了一条新的道路。该酶在发酵木糖生产乙醇方面的工业应用潜力及其独特的分子结构特点引起了广泛的关注。近年来,有关木糖异构酶序列及结构特点、底物特异性、热稳定性及冷适应性方面的分子改造虽然取得了一定的进展,但还存在着一些问题有待解决。如木糖异构酶的催化过程的负氢离子转移机制仍不明确;如何提高木糖异构酶对木糖的催化活性的报道还较少。本文较全面地综述了木糖异构酶结构与功能关系的研究进展,对于深入理解嗜热木糖异构酶具有高热稳定性的结构机理,并且基于以上经验进行分子改造,提高木糖异构酶的催化活性具有非常重要的意义。
REFERENCES
[1] Bhosale SH, Rao MB, Deshpande VV. Molecular and industrial aspects of glucose isomerase. Microbiol Rev, 1996, 60(2): 280−300.
[2] Zeikus JG, Vieille C, Savchenko A. Thermozymes: biotechnology and structure-function relationships. Extremophiles, 1998, 2(3): 179−183.
[3] Tanino T, Hotta A, Ito T, et al. Construction of a xylose-metabolizing yeast by genome integration of xylose isomerase gene and investigation of the effect of xylitol on fermentation. Appl Microbiol Biotechnol, 2010, 88(5): 1215−1221.
[4] Wang QY, Yang DF, Sun L, et al. Active expression of xylose isomerase from Thermobifida fusca in Saccharomyces cerevisiae and its influence on xylose metabolism. Guangxi Sci, 2009, 16(4): 446−450.王青艳, 杨登峰, 孙靓, 等. 酿酒酵母中的嗜热细菌木糖异构酶活性表达及木糖代谢研究. 广西科学, 2009, 16(4): 446−450.
[5] Almeida JR, Runquist D, Sànchez i Nogué V, et al. Stress-related challenges in pentose fermentation to ethanol by the yeast Saccharomyces cerevisiae. Biotechnol J, 2011, 6(3): 286−299.
[6] Brat D, Boles E, Wiedemann B. Functional expression of a bacterial xylose isomerase in Saccharomyces cerevisiae. Appl Environ Microbiol, 2009, 75(8): 2304−2311.
[7] Madhavan A, Tamalampudi S, Ushida K, et al. Xylose isomerase from polycentric fungus Orpinomyces: gene sequencing, cloning, and expression in Saccharomyces cerevisiae for bioconversion of xylose to ethanol. Appl Microbiol Biotechnol, 2009, 82(6): 1067−1078.
[8] Ha SJ, Galazka JM, Kim SR, et al. Engineered Saccharomyces cerevisiae capable of simultaneous cellobiose and xylose fermentation. Proc Natl Acad Sci USA, 2011, 108(2): 504−509.
[9] Fernandes S, Murray PG. Metabolic engineering for improved microbial pentose fermentation. Bioeng Bugs, 2010, 1(6): 424−428.
[10] Kristo P, Saarelainen R, Fagerström R, et al. Protein purification, and cloning and characterization of the cDNA and gene for xylose isomerase of barley. Eur J Biochem, 1996, 237(1): 240−246.
[11] Lopes MSG, Gomez JGC, Silva LF. Cloning and overexpression of the xylose isomerase gene from Burkholderia sacchari and production of polyhydroxybutyrate from xylose. Can J Microbiol, 2009, 55(8): 1012−1015.
[12] Parachin NS, Gorwa-Grauslund MF. Isolation of xylose isomerases by sequence-and function-based screening from a soil metagenome library. Biotechnol Biofuels, 2011, 4(1): 9. doi:10.1186/1754-6834-4-9.
[13] Epting KL, Vieille C, Zeikus JG, et al. Influence of divalent cations on the structural thermostability and thermal inactivation kinetics of class II xylose isomerase. FEBS J, 2005, 272(6): 1454−1464.
[14] Hess JM, Tchernajenko V, Vieille C, et al. Thermotoga neapolitana homotetrameric xylose isomerase is expressed as a catalytically active and thermostable dimer in Escherichia coli. Appl Environ Microbiol, 1998, 64(7): 2357−2360.
[15] Smith CA, Rangarajan M, Hartley BS. D-Xylose (D-glucose) isomerase from Arthrobacter strain N.R.R.L. B3728. Biochem J, 1991, 277(1): 255−261.
[16] Sanchez S, Smiley KL. Properties of D-xylose isomerase from Streptomyces albus. Appl Microbiol, 1975, 29(6): 745−750.
[17] Cha J, Batt CA. Lowering the pH optimum of D-xylose isomerase: the effect of mutations of the negatively charged residues. Mol Cells, 1998, 8(4): 374−382.
[18] Xiao YZ, Wu CJ, Long F, et al. Changing the optimum pH and temperature of glucose isomerase by means of protein engineering. Acta Biochim Biophys Sin, 1995, 27(5): 469−476.肖亚中, 伍传金, 龙凡, 等. 用蛋白质工程方法改变葡萄糖异构酶最适 pH和最适温度. 生物化学与生物物理学报, 1995, 27(5): 469−476.
[19] Suekane M, Tamura M, Tomimura C. Physico-chemical and enzymatic properties of purified glucose isomerases from Streptomyces olivochromogenes and Bacillus stearothermophilus. Agric Biol Chem, 1978, 42(5): 909−917.
[20] Chang C, Song HK, Park BC, et al. A thermostable xylose isomerase from Thermus caldophilus: biochemical characterization, crystallization and preliminary X-ray analysis. Acta Crystallogr Sect D, 1999, 55(Pt 1): 294−296.
[21] van Tillbeurgh H, Jenkins J, Chiadmi M, et al. Protein engineering of xylose (glucose) isomerase from Actinoplanes missouriensis 3. Changing metal specificity and the pH profile by site-directed mutagenesis. Biochemistry, 1992, 31(24): 5467−5471.
[22] Zhou SN, Huang L, Lu YJ, et al. Characteristics of xylose isomerization catalyzed by thermostable xylose isomerase from B. stearothermophilus. Microbiol China, 1998, 25(5): 271−274.周世宁, 黄蕾, 陆勇军, 等. 嗜热脂肪芽孢杆菌耐热木糖异构酶的特性. 微生物学通报, 1998, 25(5): 271−274.
[23] Chang C, Park BC, Lee DS, et al. Crystal structures of thermostable xylose isomerases from Thermus caldophilus and Thermus thermophilus: possible structural determinants of thermostability. J Mol Biol, 1999, 288(4): 623−634.
[24] Zhu GP, Cheng Y, Gong CH, et al. Progress in biological engineering of D-glucose isomerase. Prog Biochem Biophys, 2000, 27(2): 127−131.朱国萍, 程阳, 宫春红, 等. 葡萄糖异构酶的生物工程研究进展. 生物化学与生物物理进展, 2000, 27(2): 127−131.
[25] Lönn A, Gárdonyi M, van Zyl W, et al. Cold adaptation of xylose isomerase from Thermus thermophilus through random PCR mutagenesis. Gene cloning and protein characterization. Eur J Biochem, 2002, 269(1): 157−163.
[26] Jenkins, J, Janin J, Rey F, et al. Protein engineering of xylose (glucose) isomerase from Actinoplanes missouriensis. 1. Crystallography and site-directed mutagenesis of metal binding sites. Biochemistry, 1992, 31(24): 5449−5458.
[27] Rangarajan M, Hartley BS. Mechanism of D-fructose isomerization by Arthrobacter D-xylose isomerase. Biochem J, 1992, 283(1): 223−233.
[28] Lehmacher A, Bisswanger H. Comparative kinetics of D-xylose and D-glucose isomerase activities of the D-xylose isomerase from Thermus aquaticus HB8. Biol Chem Hoppe Seyler, 1990, 371(6): 527−536.
[29] Boeckmann B, Bairoch A, Apweiler R, et al. The Swiss-Prot protein knowledgebase and its supplement TrEMBL in 2003. Nucleic Acids Res, 2003, 31(1): 365−370.
[30] The UniProt Consortium. The universal protein resource (UniProt). Nucleic Acids Res, 2007, 35: D193−D197.
[31] Park KH, Robyt JF, Choi YD. Enzymes for Carbohydrate Engineering. Amsterdam: Elsevier, 1996.
[32] Hulo N, Bairoch A, Bulliard V, et al. The PROSITE database. Nucleic Acids Res, 2006, 34(S1): D227−D230.
[33] Henrick K, Collyer CA, Blow DM. Structures of D-xylose isomerase from Arthrobacter strain B3728 containing the inhibitors xylitol and D-sorbitol at 2.5 Å and 2.3 Å resolution, respectively. J Mol Biol, 1989, 208(1): 129−157.
[34] Vangrysperre W, Ampe C, Kersters-Hilderson H, et al. Single active-site histidine in D-xylose isomerase from Streptomyces violaceoruber. Identification by chemical derivatization and peptide mapping. Biochem J, 1989, 263(1): 195−199.
[35] Zhu X, Teng M, Niu L,et al. Structure of xylose isomerase from Streptomyces diastaticus no. 7 strain M1033 at 1.85 Å resolution. Acta Crystallogr Sect D, 2000, 56(Pt 2): 129−136.
[36] Whitlow M, Howard AJ, Finzel BC, et al. A metal-mediated hydride shift mechanism for xylose isomerase based on the 1.6 Å Streptomyces rubiginosus structures with xylitol and D-xylose. Proteins, 1991, 9(3): 153−173.
[37] Dauter Z, Dauter M, Hemker J, et al. Crystallisation and preliminary analysis of glucose isomerase from Streptomyces albus. FEBS Lett, 1989, 247(1): 1−8.
[38] Rasmussen H, la Cour T, Nyborg J, et al.Structure determination of glucose isomerase from Streptomyces murinus at 2.6 Å resolution. Acta Crystallogr Sect D, 1994, 50(Pt 2): 124−131.
[39] Lavie A, Allen KN, Petsko GA, et al. X-ray crystallographic structures of D-xylose isomerasesubstrate complexes position the substrate and provide evidence for metal movement during catalysis. Biochemistry, 1994, 33(18): 5469−5480.
[40] Lloyd LF, Gallay OS, Akins J, et al. Crystallization and preliminary X-ray diffraction studies of xylose isomerase from Thermoanaerbacterium thermosulfurigenes strain 4B. J Mol Biol, 1994, 240(5): 504−506.
[41] Chayen NE, Conti E, Vieille C, et al. Crystallization and initial X-ray analysis of xylose isomerase from Thermotoga neapolitana. Acta Crystallogr Sect D, 1997, 53(Pt 2): 229−230.
[42] Wang DC. Protein Engineering. Beijing: Chemical Industry Press, 2002: 34−38.王大成. 蛋白质工程. 北京: 化学工业出版社, 2002: 34−38.
[43] Dekker K, Yamagata H, Sakaguchi K, et al. Xylose (glucose) isomerase gene from the thermophile Thermus thermophilus: cloning, sequencing, and comparison with other thermostable xylose isomerases. J Bacteriol, 1991, 173(10): 3078−3083.
[44] Borgi MA, Rhimi M, Aghajari N, et al. Involvement of cysteine 306 and alanine 63 in the thermostability and oligomeric organization of glucose isomerase from Streptomyces sp. SK. Biologia, 2009, 64(5): 845−851.
[45] Xu W. Study of relationship of structure and function and modification of Thermus thermophilus xylose isomerase[D]. Nanjing: Nanjing University of Technology, 2007.许伟. 嗜热栖热菌木糖异构酶结构与功能关系及改造研究[D]. 南京: 南京工业大学, 2007.
[46] Frank Ogbo C, Frederick Odibo JC. Some properties of the thermostable xylose isomerase of Saccharococcus caldoxylosilyticus No. 31. Biotechnology, 2007, 6(3): 414−419.
[47] Meng M, Bagdasarian M, Zeikus JG. Thermal stabilization of xylose isomerase from Thermoanaerobacterium thermosulfurigenes. Nat Biotechnol, 1993, 11(10): 1157−1161.
[48] Sriprapundh D, Vieille C, Zeikus JG. Molecular determinants of xylose isomerase thermal stability and activity: analysis of thermozymes by site-directed mutagenesis. Protein Eng, 2000, 13(4): 259−265.
[49] Santa H, Kammonen J, Lehtonen O, et al. Stochastic boundary molecular dynamics simulation of L-ribose in the active site of Actinoplanes missouriensis xylose isomerase and its Val135Asn mutant with improved reaction rate. Biochim Biophys Acta, 2005, 1749(1): 65−73.
[50] Karimaki J, Parkkinen T, Santa H, et al. Engineering the substrate specificity of xylose isomerase. Protein Eng Des Sel, 2004, 17(12): 861−869.
[51] Wu CJ, Xiao YZ, Long F, et al. Effects of site-specific mutagenesis of K253 and N184V on the thermostability of D-glucose isomerase. Acta Biochim Biophys Sin, 1996, 28(3): 272−278.伍传金, 肖亚中, 龙凡, 等. K253R和N184V点突变对葡萄糖异构酶热稳定性的影响. 生物化学与生物物理学报, 1996, 28(3): 272−278.
[52] Zhu GP, Xu C, Teng MK, et al. Increasing the thermostability of D-xylose isomerase by introduction of a proline the turn of a random roil. Protein Eng, 1999, 12(8): 635−638.
[53] Ricardo Román CO, Márk G, Bärbel HH, et al. Xylose isomerase with improved properties: US, 6475768. 2002-11-05.
[54] Guo T, Bao XM. Influences of site-directed mutagenesis on the enzymeactivity and the thermostability of the xylose isomerase from Thermus thermphilus. J Shandong Univ: Nat Sci, 2006, 41(6): 145−148.郭亭, 鲍晓明. P137G点突变对嗜热细菌木糖异构酶酶活性及热稳定性的影响. 山东大学学报: 理学版, 2006, 41(6): 145−148.
[55] Sriprapundh D, Vieille C, Zeikus JG. Directed evolution of Thermotoga neapolitana xylose isomerase: high activity on glucose at low temperature and low pH. Protein Eng, 2003, 16(9): 683−690.
[56] Xu W, Cai P, Yan M, et al. Molecular dynamics simulation of temperature-dependent flexibility of thermophilic xylose isomerase. Chin J Chem Phys, 2009, 22(5): 467−472.
[57] Xu W, Cai P, Yan M, et al. Molecular docking of xylitol and xylose isomerase from Thermus thermophilus and model analysis. Chem J Chin Univ, 2007, 28(5): 971−973.许伟, 蔡萍, 严明, 等. Thermus thermophilus木糖异构酶与木糖醇的分子对接及模型分析. 高等学校化学学报, 2007, 28(5): 971−973.
[58] Xu W, Yan M, Ding L, et al. Modeling and analysis the complex of xylose isomerase with D-xylose from Thermus thermophilus. Comput Appl Chem, 2006, 23(6): 531−534.
[59] Xu W, Ding L, Yan M, et al. Expression, purification and enzymatic characterization of thermophilic xylose isomerase in Escherichia coli. China Biotechnol, 2009, 29(2): 65−70.许伟, 丁莉, 严明, 等. 嗜热木糖异构酶在大肠杆菌中的表达、纯化及酶学性质研究. 中国生物工程杂志, 2009, 29(2): 65−70.
[60] Xu W, Yan M, Xu L, et al. Engineering the activity of thermophilic xylose isomerase by site-directed mutation at subunit interfaces. Enzyme Microb Tech, 2009, 44(2): 77−83.
