小麦面粉强筋改良酶制剂研究进展
2013-12-23陆兆新
张 充,陆兆新*
(南京农业大学食品科技学院,江苏 南京 210095)
我国小麦品种众多,但面粉品质不高,在面粉后处理阶段,往往应用面粉改良剂提升面粉品质。过去面粉改良剂多以化学合成品为主,如溴酸钾等强筋剂和过氧化苯甲酰等增白剂。由于溴酸钾可能导致动物的肾脏、甲状腺及其他组织发生癌变,1992年WHO禁止使用溴酸钾这种面粉强筋剂。我国也从2005年7月1日起全面禁止溴酸钾用于面粉改良。为了避免化学改良剂所产生的食品安全问题,而开发以酶制剂为主体的新型、安全、高效的生物面粉改良剂,已成为国内外面粉加工业发展的当务之急。酶作为一种纯天然生物制品其本身就是蛋白质,经食品加工后不会对人体带来潜在的危害,因此酶制品应用于面粉后期改良具有潜在的应用前景,也可弥补我国国产小麦品质上的不足。面粉中蛋白含量一般在8%~14%,主要由清蛋白、球蛋白、谷蛋白和醇溶蛋白构成,其中后两者是主要的面筋蛋白;游离糖(包括戊聚糖、阿拉伯木聚糖)占1%~2%,脂肪占1%~1.5%、灰分与0.4%,此外还有维生素、矿物质等其他物质。酶可以催化面粉中这些成份的聚合,而起到强筋的效果。目前研究的在面粉中直接起到强筋作用的酶有以下2类:转移酶类,以谷胺酰胺转氨酶为代表;氧化酶类,这类酶中包括葡萄糖氧化酶、漆酶、过氧化物酶以及脂肪氧合酶。本文综述了这几种酶在面粉强筋方面的研究进展。
1 谷氨酰胺转氨酶在面粉改性中的应用研究
谷氨酰胺转氨酶(transglutaminase,TGase,EC 2.3.2.13)是一种催化酰基转移反应的转移酶,广泛存在于动、植物和微生物体内[1]。TGase催化机制如下:l)它可催化在蛋白质以及肽键中谷氨酰胺残基的γ-羧酰胺基和伯胺之间的酞胺基转移反应(图1a),利用该反应可以将赖氨酸引人蛋白质来改善面粉的营养特性;2)当蛋白质中的赖氨酸残基的γ-氨基作为酰基受体时,蛋白质在分子内或分子间形成ε-(γ-glutamyl) lys共价键(图1b),通过该反应蛋白质分子发生交联,使得食品以及其他制品产生质构变化,从而赋予产品特有的质构特性和黏合性能;3)当不存在伯胺时,水会成为酞基的受体,谷氨酞胺残基脱去氨基,该反应可以用于改变蛋白质的等电点及溶解度[2-3](图1c)。
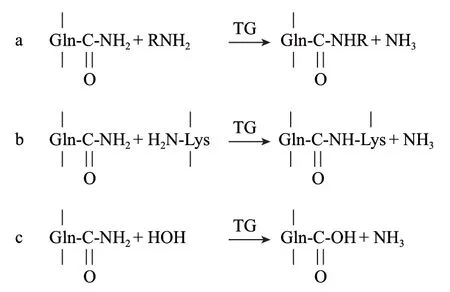
图 1 TGase催化反应机制Fig.1 Catalysis mechanism of TGase
TGase促使蛋白质发生交联的条件是底物蛋白质需要含有一定量的赖氨酸和谷氨酰胺,同时底物蛋白的结构也对会其催化效果产生影响[4-5]。一些蛋白质,如酪蛋白等较易在其催化下发生交联,因其含有较多的赖氨酸和谷氨酰胺组分。肉制品、奶制品是TGase商业应用非常典型的成功例子,主要原因还是由于这2种食物蛋白中存在的氨基酸种类,能够很好的作为TGase的催化底物。
TGase应用于小麦面粉中,促使面筋中ε-Lys与γ-谷酰基间的交联,从而加强面筋网络结构,起到氧化剂的作用,改善面团的流变学性质,延长粉质稳定时间,改善面团的延伸性及持水率,增大面筋网络的持气性[6]。但是,由于面粉品质的差异,面粉中氨基酸种类和含量的差异,对TGase的催化作用产生很大的影响。因此,TGase再面粉的实际生产加工与应用方面还有一定的距离,但TGase的复配研究有可能解决底物不足的问题,如复配中加二硫苏糖醇,打断蛋白质二硫键,暴露出更多的可供TGase催化的位点[7]。
2 葡萄糖氧化酶在面粉改性中的应用研究
葡萄糖氧化酶(glucose oxidase,GOD)被认为是“最有前途的绿色小麦粉强筋剂”,其改良效果已得到广泛认同。葡萄糖氧化酶在1982年首次发现于黑曲霉和灰绿青霉,在有氧条件下氧化葡萄糖生成δ-D-葡萄糖酸内酯,同时生成过氧化氢(H2O2)[8]。GOD对面团的氧化原理尚未达成共识,但大多数学者认为GOD是通过氧化-SH生成二硫键起作用的。由图2可知,GOD在有氧条件下氧化D-葡萄糖产生H2O2,后者在过氧化氢酶催化下氧化面团中蛋白质的-SH生成二硫键-S-S-,从而增强面筋的强度[9]。Wong[10]、Hanft[11]等发现,添加GOD可使面团内W-SH及SDS-SH含量降低。Wikstrom等[12]研究了GOD与蛋白酶、VC及溴酸钾对面团剪切阻力的影响,发现GOD的作用方式与溴酸钾接近。另外,大量流变学研究[13]表明GOD可改善面团的粉质拉伸及动态流变学特性,均为该理论提供了佐证。
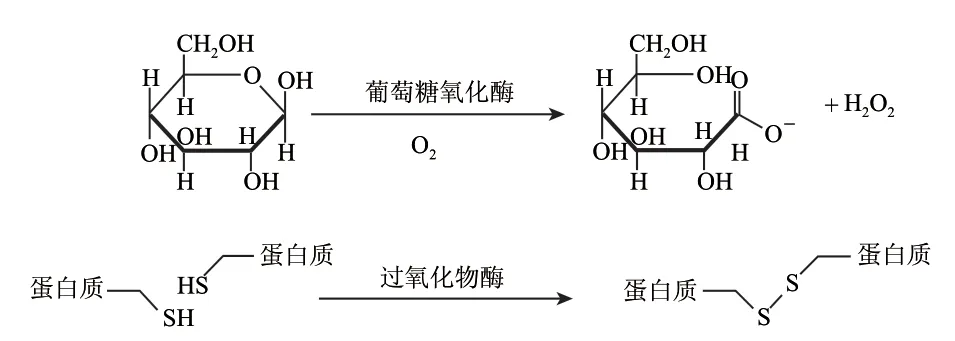
图 2 GOD对面粉强筋机制Fig.2 Flour gluten improvement of GOD
此外,也有学者[14]认为 GOD 还可以促进小麦粉中水溶性戊聚糖的氧化凝胶化,进而增强面团的网络骨架。Wang Mingwei等[15]的研究表明,戊聚糖酶(PE)与 GOD具有协同效应,前者水解面团内的大分子不溶性戊聚糖(UEAX),生成链较短的可溶性戊聚糖(WEAX),WEAX在GOD的作用下发生链间交联形成凝胶,改善了面团延展性及面包芯的品质。
国内外有关葡萄糖氧化酶的专利不是很多,国外关于葡萄糖氧化酶的专利多集中在面粉强筋及面包焙烤中的应用。国内黄卫宁等[16]用葡萄糖氧化酶替代溴酸钾作为生物氧化剂添加到小麦粉中,增强了小麦粉制品中面筋的筋力。黄卫宁等[17]将葡萄糖氧化酶和过氧化氢酶用于抗冻发酵冷冻面团,利用葡萄糖氧化酶和过氧化氢酶催化蛋白质之间交联,形成更加稳定的面筋网络结构。
目前,GOD氧化形成二硫键的强筋机制是普遍接受的观点,但是,仍有学者提出质疑。1998年,Vemulapalli等[18]最先发现了GOD对面筋蛋白并不起作用。国际谷物化学界的权威Miller等[19]及其研究小组最初也认为GOD的作用在于对面筋蛋白质的氧化,但随后的研究发现GOD可能导致了多糖结构中阿魏酸与蛋白质中酪氨酸的交联。因此,随着研究的深入,有学者认为上述氧化蛋白质的机理不能完全揭示GOD对面粉的强筋机制。另外GOD在实际的生产应用方面也存在着缺陷。首先,缺乏优良的GOD基因,在体系中稳定性较差,容易发生物理化学变性。另一个原因是缺乏高产GOD的菌种及酶的大规模生产制备技术。因此,关于 GOD今后的研究应集中在:1)彻底阐明强筋机理:GOD在面粉强筋过程中除了催化二硫键的形成外,是否对面粉蛋白的其他氨基酸,以及面粉中的多糖产生作用;2)筛选或突变获得优良菌株:从多种环境中筛选产酶高、催化反应优良的菌种,或者利用物理、化学、分子生物学手段对已有的产GOD的菌株进行诱变处理。3)优良菌种的发酵条件的探讨构建;4)建立大规模生产技术。
3 漆酶在面粉改性中的应用研究
漆酶(laccase,Lac,EC1.10.3.2)是自然界普遍存在的一种含铜金属酶类,可催化各种酚类物质如儿茶酸、单宁、黄酮等氧化为醌,是儿茶酚氧化酶和漆酶的统称[20]。Lac可以催化蛋白质发生交联聚合,可能是由于Lac能催化蛋白质分子中的酪氨酸残基以及与蛋白质通过非肽键相连的酚类化合物的氧化来实现[21](图3)。另外,多酚氧化酶可使酚类化合物氧化成醌,而醌类化合物也可与蛋白质的氨基、巯基、吲哚基等基团发生反应从而导致蛋白聚合。
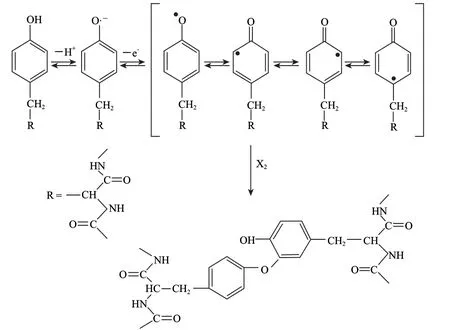
图 3 Lac催化酪氨酸残基氧化Fig.3 Tyrosine oxidation catalysis by Lac
在面团形成和烘焙过程中,Lac所参与的催化强筋作用与阿魏酸和阿拉伯木聚糖有着密不可分的关系。Labat等[22]报道了漆酶和阿魏酸在面团上应用的效果,当漆酶与阿魏酸同时添加到生面团中,通过漆酶对阿拉伯木聚糖中的阿魏酸酯的二聚作用来催化凝胶化;同时增加了混合期间巯基的氧化作用以及蛋白质的解聚作用,在氧化的面筋/水溶性戊聚糖混合物中发现阿拉伯木聚糖和蛋白质之间的共价配合物。氧化酶增加了面团的连接性,降低了阿拉伯木聚糖的水溶性,从而来提高面筋强度。在面包加工方面,漆酶的使用可以增加面包体积,改善面包结构和柔软性。Carunchio等[23]以真菌漆酶纯酶为研究材料,发现漆酶具有使面粉多糖中的阿魏酸发生相互交联的作用;Mattinen等[21]发现真菌来源的纯化的漆酶对面筋蛋白中的酪氨酸有催化聚合作用。
目前,国内外研究主要集中于真菌漆酶,在菌种选育、发酵条件以及在环境治理方面有大量的报道[24-26]。有关漆酶在食品加工,尤其是面粉改良方面的研究报道还不多。在食品加工中,可能受到制约的一个主要因素是酶的热稳定性问题,因为绝大多数的真菌漆酶的热稳定性不高。但有最新报道表明[27-28],细菌漆酶,如芽孢杆菌类的一些菌株,能产生耐热性良好的漆酶。今后在产酶菌株方面的研究应关注于细菌来源的漆酶。
4 过氧化物酶在面粉改性中的应用研究
过氧化物酶(peroxidase,POD,EC1.11.1.7)是一类以血红素为辅基的酶,广泛存在于各种动物、植物和微生物体内,可催化过氧化氢对多种有机物和无机物的氧化作用,当无过氧化氢存在时,氧分子可作为氢受体发生氧化反应[29]。
国内外有关POD对面粉具有强筋作用的研究,主要集中在对面粉中多糖、蛋白质的交联作用上。有学者[30]从小麦面粉和小麦麸中分离了阿魏酰阿拉伯木聚糖,对POD作用的氧化交联进行了研究,结果发现在POD/H2O2反应体系下,可催化阿魏酰阿拉伯木聚糖二聚体的形成。
Figueroa-Espinoza等[31]研究了锰过氧化物酶(MnP)对阿拉伯木聚糖的交联作用,结果表明MnP通过两条途径催化面粉中相关物质的交联:1) MnP催化阿魏酰阿拉伯木聚糖,产物半醌类阿魏酰阿拉伯木聚糖自由基,后者催化面粉中自由巯基生成二硫键,从而发挥强筋作用;2) MnP催化阿魏酰阿拉伯木聚糖脱甲基,生成咖啡酰阿拉伯木聚糖,在Mn3+作用下生成半醌类咖啡酰阿拉伯木聚糖,进而催化与含巯基氨基酸的聚合,形成糖类-蛋白的复合体(图4)。
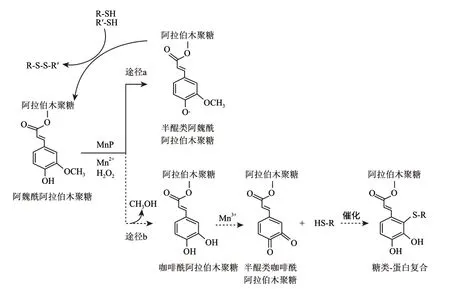
图 4 POD催化含巯基氨基酸的聚合(a)和 POD催化阿魏酰阿拉伯木聚糖与巯基氨基酸二聚体形成(b)Fig.4 Polymerization of mercaptoamino-acid catalysis by POD (a) and dimerization of feruloylated arabinoxylans and mercaptoamino-acid catalysis by POD (b)
Oudgenoeg等[32]研究发现辣根过氧化物纯酶能够催化阿魏酸与酪氨酸的聚合作用。Boeriu等[33]也发现在POD/H2O2的作用下可使酪氨酸与阿魏酰阿拉伯木聚糖发生交联聚合,首先是酪氨酸残基与阿魏酰阿拉伯木聚糖中的酚基作为供氢体在POD/H2O2的催化下氧化而分别形成酪蛋白的聚合体与阿魏酰阿拉伯木聚糖的聚合体(图5)。

图 5 POD催化酪氨酸与阿魏酸聚合Fig.5 Polymerization of tyrosine and ferulaic acid catalysis by POD
根据目前研究报道,对POD增强面筋交联作用的可能机制归纳如下:1)面粉中多糖物质的交联作用:POD催化水溶性阿魏酰阿拉伯木聚糖二聚体的形成;2)面粉中蛋白质间的交联:POD催化含巯基的氨基酸之间的二硫键的形成;3)面粉多糖与蛋白质间的交联作用:POD催化酪氨酸与阿魏酸间醚键的形成;POD催化阿魏酰阿拉伯木聚糖与巯基氨基酸聚合体的形成。
5 脂肪氧合酶在面粉改性中的应用研究
脂肪氧合酶(lipoxygenase,LOX,EC1.13.11.12),是一种含非血红素铁的蛋白,酶蛋白由单肽链组成,分子质量范围一般在90000~100000D之间,专门催化具有顺,顺-1,4戊二烯结构的不饱和脂肪酸的加氧反应,形成具有共轭双键的氢过氧化物,这些氢过氧化物性质活泼,是重要的化学反应中间体[34]。研究表明,面粉中添加大豆粉而产生的强筋和漂白作用是由大豆粉中的脂肪氧合酶引起的[35-36]。Dunnewind等[37]以纯化的大豆LOX为材料,研究发现LOX纯酶能够提高面团的拉伸性能和持水性。Toyosaki等[38]通过SDS-PAGE的方法研究了LOX对面筋蛋白的聚合作用,结果表明经LOX处理的样品,经SDS-PAGE检测出的分子质量明显高于对照组。
早期研究认为[39],由大豆粉中LOX催化不饱和脂肪酸形成的氢过氧化物能氧化蛋白质分子中的-SH形成-S-S-并能诱导蛋白质分子聚合,使蛋白质分子变得更大,从而起到强化面筋的作用(图6)。
随着研究的深入,学者们也都推测LOX与面筋筋力相关因素——面粉中淀粉多糖以及面筋蛋白中的氨基酸有着密不可分的关系,但是缺乏有力的实验证据。然而在用商品化的LOX纯酶为材料进行的研究中,只是研究了面团流变学和拉伸性能等宏观变化等[37],但是没有对强筋机制进行深入研究。因此,严格地说到目前为止,LOX在面粉强筋机理还没有清楚地被阐明。需要针对LOX的单一组分与面筋蛋白、面粉中多糖之间的酶促机制进行全面、深入的研究。而目前商品化的LOX纯酶提取工艺复杂,价格昂贵,即使明确了其机理,高成本也会制约LOX应用前景。因此,探寻能获得低成本、高纯度的酶的研究材料,是解决LOX在面粉强筋应用的关键因素。
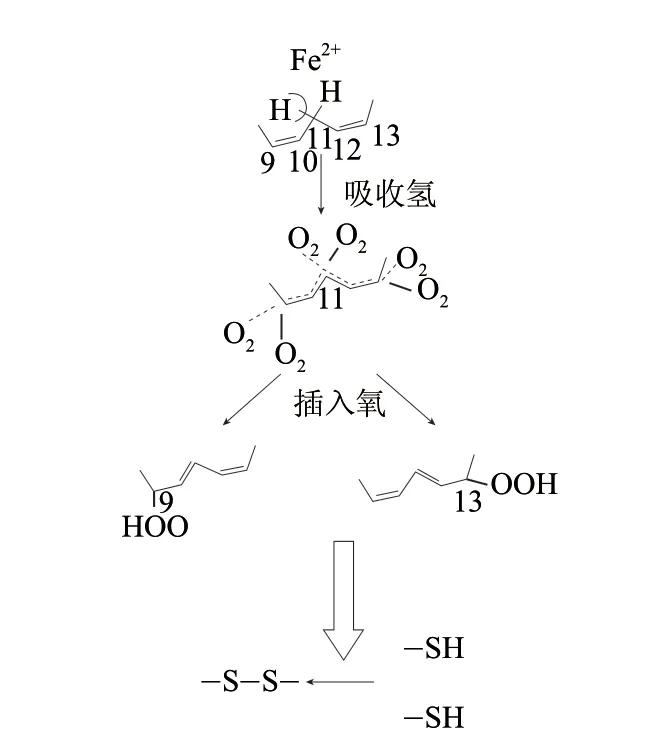
图 6 LOX催化面粉中二硫键的形成Fig.6 Formation of disulfide bond catalysis by LOX in flour
南京农业大学食品学院,就有关LOX的基因的挖掘、应用展开了大量研究。从鱼腥藻PCC7120(Anabaena sp. PCC 7120)的基因组中克隆获得脂肪氧合酶基因。在E.coli中获得了高效活性表达,表达量比已报道的最高的重组LOX酶活提高了50倍以上,通过简单纯化过程获得了纯酶[40],并对其在面粉中的应用进行了研究,发现重组Ana-LOX对面筋蛋白具有很好的交联效果(图7)。经过重组Ana-LOX改良的面团制作出的面包体积,明显优于未处理的对照组。
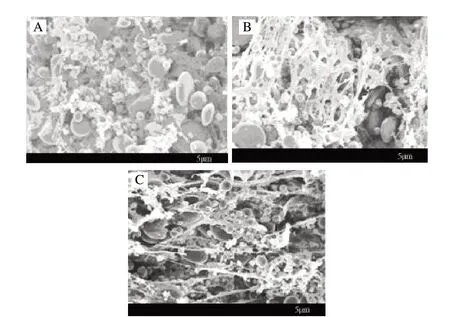
图 7 面团的SEM显微结构图Fig.7 SEM of dough
同时,为了实现重组Ana-LOX的低成本纯化目的,进行了Ana-LOX的食品级枯草杆菌表达系统研究。构建了一个Ana-LOX的高效分泌表达载体,建立了一套枯草杆菌无抗生素筛选的方法,构建获得了具有自主知识产权的食品级工程菌宿主菌[41-42]。
而在应用过程中,目前已被发现的脂肪氧合酶,包括Ana-LOX的热稳定性并不理想。针对该问题,本实验室也在尝试通过非理性设计和理性设计的方法提高Ana-LOX的热稳定性。非理性策略中,对于突变基因的高通量筛选方法的建立是至关重要的。例如郭芳芳等[43]建立了碘化钾-淀粉法快速测定脂肪氧合酶的方法,获得的突变体LOX-120、LOX-422在50℃条件下的半衰期t1/2比野生酶分别提高到1.9倍和1.8倍。
理性设计是建立在对目标蛋白结构了解较为深入的基础上。大豆脂肪氧合酶的晶体结构已被解析,通过同源建模可以预测不同来源的脂肪氧合酶的空间结构。Cristea等[44]在研究Mn脂肪氧合酶过程中,在模拟Mn脂肪氧合酶空间结构和活性中心的基础上,对其进行了定点突变研究,发现突变基因表达出的重组酶丧失了活性,进一步研究发现突变重组酶检测不到Mn离子,该结果提示活性中心的氨基酸残基的改变对酶的性质具有重要影响。课题组运用生物信息学相关软件,预测了Ana-LOX的三维空间结构(图8a)及Ana-LOX活性中心位点(图8b),定位铁离子的5个氨基酸残基分别为His197、His202、His369、Asn373和Ile455。为了验证上述预测,已对上述5个位点进行了大量定点突变研究。虽然未获得性质改良的酶基因,但证实了上述5个位点确实为Ana-LOX的活性中心位点[40]。因此,在此基础上,对活性中心周围(空间结构)进行定点突变,获得热稳定提高的酶基因,具备一定的理论基础和技术的可行性。
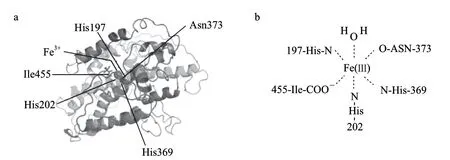
图 8 Ana-LOX模拟的三维空间结构(a)和 Fe3+在Ana-LOX活性中心定位模型(b)Fig.8 Analogous three-dimension structure of Ana-LOX (a) and analogous allocation of Fe3+ in the active center of Ana-LOX (b)
6 其他酶类在面粉改性中的应用研究
除上述在面粉加工中可以起到直接催化交联的酶之外,还有一些酶通过其在面粉中的催化反应,间接的起到强筋的效果。脂肪酶可以将甘油三酯水解生成甘油二酯或甘油一酯或甘油,面粉中的脂肪经脂肪酶分解后生成具有乳化作用的物质,在面筋网络和淀粉之间起乳化的作用,改善面团的结构,增大面制品的体积[45]。淀粉酶是一种在面粉改良中应用非常普遍的酶制剂,其效果非常显著。α-淀粉酶可以作用于面粉中的破损淀粉,生成糊精,使得面粉的结构细密,在加工过程中会很好的增加持汽性。另外,经淀粉酶作用后产生葡萄糖,增加GOD的底物,强筋效果优于单独添加GOD。添加淀粉酶也要适量,过度添加会使面制品的体积变小,而且容易老化[46]。戊聚糖酶可以将水不溶的戊聚糖分解为水溶性的戊聚糖,并伴随游离阿拉伯基木聚糖和阿魏酸含量的提高,从而增强漆酶和过氧化物酶的作用效果[47]。
7 结 语
随着人们生活水平的提高,对面制品的安全性、品质性的要求也逐步提高。溴酸钾作为传统的面粉强筋剂已被取缔,绿色天然的酶制剂是最佳的面粉强筋剂。目前,多种酶已发现在面粉强筋过程中起到直接的催化作用,而纯酶制备成本过高是制约应用的主要瓶颈。在阐明酶催化强筋机制的基础之上,研究方向的重点趋向于如何获得大量纯化酶制剂、如何解决酶制剂的储藏稳定性和在面粉加工中稳定性问题。另外,通过应用宏基因组学、生物信息学、结构生物学以及分子生物学的方法和手段,探索和开发新的面粉改良酶制剂,实现酶制剂在面粉加工中的应用。
[1] MOTOKI M, SEGURO K. Transglutaminase and its use for food processing[J]. Trends Food Science Technology, 1998, 9: 204-210.
[2] 常中义, 江波, 王璋. 微生物谷氨酰胺转胺酶的应用进展[J]. 食品科学, 2000, 21(9): 6-8.
[3] ZHU Y. Microbial transglutaminase: a review of its production and application in food processing[J]. Applied Microbiology and Biotechnology, 1995, 44: 277-282.
[4] FALCONE P, SERAFINI-FRACASSINI D, DEL-DUCA S. Comparative studies of transglutaminase activity and substrates in different organs of Helianthus tuberosus[J]. Journal of Plant Physiology, 1993, 142: 263-273.
[5] YASUEDA H, KUMAZAWA Y, MOTOKI M. Purification and characterization of a tissue-type transglutaminase from red sea bream (Pagrus major)[J]. Bioscience Biotechnology and Biochemistry, 1994, 58: 2041-2045.
[6] 寇明钰, 赵国华, 阚健全. 谷氨酰胺转胺酶及其在食品工业中的作用[J]. 中国食品添加剂, 2004(5): 81-88.
[7] ABOUMAHMOUD R, SAVELLO P. Crosslinking of whey protein by transglutaminase[J]. Journal of Dairy Science, 1990, 73(2): 256-263.
[8] WITT S, WOHLFAHRT G, SCHOMBURG D, et al. Conserved arginine-516 of Penicillium amagasakiense glucose oxidase is essential for the efficient binding of β-D-glucose[J]. The Biochemical Journal, 2000, 347: 553-559.
[9] STEFFOLANI M E, RIBOTTA P D, ALBERTO E L, et al. Effect of glucose oxidase, transglutaminase, and pentosanase on wheat proteins: relationship with dough properties and bread-making quality[J]. Journal of Cereal Science, 2010, 51: 366-371.
[10] WONG C M, WONG K H, CHEN X D. Glucose oxidase: natural occurrence, function, properties and industrial applications[J]. Applied Microbiology and Biotechnology, 2008, 78: 927-938.
[11] HANFT F, KOEHLER P. Studies on the effect of glucose oxidase in bread making[J]. Journal of the Science of Food and Agriculture, 2006, 86: 1699-1702.
[12] WIKSTROM K, ELIASSON A C. Effect of enzymes and oxidizing agents on shear stress relaxation of meat flour dough: addition of protease, glucose oaidase, ascorbic acid, and potassium bromate[J]. Cereal Chemistry, 1998, 75: 331-337.
[13] CABALLERO P A, GOMEZ M, ROSELL C M. Improvement of dough rheology, bread quality and bread shelf-life by enzymes combination [J]. Journal of Food Engineering, 2007, 81: 42-45.
[14] DECAMPS K, JOYE I J, HALTRICH D, et al. Biochemical characteristics of Trametes multicolor pyranose oxidase and Aspergillus niger glucose oxidase and implications for their functionality in wheat flour dough[J]. Food Chemistry, 2012, 131(4): 1458-1492.
[15] WANG Mingwei, VLIET T V, HAMER R J. Evidence that pentosans and xylanase affect the re-agglomeration of the gluten network [J]. Journal of Cereal Science, 2004, 39: 341-349.
[16] 黄卫宁, 邹奇波. 贾春利. 一种用于面制品中可代替溴酸钾的生物氧化剂: 中国, 200610037642[P]. 2006-10-03.
[17] 黄卫宁, 贾春利. 一种含有葡萄糖氧化酶和过氧化物酶的抗冻发酵冷冻面团及其生产方法: 中国, 2005, 200510094856[P]. 2005-10-09.
[18] VEMULAPALLI V, MILLER K A, HOENEY R C. Glucose oxidase in breadmaking system[J]. Cereal Chemistry, 1998, 75: 439-442.
[19] MILLER K A, HOSENEY R C. Effect of oxidation on the dynamic rheological properties of wheat flour-water doughs[J]. Cereal Chemistry, 1999, 76: 100-104.
[20] GIANFREDA L, XU F, BOLLAG J M. Laccase: a useful group of oxidoreductive enzymes[J]. Bioremediation Journal, 1999, 3: 1-25.
[21] MATTINEN M L, KRUUS K, BUCHERT J, et al. Laccase catalyzed polymerization of tyrosine-containing peptides[J]. FEBS, 2005, 272: 3640-3650.
[22] LABAT E, MOREL M H, ROUAU X. Effect of laccase and ferrulic acid on wheat flour doughs[J]. Cereal Chemistry, 2000, 77: 823-828.
[23] CARUNCHIO F, CRESCENZI C, GIRELLI A M, et al. Oxidation of ferulic acid by laccase: identification of the products and inhibitory effects of some dipeptides[J]. Talanta, 2001, 55: 189-200.
[24] FOROOTANFAR H, FARAMARZI M A, SHAHVERDI A R, et al. Purification and biochemical characterization of extracellular laccase from the ascomycete Paraconiothyrium variabile[J]. Bioresource Technology, 2011, 102: 1808-1804.
[25] HALABURGI V M, SHARMA S, SINBA M, et al. Purification and characterization of a thermostable laccase from the ascomycetes Cladosporium cladosporioides and its applications[J]. Process Biochemistry, 2011, 46: 1146-1152.
[26] BALDRIAN P. Fungal laccases-occurrence and properties[J]. FEMS Microbiol Review, 2006, 30: 215-242.
[27] ZHANG C, DIAO H W, LU F X, et al. Degradation of triphenylmethane dyes using using temperature and pH stable laccase from a strain of Bacillus vallismortis[J]. Bioresource Technology, 2012, 126: 80-86.
[28] LU L, ZHAO M, WANG T N, et al. Characterization and dye degradation ability of an alkaline resistant and organic solvents tolerant laccase from Bacillus licheniformis LS04[J]. Bioresource Technology, 2012, 115: 35-40.
[29] 田国忠, 李怀方, 裘维蕃. 植物过氧化物酶研究进展[J]. 武汉植物学研究, 2001, 19(4): 332-344.
[30] SCHOONEVELD-BERGMANS M E F, DIGNUM M J W, GRABBER J H, et al. Studies on the oxidative cross-linking of feruloylated arabinoxylans from wheat flour and wheat bran[J]. Carbohydrate Polymers, 1999, 38(4): 309-317.
[31] FIGUEROA-ESPINOZA M C, MOREL M H, SURGET A, et al. Oxidative cross-linking of wheat arabinoxylans by manganese peroxidase. Comparison with laccase and horseradish peroxidase. Effect of cysteine and tyrosine on gelation[J]. Journal of the Science of Food and Agriculture, 1999, 79: 460-463.
[32] OUDGENOEG G, HILHORT R, PIERSMA S R, et al. Peroxidasemediated cross-linking of a tyrosine-containing peptide with ferulic acid[J]. Journal of Agricultural and Food Chemistry, 2001, 49(5): 2503-2510.
[33] BOERIU C G. Horseradish peroxidase-catalyzed cross-linking of feruloylated arabinoxylans with beta-casein[J]. Journal of Agricultural and Food Chemistry, 2004, 52(21): 6633-6639.
[34] 李彩凤, 赵丽影, 陈业婷, 等. 高等植物脂氧合酶研究进展[J]. 东北农业大学学报, 2010, 41(10): 143-149.
[35] HOOVER W. Use of soy proteins in baked foods[J]. Journal of the American Oil Chemists Society, 1979, 56: 301-303.
[36] FAUBION J M, HOSENEY R C. Lipoxygenase: its biochemistry and role in breadmaking[J]. Cereal Chemistry, 1981, 58: 175-180.
[37] DUNNEWIND B, VLIE V T, ORSEL R. Effect of oxidative enzymes on bulk rheological properties of wheat flour doughs[J]. Journal of Cereal Science, 2002, 36: 357-366.
[38] TOYOSAKI T. Effects of hydroperoxide in lipid peroxidation on dough fermentation[J]. Food Chemistry, 2007, 104: 680-685.
[39] SHEWRY P R, TATHAM A S, BARRO F, et al. Biotechnology of breadmaking: unravelling and manipulating the multi-protein gluten complex[J]. Biotechnology, 1995, 13: 1185-1190.
[40] 张充, 周孝伟, 吕凤霞, 等. 重组鱼腥藻脂肪氧合酶基因克隆表达, 分离纯化及酶学性质的研究[J]. 生物工程学报, 2012, 28(4): 440-456.
[41] ZHANG C, TAO T T, YING Q, et al. Extracellular production of lipoxygenase from Anabaena sp. PCC 7120 in Bacillus subtilis and its effect on wheat protein[J]. Applied Microbiology and Biotechnology, 2012, 94(4): 949-958.
[42] ZHANG C, ZHANG X H, YAO Z Y, et al. A new method for multiple gene inactivations in Bacillus subtilis 168, producing a strain free of selectable markers[J]. Canadian Journal of Microbiology, 2011, 57(5): 427-436.
[43] 郭芳芳, 应琦, 张充, 等. 重组脂肪氧合酶基因工程菌破碎条件优化及其酶活力测定方法研究[J]. 食品科学, 2013.1.7网络出版.
[44] CRISTEA M, ENGSTR M Å, SU C, et al. Expression of manganese lipoxygenase in Pichia pastoris and site-directed mutagenesis of putative metal ligands[J]. Archives od Biochemistry and Biophysics, 2005, 434(1): 201-210.
[45] 王学东, 李庆龙, 张声华. 外源脂肪酶对国产小麦面包粉品质的影响[J]. 食品科学, 2003, 24(7): 96-99.
[46] 刘爱国, 陈庆森, 祁兵, 等. 淀粉酶和糖化酶在冷冻食品中的应用研究[J]. 食品科学, 2004, 25(4): 115-118.
[47] 王学东, 李庆龙, 张声华. 外源戊聚糖酶对国产小麦面包粉品质的影响[J]. 食品科学, 2004, 25(11): 41-44.
