骨癌痛大鼠脊髓背角TRESK 表达水平的变化*
2013-12-23张登文吴焕兵张传汉姚文龙田玉科王学仁
张登文, 吴焕兵, 张传汉, 夏 辉, 徐 林, 姚文龙, 田玉科, 王学仁△
1华中科技大学同济医学院附属同济医院麻醉学教研室,武汉 430030
2武警湖北省总队医院麻醉科,武汉 430061
医学技术的进步大大提高了癌症患者的5年生存率。随之凸现的问题是癌症引起的疼痛严重影响着患者生活质量,其中以骨癌痛为典型代表。骨癌痛一般是由原发性的肿瘤或其他部位的肿瘤转移所引起的痛觉过敏、痛觉超敏,具有自发性。TRESK(TWIK-related spinal cord K+channel)是近年新发现的一种双孔钾通道,它主要定位于脊髓和背根神经节,是一种重要的背景钾离子通道。最近发现TRESK 的突变与家族性偏头痛有关[1]。但是TRESK 在骨癌痛发生与维持过程中的作用并不十分清楚。因此,本研究拟观察骨癌痛大鼠脊髓背角TRESK 的表达变化,为进一步探讨骨癌痛的发病机制提供参考。
1 材料与方法
1.1 实验动物及分组
清洁级雌性SD 大鼠12只,体重150~180g,由华中科技大学同济医学院实验动物学部提供,饲养于同济医院实验动物中心,室温20~24℃,湿度约60%。将大鼠随机分为假手术组(Sham 组)和骨癌痛组(BCP组),每组6只大鼠。
1.2 骨癌痛大鼠模型的制备
大鼠用10%水合氯醛麻醉后(3mL/kg),仰卧固定于操作台上,备皮后碘伏消毒右侧后肢皮肤,于胫骨上段切开皮肤,钝性分离肌肉骨膜组织,暴露胫骨,在胫骨结节下方0.5~1.0cm 处的胫骨平台上用23G 的注射器针头垂直钻孔至骨髓腔,再用20 μL微量注射器将10μL Walker256大鼠乳腺癌细胞(3×104个)悬液缓慢注入骨髓腔内。注射完毕后,用医用骨蜡封住针孔,消毒皮肤切口,局部给予少许青霉素后缝合肌肉、皮肤。Sham 组大鼠予骨髓腔内注射10μL的D-Hanks液。
1.3 机械痛阈测定
各组大鼠在手术前1d测定基础机械缩足阈值(mechanical withdrawal threshold,MWT),取平均值为基础值。各组大鼠均在术后3、5、9、14d,用Von-Frey纤维丝(美国Stoeling公司)以up-down法[2]测定术侧的MWT。
MWT 的测定:将大鼠置于一透明玻璃箱内,待其适应20min后,用Von-Frey纤维丝垂直刺激大鼠右后肢足底皮肤表面,持续时间≤6s,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。首次测定从2g开始,当该力度的刺激不能引起阳性反应时,给予大一级力度的刺激;如出现阳性反应则给予小一级力度的刺激,如此连续进行,直至出现第一次阳性和阴性反应的骑跨,再连续测定4 次。最大力度为15g,大于此值时记为15g。每次刺激间隔30s。
1.4 KATP通道的免疫组织化学染色
术后14d,大鼠分别用10%水合氯醛麻醉后,行左心室-主动脉插管,依次用4℃生理盐水200mL及含4%多聚甲醛400mL灌流。取腰膨大段脊髓,4%多聚甲醛后固定,30%蔗糖脱水至组织沉底后,行冰冻切片,片厚20μm。PBS漂洗5 min×3次,山羊血清封闭15 min 后加入兔抗鼠TRESK(1∶200),4℃过夜。PBS漂洗5min×3次,加入FITC标记的羊抗兔二抗(1∶100)孵育1h,PBS 漂洗5 min×3次,荧光显微镜下观察。
1.5 Western blot检测
术后14d,每组取4只大鼠,麻醉后处死,取脊髓腰膨大组织,用RIPA 裂解液提取组织总蛋白,并用分光光度仪测定蛋白浓度。将100μg的蛋白用5%的浓缩胶及10%的分离胶进行电泳后转移至PVDF膜上,5%的脱脂奶粉室温下封闭1h,一抗(TRESK 1∶500,GAPDH 1∶5 000)4℃孵育过夜,洗膜后辣根过氧化物酶标记的二抗(1∶5 000)室温下孵育1h。漂洗后加入ECL 发光试剂,用BIORAD GelDoc 2000凝胶成像系统进行成像分析。
1.6 统计学分析
2 结果
2.1 机械痛阈值的变化
两组大鼠术前MWT 值差异无统计学意义(P>0.05);BCP 组在手术后5d机械痛阈值开始降低,与Sham 组相比,差异有统计学意义(P <0.05),见表1。
表1 各组大鼠不同时点机械缩足阈值的变化(g,±s,n=6)Table 1 The changes of MWTs of rats at different time points(g,±s,n=6)
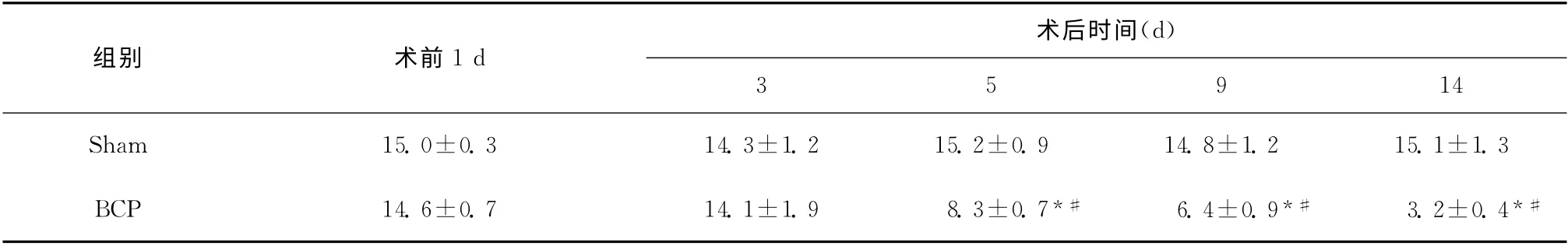
表1 各组大鼠不同时点机械缩足阈值的变化(g,±s,n=6)Table 1 The changes of MWTs of rats at different time points(g,±s,n=6)
与Sham 组比较,*P<0.05;与手术前1d比较,#P<0.05
术后时间(d)组别术前1d 3 5 9 14 Sham 15.0±0.3 14.3±1.2 15.2±0.9 14.8±1.2 15.1±1.3 BCP 14.6±0.7 14.1±1.9 8.3±0.7*#6.4±0.9*#3.2±0.4*#
2.2 TRESK 蛋白的表达
如图1所示,TRESK的表达主要位于脊髓背角。Western blot检测结果也显示,BCP组的TRESK 蛋白的表达较Sham 组明显减少(P<0.05),见图2。
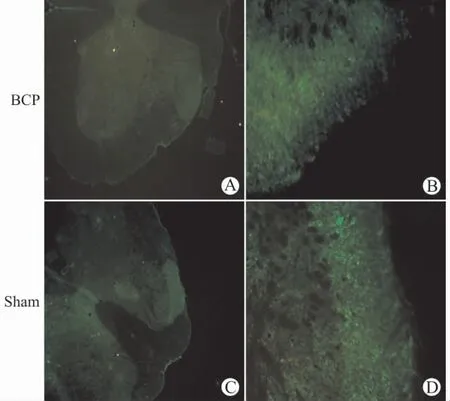
图1 大鼠脊髓腰膨大术侧背角组织TRESK 免疫荧光染色(A、C:×40,B、D:×200)Fig.1 Immunofluorescence staining of TRESK in the spinal dorsal horn of rats(A,C:×40,B,D:×200)
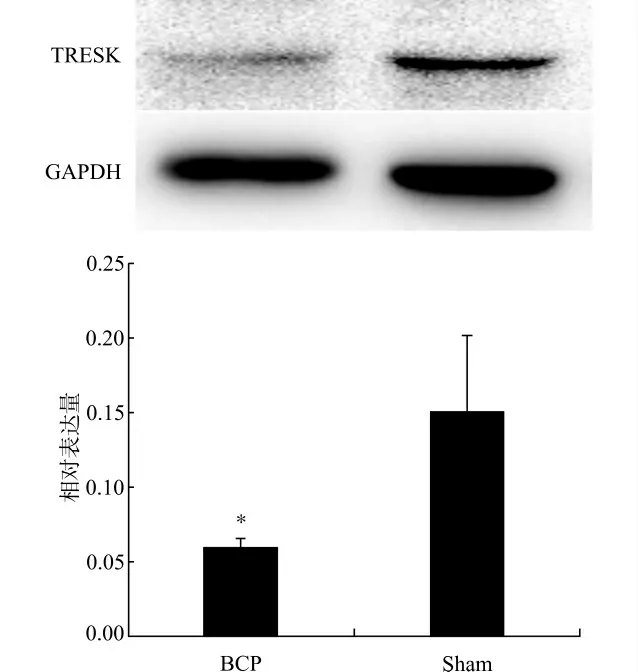
图2 大鼠脊髓腰膨大术侧背角组织TRESK 表达变化Fig.2 The changes in expression of TRESK in rat spinal dorsal horn
3 讨论
向胫骨骨髓腔注入Walker 256 乳腺癌细胞制备大鼠胫骨癌痛模型是比较成熟的骨癌痛模型[3]。本研究结果表明,在接种癌细胞5d后大鼠的机械痛阈值开始明显降低,表明模型制备成功。
骨癌痛机制复杂。脊髓背角是疼痛信息传递和整合的初级中枢,也是机体对于伤害性信息进行自身调制或整合的重要位点之一。目前研究认为脊髓中枢敏化在神经病理性疼痛的产生和维持中起着重要的作用。中枢敏化是指伤害性刺激传入引起的中枢神经系统疼痛传递神经元兴奋性增高及突触的可塑性改变[4]。神经元兴奋性增高导致一些本不该产生自发放电活动的部位产生自发放电现象,即异位放电。
钾离子通道的生理作用是维持细胞膜的静息电位,使动作电位复极化,决定着神经元的放电频率等。抑制钾通道可以使异位放电的频率增加,提示钾通道参与了异位放电的形成。Everill等[5]发现坐骨神经损伤后,受损的DRG 大神经元的钾电流明显下调,其中IA 降低60%,IK 降低65%,ID 无明显变化。同时在我们的前期研究中发现开胸术后大鼠胸段脊髓背角神经元中的ATP敏感性钾离子通道的表达是降低的,在坐骨神经慢性压迫性损伤大鼠模型中也得到同样的结果[2,6]。
TRESK,双孔微弱的内向整流钾通道(TWIK)相关的脊髓钾通道,是近年新发现的一种双孔钾离子通道(K2P),它与其他的钾离子通道包括电压门控(Kv)、钙激活(Kca)和内向整流器(Kir)通道在分子结构、电生理和药理性质方面区别很大。K2P 的离子选择通道亚基由4次跨膜(TMA1-4)和双孔形成区(P1,P2)组成,而其它的钾通道亚基由2、6或8次跨膜片段和一个保守孔形成区组成。K2P电流在所有的细胞膜电位中都能观察到,而且能被电压跃阶即时地激活且没有显示激活所需的电压阈值,这也是能把它们从其它的钾电流中辨别出来的原因。因此,它能产生漏电流来帮助形成和稳定静息电位并且在生理条件下影响细胞兴奋性[7-8]。TRESK主要定位于脊髓和背根神经节,是一种重要的背景钾离子通道[9]。Kang等[10]发现在24℃时背根神经节神经元主要的背景钾离子通道是TRESK。Lafreniere等[1]发现在典型家族性偏头痛患者中TRESK 的基因发生了移位突变,TRESK 突变后,患者会更容易感到头痛,对光线、声音和触碰也变得更敏感。
本研究结果显示,骨癌痛大鼠脊髓背角TRESK 的表达较Sham 组明显降低。这表明,TRESK 可能参与了骨癌痛的发生。其他的研究也发现在神经病理性疼痛中大鼠脊髓背根神经节TRESK 的表达降低[11-12]。我们推测在神经损伤或受压后,可能导致背根神经节神经元和脊髓背角神经元细胞膜上的TRESK 表达降低,从而使钾离子外流减少,细胞膜的静息电位升高,神经元的兴奋性增加,放电频率增加,导致异位放电,形成中枢敏化。
综上所述,脊髓背角神经元膜上的TRESK 在骨癌痛中可能起重要的作用。但骨癌痛改变TRESK 基因表达的具体机制还有待进一步探讨。
[1] Lafreniere R G,Cader M Z,Poulin J F,et al.A dominant-negative mutation in the TRESK potassium channel is linked to familial migraine with aura[J].Nat Med,2010,16(10):1157-1160.
[2] 吴焕兵,张登文,夏辉,等.坐骨神经慢性压迫性损伤大鼠相应脊髓背角神经元KATP通道表达的变化[J].华中科技大学学报:医学版,2011,40(4):400-403.
[3] Mao-Ying Q L,Zhao J,Dong Z Q,et al.A rat model of bone cancer pain induced by intra-tibia inoculation of Walker 256 mammary gland carcinoma cells[J].Biochem Biophys Res Commun,2006,345(4):1292-1298.
[4] Latremoliere A,Woolf C J.Central sensitization:agenerator of pain hypersensitivity by central neural plasticity[J].J Pain,2009,10(9):895-926.
[5] Everill B,Kocsis J D.Reduction in potassium currents in identified cutaneous afferent dorsal root ganglion neurons after axotomy[J].J Neurophysiol,1999,82(2):700-708.
[6] 吴焕兵,赵邦娥,张登文,等.开胸术后慢性疼痛模型大鼠相应脊髓背角神经元KATP通道表达的变化[J].中华麻醉学杂志,2011,31(6):699-701.
[7] Czirjak G,Vuity D,Enyedi P.Phosphorylation-dependent binding of 14-3-3proteins controls TRESK regulation[J].J Biol Chem,2008,283(23):15672-15680.
[8] Czirjak G,Enyedi P.Targeting of calcineurin to an NFAT-like docking site is required for the calcium-dependent activation of the background K+channel,TRESK[J].J Biol Chem,2006,281(21):14677-14682.
[9] Tulleuda A,Cokic B,Callejo G,et al.TRESK channel contribution to nociceptive sensory neurons excitability:modulation by nerve injury[J].Mol Pain,2011,7:30.
[10] Kang D,Kim D.TREK-2(K2P10.1)and TRESK(K2P18.1)are major background K+channels in dorsal root ganglion neurons[J].Am J Physiol Cell Physiol,2006,291(1):C138-C146.
[11] Marsh B,Acosta C,Djouhri L,et al.Leak K+channel mRNAs in dorsal root ganglia:relation to inflammation and spontaneous pain behaviour[J].Mol Cell Neurosci,2012,49(3):375-386.
[12] 周俊,姚尚龙,杨承祥,等.神经病理性痛大鼠背根神经节TRESK mRNA 表达的变化[J].中华麻醉学杂志,2011,31(2):183-185.
