吡格列酮改善2型糖尿病大鼠脑内胰岛素抵抗以及阿尔茨海默病样tau蛋白磷酸化*
2013-12-23胡蜀红杨思思
姜 腾, 胡蜀红, 杨 雁, 杨思思
华中科技大学同济医学院附属同济医院内分泌科,武汉 430030
2型糖尿病(type 2diabetes,T2D)是最常见的内分泌代谢病,中国20岁以上成人糖尿病患病率已高达9.7%[1]。随着治疗水平的提高,T2D 患者带病生存时间延长,然而认知功能损害和痴呆成为新的并发症。阿尔茨海默病(Alzheimer’s disease,AD)是一种神经退行性疾病,占成人痴呆症的60%~80%[2]。流行病学资料显示,T2D 人群发生迟发型阿尔茨海默病的风险较非T2D 人群增加1.4~4.3倍[3-4]。因此,探讨T2D 患者AD 发病风险增高的原因和寻求药物治疗靶点具有重要意义。
AD 患者最典型的临床表现是记忆力进行性减退,海马组织中tau蛋白过度磷酸化形成的神经纤维缠结和淀粉样β蛋白(amyloidβ-protein,Aβ)聚集形成老年斑被认为是AD 的特征性病理改变[5]。大脑内胰岛素可改善记忆和认知功能,大脑胰岛素缺乏或敏感性下降可导致AD。研究证实,AD 病变与大脑胰岛素水平的异常以及胰岛素信号转导的变化密切相关[6]。大脑内的胰岛素主要来源于外周血液,在外周,胰岛素主要发挥促进合成、维持血糖浓度稳定的作用。在中枢神经系统,胰岛素主要作为一种神经调节剂,与胰岛素受体结合之后通过影响神经递质的释放和重摄取来调控突触可塑性及促进记忆、学习和认知功能[7]。非糖尿病AD 患者与正常人比较,外周胰岛素水平并无变化,但大脑胰岛素水平显著降低,反映AD 患者脑内存在明显的胰岛素摄取或分泌缺陷,大脑胰岛素大多为外周胰岛素通过血脑屏障进入[8]。在对大鼠脑室注射链脲佐菌素STZ后,大鼠会出现认知功能减弱,其原因在于胰岛素信号传导减弱[9]。而经对上述大鼠脑室注射胰岛素类似物后,大鼠认知功能得到相应恢复[10]。AD 小鼠腹腔注射链脲佐菌素(STZ)后(1型糖尿病模型)导致外周胰岛素缺乏,大脑内胰岛素水平进一步下降,检测发现小鼠大脑出现AD 样改变:Aβ沉积及tau蛋白过度磷酸化加重[11]。这些研究说明,大脑胰岛素缺乏与AD 样病变的形成密切相关。T2D时外周胰岛素水平增高,大脑胰岛素水平是否也如血浆中胰岛素水平一样升高,尚不明了。
噻唑烷二酮(thiazolidinedione,TZD)是迄今为止作用最强的选择性过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPARγ)激动剂,作为一种胰岛素增敏剂能改善外周胰岛素抵抗并降低血糖水平,被广泛应用于治疗T2D。研究发现TZD 类药物吡格列酮(Pioglitazone)能改善AD 患者认知功能[12],吡格列酮能否改善脑内胰岛素抵抗,减轻AD 样病变尚未见报道。
本研究以T2D 大鼠为研究对象,测定脑脊液和血浆胰岛素水平、大脑及外周组织(肝脏)胰岛素信号转导途径中PI3K/Akt/GSK-3β的活性来评估胰岛素抵抗程度。同时检测大脑海马磷酸化tau蛋白水平判断糖尿病大鼠脑AD 样病变的程度,分析糖尿病大鼠脑内胰岛素抵抗与AD 样病变的关系。此外,采用胰岛素增敏剂吡格列酮干预T2D 大鼠,观察上述指标的变化以探讨胰岛素增敏剂能否改善T2D 大鼠脑内胰岛素抵抗以及减少AD 样病变的发生。
1 材料与方法
1.1 T2D大鼠模型的制备
雄性SD 大鼠(华中科技大学同济医学院实验动物学部提供)21 只,体重150~180g,10~12 周龄,随机分为3 组,每组7 只,分别为正常对照组(CTL),2型糖尿病非干预组(T2D),2型糖尿病吡格列酮干预组(PIO)。T2D 组和PIO 组给予高脂高糖高蛋白饮食[热卡百分比为碳水化合物26.0%,蛋白质15.2%,脂肪(炼猪油)58.8%]3个月后,按照30~35 mg/kg剂量腹腔1次性注射链脲佐菌素(Streptozocin,STZ)(Sigma,粉剂溶于0.1 mol/L pH 4.3 柠檬酸钠缓冲液中),72h后尾静脉取血,血糖仪(强生稳豪)测血糖≥16.7mmol/L、尿糖持续阳性为造模成功。CTL 组给予普通饮食喂养,并按照上述方法尾静脉注射柠檬酸缓冲液。
1.2 吡格列酮干预
PIO 组用吡格列酮片(吡格列酮片由日本武田公司提供)按照每天20mg/kg灌胃4 周,T2D 组及CTL组同等剂量生理盐水灌胃4周,4周后断颈处死所有实验动物。实验过程中,大鼠单笼饲养于恒温(25℃)的清洁级动物房中,每天光照12h,天黑前投食,自由饮水。处死前各组大鼠数目:CTL组5只,T2D 组5只,PIO 组5只。
1.3 血糖测定
处死前由尾静脉采血,用血糖仪(强生稳豪)检测血糖水平。
1.4 血浆胰岛素测定
处死前心脏取血1mL,离心后取血浆,-20℃保存,放免法一次性检测。药盒购自北京中科院原子能科学研究所,测定值批内CV<2.5%,批间CV<3.5%。
1.5 胰岛素抵抗指标
胰岛素抵抗指标以稳态模型的胰岛素抵抗指数HOMA-IR=FINs(mU/L)×FPG(mmol/L)/22.5表示[13],FINs为(空腹胰岛素浓度),FPG 为(空腹血糖浓度)。
1.6 脑脊液胰岛素测定
参照Höistad等[14]的方法,运用20%的乌拉坦将大鼠麻醉以后,剪开头部皮肤,清理组织和肌肉,暴露小脑及延髓部,运用注射器针头在脑膜上开孔,向内插入细管,将细管末端低于头部,等待脑脊液自动流出,收集20~50μL用放免法检测脑脊液胰岛素水平。
1.7 Western blot检测
处死动物,取出一侧大脑海马组织、肝脏组织及肌肉组织。分别放入匀浆器内,加入蛋白质提取液,冰上匀浆。蛋白质提取液为40mmol/L Tris-HCl,pH 7.0,1%Triton X-100,0.2%SDS,1.0 mmol/L脱氧胆酸钠,1.0 mmol/L Na3VO4,50 mmol/L NaF,1.0 mmol/L PMSF,2.0 mg/L 的aprotinin、leupeptin、pepstatin,1.0 mmol/L EGTA,及1.0 mmol/L EDTA(以上试剂购自武汉凌飞科技公司)。于4℃离心机内12 000g离心10min,取上清即为蛋白质。取10μL 用Bradford法检测蛋白质浓度,余储存于-80℃冰箱备用。用前加2×样本缓冲液并混匀,于100℃变性5min。在垂直电泳槽内每孔内加入约10~30μg蛋白,10%SDS-PAGE电泳,结束后全湿转至NC 膜。摇床上5%BSA 封闭2h;杂交一抗(所有抗体如表1 所示)4℃过夜;PBST 洗膜3次,每次10min;杂交二抗(辣根酶标记的羊抗兔、羊抗鼠及兔抗羊IgG 购自PIERCE 试剂公司),室温摇床上1h;PBST 洗膜3次,每次10 min;ECL显色,最后用胶片感光。运用BandScanV 5.0软件对免疫反应条带进行定量分析。
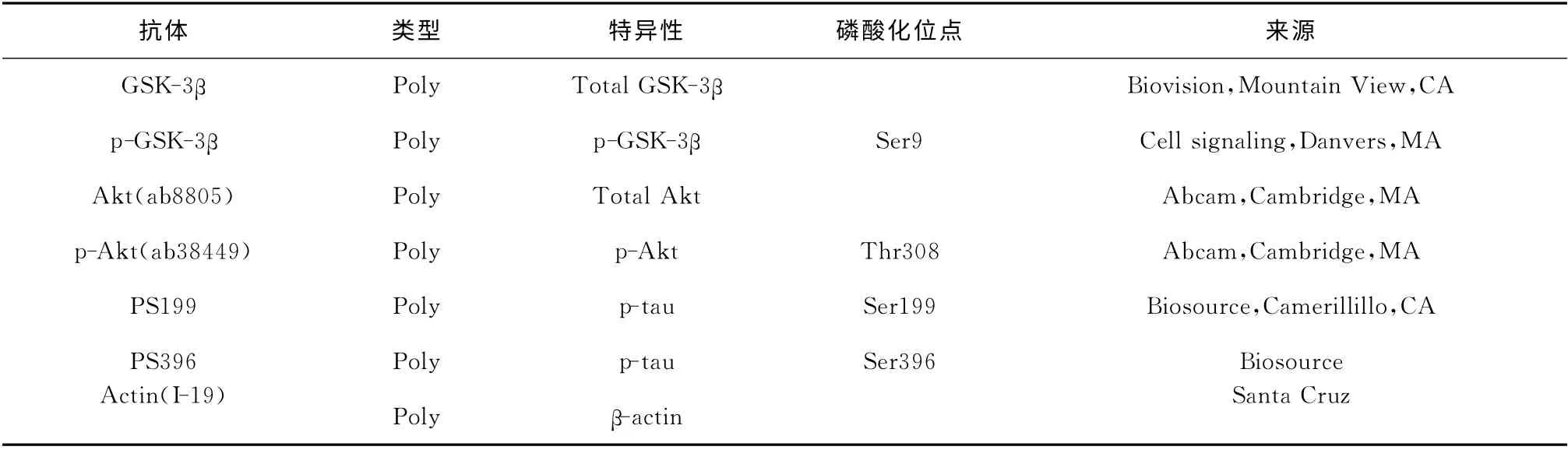
表1 本实验所用一抗Table 1 Primary antibodies employed in this study
1.8 统计学处理
资料用Graph Pad生化数据处理软件包Prism 5.0进行统计处理。计量资料以±s表示,各组均数间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠血糖、血胰岛素、外周胰岛素抵抗程度以及脑脊液胰岛素水平
T2D 组血糖水平及血胰岛素水平显著高于CTL组(P<0.01),但脑脊液胰岛素水平显著低于CTL组(P<0.05)。吡格列酮组(PIO 组)血糖及血胰岛素水平明显低于T2D 组(均P<0.01),与对照组相比无明显差别,而脑脊液胰岛素水平与T2D组相比并无明显改变,仍低于对照组。运用HOMA-IR公式评估的胰岛素抵抗程度结果显示,T2D 组外周组织胰岛素抵抗程度显著高于CTL组(P<0.01),PIO 组外周胰岛素抵抗程度显著低于T2D 组(P<0.01),但与对照组相比差异无统计学意义(表2)。
表2 研究大鼠实验室资料(±s,n=5)Table 2 The result of laboratory examination of rats(±s,n=5)

表2 研究大鼠实验室资料(±s,n=5)Table 2 The result of laboratory examination of rats(±s,n=5)
与对照组比较,*P<0.05**P<0.01;与2型糖尿病组比较,##P<0.01
组别处死前体重(kg)血糖浓度(mmol/L)血胰岛素浓度(mU/L)脑脊液胰岛素浓度(mU/L)胰岛素抵抗指数2型糖尿病组(T2D)436.80±11.82**21.50±7.13**27.54±2.32**1.18±0.78*28.80±7.01**对照组(CTL)314.40±4.45 6.54±1.35 9.78±1.37 2.82±0.24 2.76±0.34吡格列酮组(PIO)444.60±6.87**8.84±0.73##12.36±2.48##1.14±0.42 4.07±2.11##
2.2 周围组织胰岛素信号传导途径PI3K/Akt/GSK-3β活性
我们检测了周围组织中位于胰岛素信号传导途径中重要组成部分的PI3K/Akt/GSK-3β 活性,PI3K 活性通过其下游Akt活性来评估,Akt活性越高,表示PI3K 活性越高。而Akt活性通过磷酸化Akt与总Akt比值来反映,磷酸化Akt/总Akt比例越高,表示Akt以及PI3K 活性越高;GSK-3β的活性由其Ser9磷酸化水平与总GSK-3β的比值来评估,其比值越高,则GSK-3β活性越低。如图1所示,T2D 组与CTL组比较,肝细胞内总Akt以及总GSK-3β 水平无显著差异,但T2D 组Akt 在Thr308位点上的磷酸化水平及GSK-3β上Ser9的磷酸化水平均显著低于CTL组(均P<0.01),此结果表明T2D大鼠肝脏胰岛素信号传导途径中Akt活性下降,而下游的GSK-3β活性上升。PIO 组与T2D组比较,总Akt与总GSK-3β水平无显著差异,但Akt在Thr308位点上的磷酸化水平显著高于T2D组(P<0.01),GSK-3β上Ser9的磷酸化水平也显著高于T2D组(P<0.05)。表明与正常大鼠比较,T2D组大鼠肝脏胰岛素信号传导减弱,而经吡格列酮干预后T2D大鼠肝脏胰岛素信号传导增强。
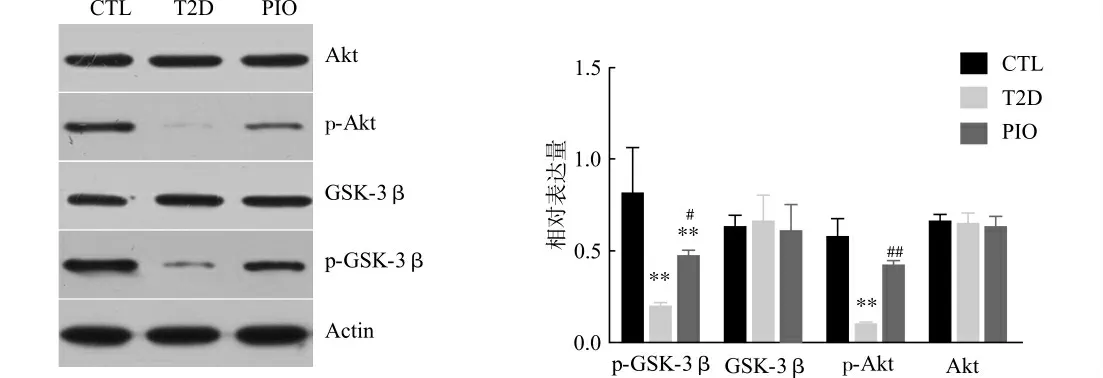
图1 免疫印迹法检测大鼠肝脏内胰岛素信号途径关键激酶活性Fig.1 Western blot analysis of related kinases in insulin signal transduction pathway in rat liver tissues
2.3 海马内胰岛素信号传导途径关键激酶活性以及tau蛋白磷酸化水平
如图2所示,T2D 组与CTL 组比较,海马内总Akt、总GSK-3β以及总tau蛋白水平无显著差异,但T2D 组Akt在Thr308位点上的磷酸化水平以及GSK-3β上Ser9的磷酸化水平均显著低于CTL组(均P<0.01),同时T2D 组tau蛋白在Ser199、Ser396位点上的磷酸化水平均显著高于CTL 组(均P<0.01)。此结果表明2型糖尿病大鼠大脑胰岛素信号传导途径中Akt 活性下降,而下游的GSK-3β活性上升,tau蛋白磷酸化程度增加。PIO组与T2D 组比较,总Akt与总GSK-3β水平无显著差异,但Akt在Thr308 位点上的磷酸化水平及GSK-3β上Ser9的磷酸化水平均显著高于T2D 组(均P<0.01),tau蛋白在Ser396和Ser199位点上的磷酸化水平均显著低于T2D 组(P<0.05或P<0.01)。表明与正常大鼠比较,T2D 组大鼠大脑胰岛素信号传导减弱,而应用吡格列酮干预后大脑胰岛素信号传导增强,从而使tau蛋白磷酸化程度降低,AD 样病变得以减轻。
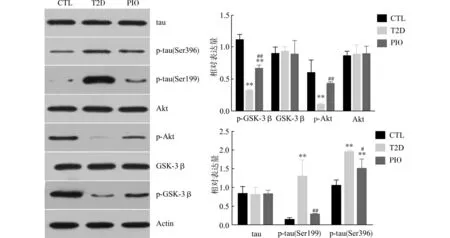
图2 免疫印迹法检测大鼠海马内胰岛素信号途径关键激酶活性及tau蛋白磷酸化水平Fig.2 Western blot analysis of related kinases in insulin signal transduction pathway and the level of phosphyorlated tau protein inrat hippocampus
3 讨论
研究证实:①T2D 大鼠大脑组织也呈AD 样病变;②海马细胞内糖原合成酶激酶-3β(GSK-3β)活性上升。GSK-3β是导致tau蛋白出现磷酸化的关键酶,过度磷酸化的tau蛋白易形成神经纤维缠结,促进AD 的发生[15-16]。GSK-3β在胰岛素信号传导途径中位于磷脂酰肌醇3 激酶(phosphatidylinositol 3kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)下游,其活性受PI3K/Akt抑制[17],由此推测T2D脑内胰岛素信号转导障碍,PI3K/Akt活性下降,即脑内胰岛素抵抗,导致GSK-3β 活性上升,使tau蛋白过度磷酸化。我们的研究中,在检测T2D大鼠大脑神经细胞内的胰岛素信号传导中各激酶的活性时发现,PI3K/Akt活性下降,而位于其下游的GSK-3β活性上升,外周组织肝脏中也发现类似结果,与上述研究结果一致。经吡格列酮干预后,T2D大鼠外周胰岛素抵抗程度显著降低,脑内tau蛋白磷酸化程度降低,但脑脊液胰岛素水平无明显改变,此结果说明T2D 大鼠大脑中不仅胰岛素水平下降,也存在胰岛素信号传导途径的异常,考虑为胰岛素抵抗,并由此导致tau蛋白过度磷酸化,加重脑AD样病变的发生。
前文已经提到,大脑胰岛素缺乏在AD 形成中起重要作用,但T2D 大鼠大脑胰岛素水平如何变化尚不清楚。研究发现,外周血液胰岛素水平持续增高可使运送到大脑的胰岛素减少,产生大脑的胰岛素抵抗状态,从而导致脑脊液中胰岛素水平下降[18]。本实验结果显示,T2D 大鼠外周血胰岛素水平增高,大脑胰岛素水平与对照组相比显著下降,说明T2D 大鼠外周血胰岛素通过血脑屏障少于对照组,与上述研究结果一致。噻唑烷二酮类(TZD)作为改善胰岛素抵抗的药物已在临床上得到广泛使用。已有研究发现TZD 类药物吡格列酮能改善糖尿病合并AD 患者认知功能[12]。我们用吡格列酮对T2D 大鼠进行干预后吡格列酮组大鼠大脑胰岛素水平与T2D 组比较并无明显改变,但大脑胰岛素信号途径上调,tau蛋白磷酸化降低。表明吡格列酮是通过改善脑内胰岛素抵抗而不是提高脑内胰岛素浓度减轻tau蛋白过度磷酸化的。
综上所述,我们的结果说明T2D 大鼠中枢神经系统和外周组织一样存在胰岛素抵抗并由此导致tau蛋白过度磷酸化,加重脑AD 病样改变,同时外周胰岛素通过血脑屏障减少。应用胰岛素增敏剂降低了脑内胰岛素抵抗并减轻脑tau 蛋白过度磷酸化,而脑胰岛素浓度并未升高,因此T2D 大鼠大脑内存在的胰岛素抵抗可能是导致AD 发病的重要原因,而脑脊液胰岛素浓度的变化在T2D 大鼠AD 样病变中的作用可能并不重要。
[1] Yang W,Dou K F,Song W J,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(25):2425-2426.
[2] Alzheimer’s Association.2012Alzheimer’s disease facts and figures[J].Alzheimers Dement,2012,8(2):131-168.
[3] Arvanitakis Z,Wilson R S,Bienias J L,et al.Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function[J].Arch Neurol,2004,61(5):661-666.
[4] Xu W L,Qiu C X,Wahlin A,et al.Diabetes mellitus and risk of dementia in the Kungsholmen project:a 6-year follow-up study[J].Neurology,2004,63(7):1181-1186.
[5] Perrin R J,Fagan A M,Holtzman D M.Multimodal techniques for diagnosis and prognosis of Alzheimer’s disease[J].Nature,2009,461(7266):916-922.
[6] Plaschke K,Kopitz J,Siegelin M,et al.Insulin-resistant brain state after intracerebroventricular steptozocin injection exacerbates Alzheimer-like changes in Tg2576 AbetaPP-overexpressing mice[J].Alzheimers Dis,2010,19(2):691-704.
[7] Belgardt B F,Brüning J C.CNS leptin and insulin action in the control of energy homeostasis[J].Ann N Y Acad Sci,2010,1212:97-113.
[8] Laron Z.Insulin and the brain[J].Arch Physiol Biochem,2009,115(2):112-116.
[9] Shingo A S,Kanabayashi T,Murase T,et al.Cognitive decline in STZ-3Vrats is largely due to dysfunctional insulin signalling through the dentate gyrus[J].Behav Brain Res,2012,229(2):378-383.
[10] Shingo A S,Kanabayashi T,Kito S,et al.Intracerebroventricular administration of an insulin analogue recovers STZ-induced cognitive decline in rats[J].Behav Brain Res,2013,241:105-111.
[11] Wang X,Zheng W,Xie J W,et al.Insulin deficiency exacerbates cerebral amyloidosis and behavioral deficits in an Alzheimer transgenic mouse model[J].Mol Neurodegener,2010,5:46.
[12] Sato T,Hanyu H,Hirao K,et al.Efficacy of PPAR-gamma agonist pioglitazone in mild Alzheimer disease[J].Neurobiol Aging,2011,32(9):1626-1633.
[13] Matthews D R,Hosker J P,Rudenski A S,et al.Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419
[14] Höistad M,Samskog J,Jacobsen K X,et al.Detection of betaendorphin in the cerebrospinal fluid after intrastriatal microinjection into the rat brain[J].Brian Res,2005,1041(2):167-180.
[15] Leavens K F,Birnbaum M J.Insulin signaling to hepatic lipid metabolism in health and disease[J].Crit Rev Biochem Mol Biol,2011,46(2):200-215.
[16] Qian W,Shi J,Yin X,et al.PP2Aregulates tau phosphorylation directly and also indirectly via activating GSK-3beta[J].J Alzheimers Dis,2010,19(4):1221-1229.
[17] Tamboli I Y,Barth E,Christian L,et al.Statins promote the degradation of extracellular amyloid{beta}-peptide by microglia via stimulation of exosome-associated insulin-degrading enzyme(IDE)secretion[J].J Biol Chem,2010,285(48):37405-37414.
[18] Steen E,Terry B M,Rivera E J,et al.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer’s disease—is this type 3diabetes?[J].J Alzheimers Dis,2005,7(1):63-80.
