HCN通道对大鼠脊髓背角神经元P2X受体功能的调节作用
2023-06-30杨舒蕾雷晓露刘晓红
杨舒蕾,雷晓露,刘晓红
(1.河南科技职业大学 生理学教研室,河南 周口 466000;2.遵义医科大学 生理学教研室,贵州 遵义 563099)
神经病理性疼痛涉及神经元正常电活动的改变,其主要的电生理学特点是神经元放电异常增加,超极化激活环核苷酸门控阳离子(hyperpolarization-activated cyclic nucleotide-gated channels,HCN)通道属孔隙环离子通道超家族成员,在哺乳动物中,HCN通道家族包括4个成员(HCN1、2、3、4),激活时产生的内向Ih电流导致细胞膜去极化,兴奋性增高。近年研究表明HCN通道与神经病理性疼痛的发生密切相关,HCN通道广泛分布于伤害性感觉传导通路,其表达和功能的变化可促进病理疼痛的产生[1]。脊髓是痛觉信号调制的关键部位,研究发现HCN通道表达于脊髓背角, HCN1和HCN2存在于初级传入神经中枢端[2-3];HCN4选择性表达于背角抑制性中间神经元,但在脊髓背角中未检测到HCN3的表达[4]。最近,Hu等[5]进行大鼠脊髓薄片全细胞膜片钳记录时发现,58%的脊髓胶状质抑制性中间神经元可记录到Ih电流。然而,HCN通道是如何影响脊髓背角神经元兴奋性并参与病理痛的调节,目前相关研究证据尚不充分。
细胞外ATP是一种重要的疼痛信号物质,其受体分为离子通道型P2X受体和G蛋白藕联型P2Y受体。其中,P2X(P2X1-7)受体是一种非选择性阳离子通道,激活时允许Na+、K+和Ca2+通过,其中对Ca2+的通透性最大。P2X受体广泛分布于各级感觉神经元,与伤害性信息的传递和整合密切相关[6]。形态学及分子生物学实验表明,多种P2X受体表达于脊髓背角,其中P2X1和P2X3主要分布于初级传入神经中枢端;P2X4和P2X7选择性表达于小胶质细胞;而P2X2、P2X5和P2X6表达于脊髓背角神经元[7-8]。脊髓背角神经元P2X受体的功能是否受到HCN通道影响尚不清楚。本实验通过观察HCN通道拮抗剂ZD7288对培养的脊髓背角神经元P2X受体激活诱发的[Ca2+]i的影响,以探讨HCN通道对P2X受体功能的调节作用。
1 材料与方法
1.1 实验动物 实验研究动物SD成年健康大鼠所生的1~3 d乳鼠由重庆第三军医大学实验动物中心提供[许可证号SCXK(渝) 2007-0005],动物实验伦理审批编号为ZMU21-2210-008,大鼠在合适的温度、湿度环境(干燥通风、自由饮食、昼夜光线变换)中饲养。
1.2 试剂与仪器 ATP、PPADS、ZD7288、8-Br-cAMP均购自美国Sigma;EDTA购自成都科龙化工试剂厂;钙离子荧光探针Fluo-4/AM和F-127购自日本Dojindo;激光共聚焦显微镜(TCS SP2)为德国Leica产品。
1.3 脊髓背角神经元培养 1~3 d 乳鼠乙醚麻醉,断头,在解剖显微镜下取出脊髓背角组织,剪碎,加0.125%胰蛋白酶,置于37 ℃含5% CO2细胞培养箱中孵育30 min;用含胎牛血清的DMEM/F12培养基终止消化,吹打成细胞混悬液,离心5 min(1 000 r/min),弃去上清液,加入适量Neurobasal/B27培养基重悬细胞,接种于激光共聚焦培养皿内的盖玻片(玻片预先包被多聚赖氨酸和层粘连蛋白),放入细胞培养箱,3 h后添加2 mL Neurobasal/B27培养基。接种1 d后加入阿糖胞苷(5 μmol/L,24 h)抑制胶质细胞增殖,2~3 d用于实验。
1.4 分组及给药 培养的脊髓背角神经元分为7组:①对照组;②ATP组(100 μmol/L);③无钙液+ATP组(无钙液预先孵育20 min,再加入ATP);④PPADS+ATP组(50 μmol/L PPADS预先孵育10 min,再加入ATP);⑤ ZD7288+ATP组(不同浓度1~1 000 μmol/L ZD7288预先孵育10 min,再加ATP);⑥ 8-Br-cAMP+ATP组(100 μmol/L 8-Br-cAMP孵育10 min后加ATP);⑦ ZD7288+8-Br-cAMP+ATP组(先加100 μmol/L ZD7288孵育10 min,再加8-Br-cAMP孵育10 min,最后加ATP)。
1.5 背角神经元[Ca2+]i测定 参照孙涛等[9]的方法检测培养的脊髓神经元[Ca2+]i,大致方法如下:培养细胞用DMEM/F12培养基漂洗3次,加入Fluo-4/AM (2 μmol/L)荧光指示剂与F127的混合溶液,37 ℃细胞培养箱内避光孵育30 min;漂洗后以少许DMEM/F12培养基覆盖细胞,置于Leica激光共聚焦显微镜的载物台上,通过Hamamatsu Ca2+检测系统进行扫描检测:扫描频率2 s/图,检测5 min。用Ca2+相对荧光强度=F1/F0 (F0,静息状态时Ca2+荧光强度;F1,加药后Ca2+荧光强度)反映脊髓背角神经元[Ca2+]i的变化。
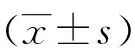
2 结果
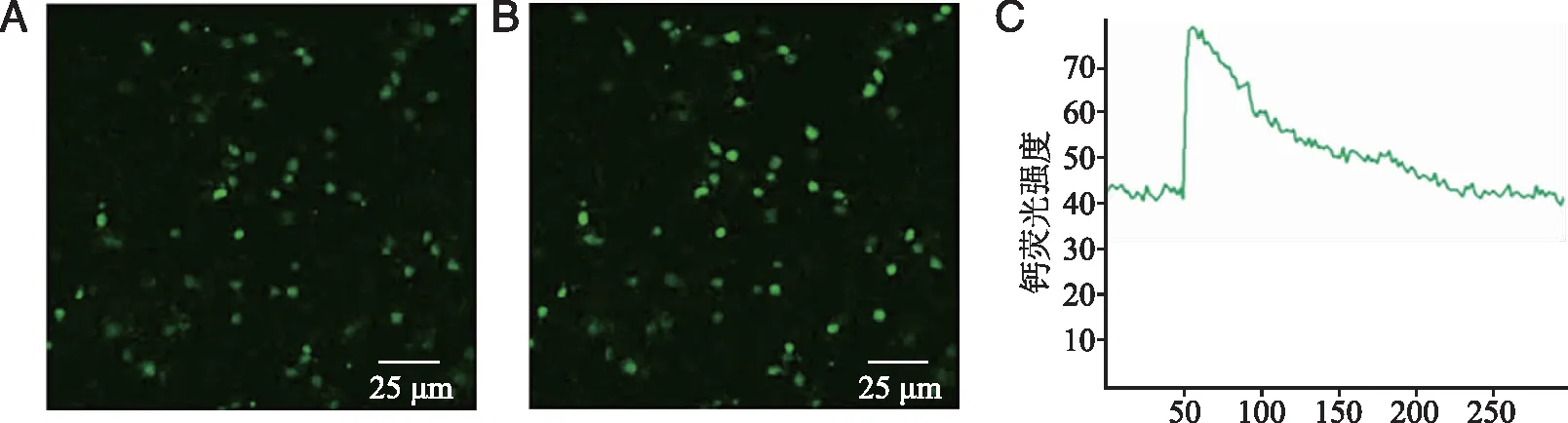
2.1 ATP诱发脊髓背角神经元[Ca2+]i快速升高 100 μmol/L ATP可迅速升高脊髓背角神经元[Ca2+]i,然后缓慢下降恢复(P<0.05,图1、2)。为了验证ATP引起[Ca2+]i升高效应中Ca2+的来源,加入了乙二胺四乙酸螯合孵育液中Ca2+后,ATP不再引起脊髓背角神经元[Ca2+]i升高,说明乙二胺四乙酸螯合孵育液中的Ca2+可完全阻断ATP增高脊髓背角神经元[Ca2+]i,表明ATP诱导的[Ca2+]i增加是由细胞外钙内流引起的,无细胞内钙释放参与(P<0.05,图2、3);此外,为了清楚ATP所致的[Ca2+]i升高是通过P2X途径还是P2Y途径,采用P2X受体拮抗剂PPADS(P2X1、2、3、5、7特异性拮抗剂,50 μmol/L)预孵育10 min后,可基本阻断ATP导致脊髓背角神经元[Ca2+]i升高的效应(P<0.05,图2、4),说明ATP诱发的脊髓背角神经元[Ca2+]i增加是由P2X受体介导的。
A:加100 μmol/L ATP前脊髓背角神经元的基础钙荧光强度;B:加100 μmol/L ATP后脊髓背角神经元的钙荧光强度明显增强;C:加100 μmol/L ATP后脊髓背角神经元的钙荧光强度曲线变化。图1 ATP升高脊髓背角神经元[Ca2+]i
*:与对照组相比, P<0.05;#:与ATP组相比,P<0.05;n=8。 图2 ATP经P2X受体引起脊髓背角神经元[Ca2+]i升高

A:孵育液为无钙液时加100 μmol/L ATP前脊髓背角神经元的基础荧光强度;B:孵育液为无钙液预先孵育20 min后加100 μmol/L ATP后脊髓背角神经元的钙荧光强度无明显变化;C.孵育液为无钙液时加100 μmol/L ATP后脊髓背角神经元的钙荧光强度变化曲线。图3 孵育液为无钙液对ATP所致脊髓背角神经元[Ca2+]i升高的影响

A:PPADS(50 μmol/L)预先孵育10 min后加100 μmol/L ATP前脊髓背角神经元的基础荧光强度;B:PPADS(50 μmol/L)预先孵育10 min后加100 μmol/L ATP后脊髓背角神经元的基础荧光强度;C:PPADS(50 μmol/L)预先孵育10 min后加100 μmol/L ATP后脊髓背角神经元的钙荧光强度变化曲线。图4 P2X受体拮抗剂PPADS对ATP所致的脊髓背角神经元[Ca2+]i升高的影响
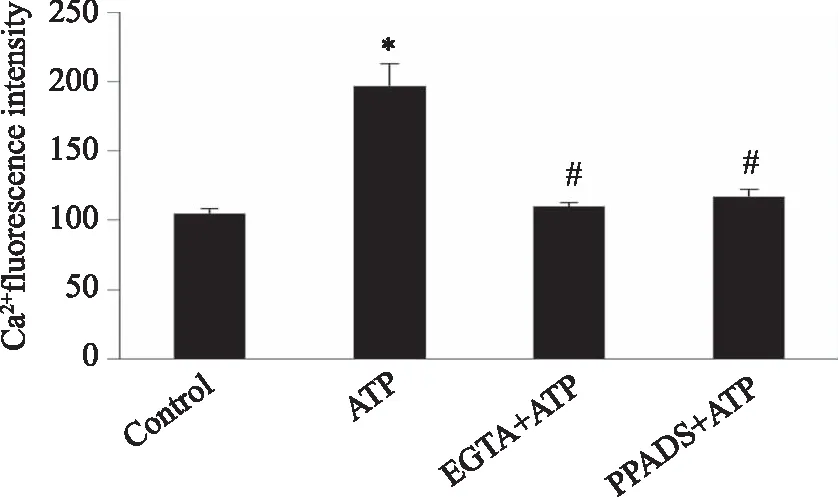
2.2 HCN通道对脊髓背角神经元ATP所致的[Ca2+]i升高的调节作用 1~1 000 μmol/L ZD7288对静息状态下脊髓背角神经元[Ca2+]i无影响,但ZD7288(100 μL/L)预孵育10 min可显著抑制ATP(100 μmol/L)诱导的神经元[Ca2+]i升高。ZD7288浓度由10 μmol/L增加至100 μmol/L,1 000 μmol/L,其对ATP所致[Ca2+]i升高的抑制作用越强,呈剂量依赖性(P<0.05,图5、6)。
A:加入100 μmol/LATP前后脊髓背角神经元的钙荧光强度;B~E:不同浓度ZD7288(1~1 000 μmol/L)预先孵育10 min,再加ATP前后脊髓背角神经元的钙荧光强度。 图5 不同浓度ZD7288对ATP导致脊髓背角神经元[Ca2+]i升高的影响
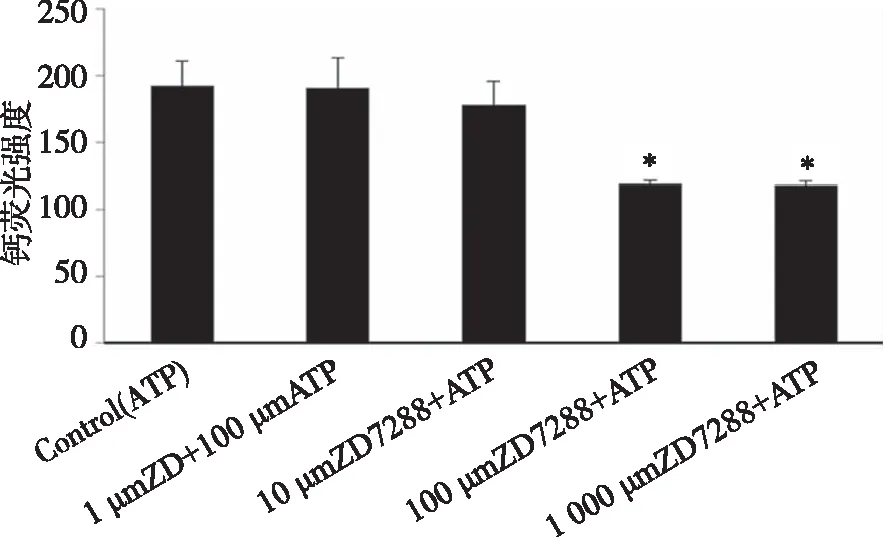
*:与ATP组相比,P<0.05;n=8。图6 ZD7288抑制ATP所致的脊髓背角神经元[Ca2+]i升高呈剂量依赖性
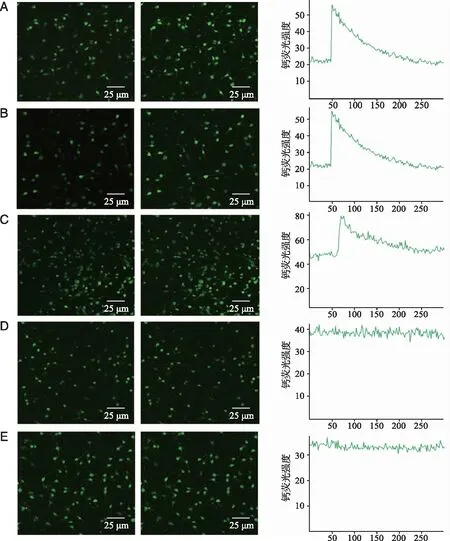
2.3 HCN通道拮抗剂ZD7288抑制8-Br-cAMP增强ATP所致的脊髓背角神经元[Ca2+]i升高的效应 8-Br-cAMP是可透过细胞膜的cAMP类似物,8-Br-cAMP(100 μmol/L)能显著增强ATP对脊髓背角神经元[Ca2+]i的作用;ZD7288预孵育10 min可显著抑制8-Br-cAMP对ATP增强神经元[Ca2+]i的作用(P<0.05,图7、8)。
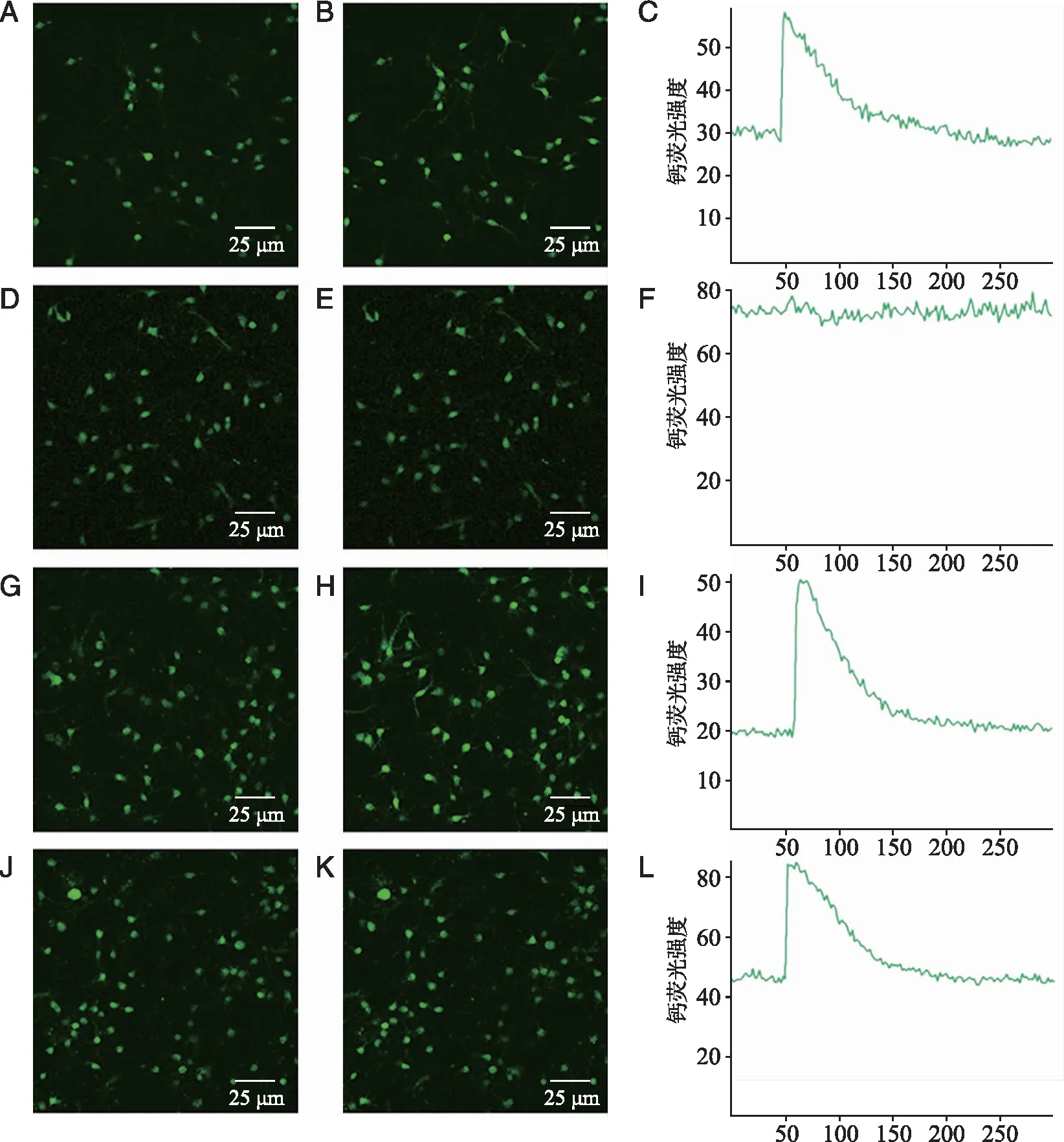
A~C:加入100 μmol/LATP前后脊髓背角神经元的钙荧光强度;D~F:100 μmol/L ZD7288预先孵育10 min,再加100 μmol/LATP前后脊髓背角神经元的钙荧光强度; G~I:100 μmol/L 8-Br-cAMP孵育10 min后加100 μmol/L ATPATP前后脊髓背角神经元的钙荧光强度;J~L:先加100 μmol/L ZD7288孵育10 min,再加8-Br-cAMP孵育10 min,最后加ATP前后脊髓背角神经元的钙荧光强度。图7 ZD7288抑制8-Br-cAMP增强ATP升高脊髓背角神经元[Ca2+]i的效应

*:与ATP组相比,P<0.05;#:与8-Br-cAMP +ATP组相比,P<0.05;n=8。图8 ZD7288抑制8-Br-cAMP增强ATP升高脊髓背角神经元[Ca2+]i的效应
3 讨论
大量研究证实,ATP及其P2受体与病理性疼痛的发生发展密不可分,ATP在组织损伤时被释放,与P2X和(或)P2Y受体结合可升高感觉神经元[Ca2+]i,促进兴奋性神经递质的释放,导致痛敏的产生[10]。本实验研究发现,ATP可以增高脊髓背角神经元[Ca2+]i,P2X受体拮抗剂PPADS可阻断此效应,说明ATP所致的[Ca2+]i升高可能是由P2X受体介导。另外,胞外Ca2+与EGTA螯合可以完全阻断ATP对神经元[Ca2+]i的作用,也从侧面印证了ATP激活P2X受体导致细胞外Ca2+内流,导致神经元[Ca2+]i升高。以往的研究显示,表达于脊髓背角神经元的P2X受体主要有P2X2、P2X5、P2X6,其中P2X2最丰富[7,11]。本实验PPADS(P2X1、2、 3、 5、7特异性拮抗剂)基本上能阻断ATP引起的脊髓背角神经元[Ca2+]i升高,也印证了前人的结果。以往研究显示,P2X受体的功能受到PKA调节。Chow等[12]报道P2X2受体的细胞内羧基末端含有几个cAMP依赖的PKA共识磷酸化位点;在培养的背根节及脊髓背角神经元,P2X受体的功能受到大麻素CB1受体活化所致的cAMP-PKA活性降低而抑制。本实验膜透性cAMP类似物8-Br-cAMP可显著增强P2X受体激活导致的[Ca2+]i升高,表明cAMP-PKA信号通路活化可以促进脊髓背角神经元P2X受体开放,致使[Ca2+]i升高。
以往对脊髓背角HCN通道参与病理性疼痛的研究主要集中于突触前。Takasu等[13]发现,鞘内注射ZD7288可显著抑制福尔马林引起的炎性痛和外周神经损伤引起的神经痛;进一步的脊髓薄片电生理实验中观察到,突触前HCN2通道促进了初级传入纤维中枢端释放谷氨酸,导致背角感觉神经元兴奋性增加。存在于脊髓背角神经元的HCN通道主要为HCN4[4],近年研究发现,局麻药利多卡因可显著抑制脊髓胶状质神经元Ih幅度[5],治疗神经痛的药物加巴喷丁也可抑制胶状质抑制性神经元HCN4介导的Ih电流[14],推测脊髓背角HCN4通道在病理性疼痛的产生过程中可能发挥重要作用并有望成为疼痛治疗新靶点。本研究ZD7288可显著抑制ATP经P2X受体引起的[Ca2+]i升高,表明脊髓背角神经元HCN4通道的活化可促进嘌呤能P2X受体开放,导致背角感觉神经元兴奋性水平增高。此外,ZD7288可抑制8-Br-cAMP增强ATP升高脊髓背角神经元[Ca2+]i的效应,由此推测HCN通道可能是通过增强背角神经元cAMP-PKA的活性而促进P2X受体的开放。先前的研究也表明,HCN通道功能的改变可以调节cAMP-PKA的活性。中脑导水管周围灰质腹外侧区(vlPAG)局部注射ZD7288可降低慢性坐骨神经损伤大鼠vlPAG 区cAMP含量及神经元动作电位发放频率的增加[15];ZD7288可显著抑制8-Br-cAMP增强谷氨酸诱发海马神经元[Ca2+]i升高的效应[16];鞘内给予ZD7288可降低糖尿病周围神经痛大鼠脊髓背角cAMP含量的增加[17]。
HCN通道如何影响cAMP-PKA活性?目前的研究显示,HCN通道的开放可升高细胞[Ca2+]i,进一步激活Ca2+钙调蛋白依赖性腺苷酸环化酶,导致胞内cAMP浓度升高,PKA活化[18]。关于HCN通道激活导致细胞[Ca2+]i升高,从现有的文献来看,可能主要是因为:HCN通道开放产生的内向电流引起细胞膜去极化,导致膜电压依赖钙通道打开,细胞外Ca2+流入,[Ca2+]i增加[2,17]。比如,Felix等[19]发现HCN通道拮抗剂ZD7288可阻断小鼠精原细胞以及HEK-293细胞的T型电压依赖性钙通道电流。此外,近年有研究认为HCN通道开放后,除了Na+内流、K+外流,对Ca2+也具通透性,存在Ca2+内流。在脊髓背角神经元,HCN通道开放引起的去极化是否激活电压依赖性钙通道,有待于进一步证实。
由此可见,病理性疼痛时脊髓背角感觉神经元HCN通道表达增加可能引起胞内cAMP-PKA信号通路的激活,进而促进嘌呤能P2X受体的激活,导致脊髓背角感觉神经元兴奋性增加,促进了病理性疼痛的发生与发展。
综上所述,本研究结果显示HCN通道可通过改变cAMP-PKA活性而调节脊髓背角神经元P2X受体的功能。在炎性损伤或神经损伤时,背角神经元 HCN通道激活,通过增强胞内cAMP-PKA活性而促进嘌呤能P2X受体活化,导致脊髓背角感觉神经元兴奋性增加,这可能是HCN通道参与脊髓水平疼痛调节的重要机制。
