白癜风皮损组织中黑素细胞谱系特异性标记基因检测
2013-12-04徐万纹史赢王雄范智峰雷铁池
徐万纹 ,史赢 ,王雄 ,范智峰 ,雷铁池
(1.湖北省武汉市第三医院,武汉430060;2.武汉大学人民医院,武汉430060)
白癜风是一种常见的后天色素脱失性皮肤病[1-2]。虽然该疾病不会导致受累皮肤出现明显的器质性功能障碍,但可对患者的身心健康造成严重影响,甚至阻碍患者的社会交往与择业就业[2]。白癜风的发病机制至今仍不完全清楚,临床上治疗困难。由于毛囊隆突区细胞被认为存在免疫赦免(immune privilege)[3],隆突区储存的黑素干细胞(melanocyte precusor)在疾病发生中可能免遭破坏。这样如何诱导有毛皮肤的白斑皮损出现毛囊复色(perifollicular repigmentation)是治疗成功的关键[4-5]。有研究显示白癜风患者对各种疗法的无效率可高达50%[6]。推测原因可能关系到患者在接受治疗前,临床医师无法评估皮损处的毛囊隆突区是否还存在可被诱导成熟的黑素干细胞。本研究用针尖皮肤切削术结合RT-PCR技术检测白癜风皮损组织中黑素细胞谱系标记基因表达,旨在建立一种预测白癜风皮损可能出现毛囊复色的准确微创方法。
1 资料与方法
1.1 临床资料 该研究获得武汉大学人民医院伦理委员会的批准。选取4例健康志愿者和6例就诊于武汉大学人民医院皮肤科的皮损处于静止期白癜风患者,所有受试者均签署医疗知情同意书。
1.2 方法
1.2.1 针尖皮肤切削术(needle biopsy)取材方法建立 患处皮肤常规活力碘液消毒后,75%医用乙醇脱碘,铺手术洞巾,暴露皮损区域及部分周围正常皮肤,对白斑的中心、近边缘和周边“正常皮肤”处皮肤活检。具体方式:用1 mL卡介苗注射器吸取2%利多卡因溶液0.5 mL,在取标本处皮下缓慢注射形成皮丘。针尖将皮丘轻轻挑起,手术刀平行皮肤表面切除皮丘顶端表皮(面积约为3~4 mm2),见点状出血,用无菌纱布压迫止血。直接将皮肤组织标本置入预装有50 μL冷Trizol试剂(美国Invitogene公司)的EP管,用分析天平称重。每次取标本前更换新的注射器、刀片和止血纱布,以避免基因污染。
1.2.2 RT-PCR检测 用微量电动组织匀浆器(美国Kontes公司)对EP管中的皮肤组织进行匀浆,参照Trizol试剂说明书提取标本组织总RNA。用M-MLV逆转录试剂盒(美国Invitrogen公司)合成第一链cDNA。用Dct和Tyr引物行PCR实验(引物序列见表1),内参照物为β-actin,以检测皮损标本是否有相应基因的表达。PCR反应条件94℃预变性2 min,94℃变性 30 s,55℃退火 30 s,72℃延伸 30 s,72℃终延伸2 min,其中变性到延伸过程循环35次。
2 结果
2.1 针尖皮肤切削术结合RT-PCR技术检测皮肤组织中黑素细胞谱系标记基因方法的建立 用针尖皮肤切削术获取3 mg和7 mg的组织标本并与负压吸疱法采集的表皮片进行比较,结果显示针头切削术获取的7 mg组织,经Trizol法抽提到的总RNA,能在正常皮肤组织中检测到多巴色素异构酶(Dct)、酪氨酸酶(Tyr)和管家基因β-肌动蛋白(ACTB)3种基因mRNA的表达。而在吸疱皮片中不能测到这些基因的表达。同时对10例针尖皮肤切削术后的局部伤口愈合进行了追踪随访,1个月后10例均正常愈合,未见瘢痕形成,见图1。
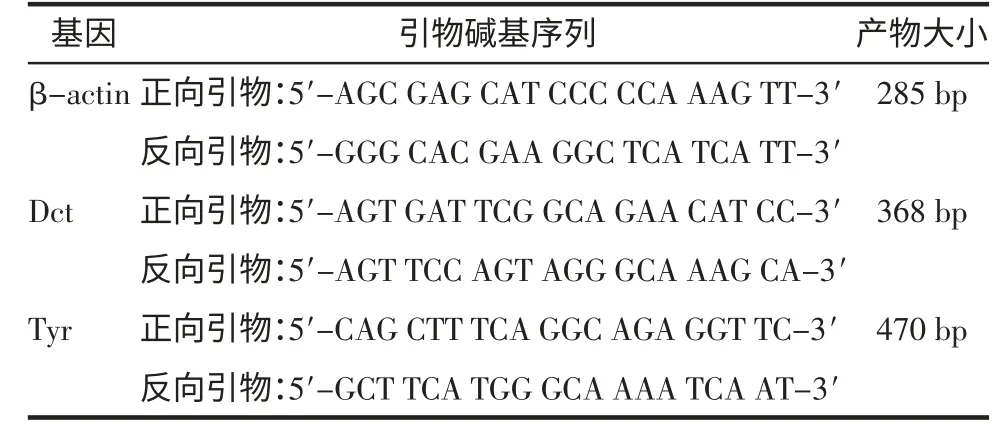
表1 黑素细胞相关基因引物序列

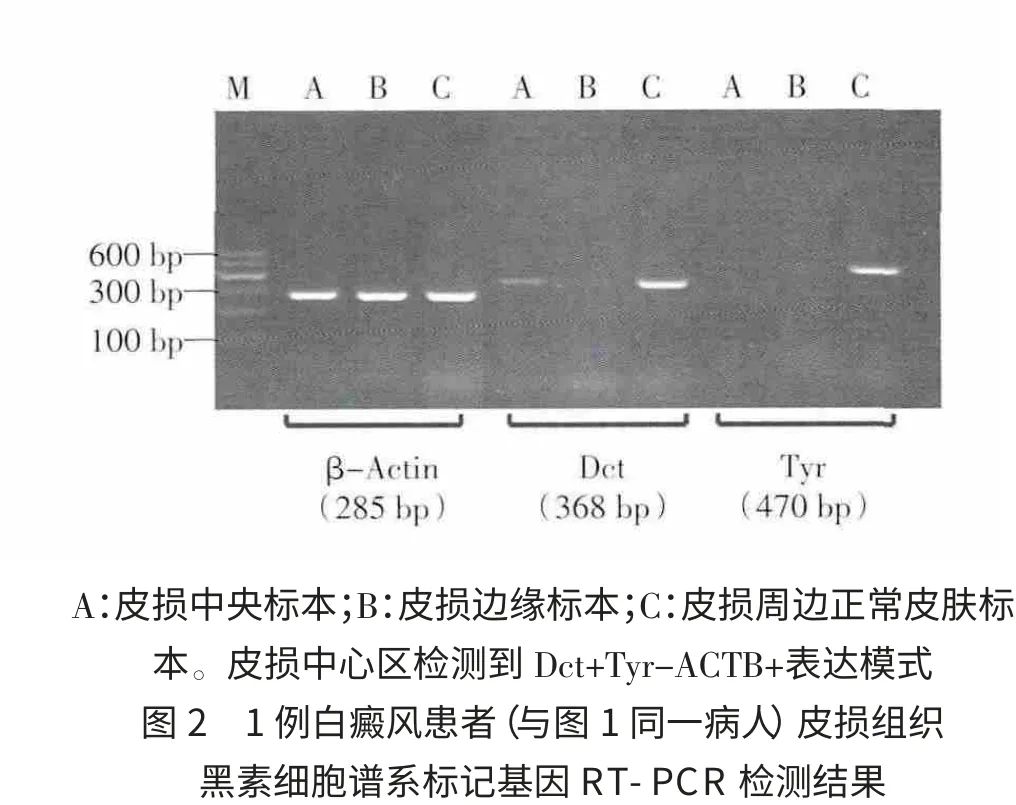
2.2 白癜风皮损组织中黑素细胞谱系标记基因的检测 本研究通过对6例白癜风患者18块组织标本进行黑素细胞谱系标记基因的检测,结果皮损中心区检测到3种模式,1例为:Dct+Tyr-ACTB+,见图 2;4例为:Dct-Tyr-ACTB+;1例为:Dct+Tyr+ACTB+。对1例检测结果为“Dct+Tyr-ACTB+”的患者随访,用希兰UV308准分子光疗饥(日本牛尾公司产)照射(200和300 mJ/cm2)2次,皮损即出现毛囊复色,见图3。
3 讨论

临床观察发现有着色毳毛(黑毛)的白癜风皮损较有脱色毳毛(白毛)的皮损更易诱导出复色,且受累皮损发生在无毛区域(肢端型)较在有毛区域(寻常型)对复色诱导治疗更显抵抗[7]。在白癜风疾病发生过程毛囊内受免疫赦免而保护的残存黑素细胞主要是一群无色素黑素细胞(amelanotic melanocyte),存在于毛囊的外毛根鞘,推测这群细胞活化可能参与白癜风毛囊复色[5,8]。最近的研究显示毛囊隆突区还可能存在有神经嵴衍生黑素干细胞 (neural crest-derived melanocyte stem cells,NSMSC),在体外用窄谱UVB可诱导NS-MSC分化为成熟黑素细胞,这一机制被认为也可能参与白癜风毛囊复色[9]。
Dct,小眼相关转录因子(MITF)和干细胞因子受体(c-Kit)等被认为是神经嵴干细胞转变为定向分化的成黑素细胞(melanoblast)的特异性标记蛋白[10-12]。Nishimura等[11-12]用Dct启动子控制半乳糖苷酶(Lac Z)报告基因表达构建Dct-Lac Z转基因小鼠,Dct-Lac Z阳性细胞被视为进入黑素细胞谱系分化的最早期成黑素细胞,结果发现Dct-Lac Z阳性细胞专一存在于被立毛肌附着的毛囊隆突区,不含黑素颗粒和酪氨酸酶,呈小卵圆形。本研究用针尖皮肤切削术结合逆转录聚合酶链式反应(RTPCR)技术检测白癜风皮损组织中是否存在黑素细胞谱系标记基因表达,结果发现在白癜风皮损中心区检测出3种基因表达模式,即Dct+Tyr-ACTB+,Dct-Tyr-ACTB+和 Dct+Tyr+ACTB+。“Dct+Tyr-ACTB+”提示皮肤组织中可能存在有无色素黑素细胞;“Dct-Tyr-ACTB+”提示组织中完全缺乏成熟或幼稚黑素细胞;“Dct+Tyr+ACTB+”提示组织中可能存在功能障碍的黑素细胞。对1例检测结果为“Dct+Tyr-ACTB+”的患者追踪随访,用UV308准分子光照射(200 mJ/cm2和 300 mJ/cm2)2 次,皮损即观察到出现毛囊复色。此外,我们还比较了针尖皮肤切削术与负压吸疱法皮肤活检对黑素细胞谱系标记基因检测的影响。结果显示负压吸疱法不能检测出上述标记基因,推测负压吸疱致表皮裂解位置可能不能达到毛囊隆突区深度[13]。
总之,用针尖皮肤切削术结合RT-PCR技术检测白癜风皮损组织中黑素细胞谱系标记基因表达,可作为预测白癜风皮损出现毛囊复色的一种准确微创方法。临床上需要进一步大样本测试与验证基因检出结果与诱导出现毛囊复色的关联性,为白癜风病人临床个体化治疗提供实验室参考依据。
[1]Halder RM,Chappell JL.Vitiligo update[J].Semin Cutan Med Surg,2009,28:86-92.
[2]Dolatshahi M,Ghazi P,Feizy V,et al.Life quality assessment among patients with vitiligo:comparison of married and single patients in Iran[J].Indian J Dermatol Venereol Leprol,2008,74:700.
[3]Meyer KC,Klatte JE,Dinh HV,et al.Evidence that the bulge region is a site of relative immune privilege in human hair follicles[J].Br J Dermatol,2008,159:1077-1085.
[4]Lei TC,Virador V,Yasumoto K,et al.Stimulation of melanoblast pigmentation by 8-methoxypsoralen:the involvement of microphthalmia-associated transcription factor,the protein kinase a signal pathway,and proteasome-mediated degradation[J].J Invest Dermatol,2002,119:1341-1349.
[5]Lei TC,Vieira WD,Hearing VJ.In vitro migration of melanoblasts requires matrix metalloproteinase-2:implications to vitiligo therapy by photochemotherapy[J].Pigment Cell Res,2002,15:426-432.
[6]Patel NS,Paghdal KV,Cohen GF.Advanced treatment modalities for vitiligo[J].Dermatol Surg,2012,38:381-391.
[7]Anbar TS,Abdel-Raouf H,Awad SS,et al.The hair follicle melanocytes in vitiligo in relation to disease duration[J].J Eur Acad Dermatol Venereol,2009,23:934-939.
[8]Zhu WY,Zhang RZ,Ma HJ,et al.Isolation and culture of amelanotic melanocytes from human hair follicles[J].Pigment Cell Res,2004,17:668-673.
[9]Dong D,Jiang M,Xu X,et al.The effects of NB-UVB on the hair follicle-derived neural crest stem cells differentiating into melanocyte lineage in vitro[J].J Dermatol Sci,2012,66:20-28.
[10]Sviderskaya EV,Easty DJ,Lawrence MA,et al.Functional neurons and melanocytes induced from immortal lines of postnatal crest-like stem cells[J].FASEB J,2009,23:3179-3192.
[11]Nishimura EK,Jordan SA,Oshima H,et al.Dominant role of the niche in melanocyte stem-cell fate determination[J].Nature,2002,416:854-860.
[12]Nishimura EK,Granter SR,Fisher DE.Mechanisms of hair graying:incomplete melanocyte stem cell maintenance in the niche[J].Science,2005,307:720-724.
[13]Gottschalk GM,Kidson SH.Molecular analysis of vitiligo lesions reveals sporadic melanocyte survival[J].Int J Dermatol,2007,46:268-272.
