CGRP修饰大鼠MSCs对血管平滑肌细胞增殖及表型转化的影响*
2013-12-01陈攀科龙仙萍刘志江王正龙王冬梅
陈攀科, 石 蓓, 龙仙萍, 刘志江, 王正龙, 王冬梅
(遵义医学院附属医院心内科,贵州遵义563003)
经皮冠状动脉介入治疗(percutaneous coronary interention,PCI)术后再狭窄仍是当今临床急待解决的重要问题之一[1],再狭窄的发生主要与内皮损伤和血管平滑肌细胞增殖等所致的新生内膜增生及血管重塑有关。本研究小组前期研究显示:间充质干细胞(mesenchymal stem cells,MSCs)移植能在一定程度上促进损伤动脉内皮的修复,从而减轻术后血管内狭窄的程度,但其对血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的作用相对较弱[2-3]。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)具有抑制VSMCs增殖的作用,对MSCs的增殖、迁移具有正向调节作用[4]。因此,本研究旨在研讨CGRP修饰的大鼠MSCs在体外对大鼠VSMCs的作用及其机制,为体内动物实验奠定基础,并为血管狭窄提供新的治疗思路。
材料和方法
1 材料
雄性SD大鼠购自重庆第三军医大学动物实验中心。慢病毒载体Lv-EGFP和Lv-CGRP由上海英为信公司提供;CGRP引物由上海英为信公司合成。所用的抗体均购自Abcam。ELISA试剂盒购自Biosciences。MTT购自Promega。细胞共培养板购自康宁生命科学(吴江)有限公司。
2 方法
2.1 MSCs的培养和鉴定 SD大鼠(100 g左右)脱臼处死后,无菌条件下获取骨髓,离心纯化并获取MSCs。MSCs在10%胎牛血清的完全培养基中培养,每2~3 d换液,弃悬浮细胞,细胞铺满瓶底约90%后传代,第2~4代细胞用于实验;取第3代细胞通过流式细胞术检测MSCs表面标记物(CD29、CD45和CD90)来鉴定,分别加入各自IgG作为对照。
2.2 VSMCs的培养和鉴定 SD大鼠(150 g左右)颈椎脱臼处死后,无菌条件下分离全段主动脉,去除内外膜,将其剪切成1 mm×1 mm×1 mm大小的组织块,均匀摆置于培养瓶底。组织块在10%胎牛血清的完全培养基中培养,4~5 d首次换液并去除组织块,细胞铺满瓶底传代,第3~6代细胞用于实验;取第5代细胞爬片后,FITC标记VSMCs所特有的α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)、DAPI标记细胞核后通过激光共聚焦显微镜进行鉴定。
2.3 MSCs基因修饰和转染 CGRP重组慢病毒转染的 MSCs设为 MSCs-CGRP,空载病毒转染设为MSCs-EGFP。通过荧光显微镜评估转染效率和最佳感染复数。
2.4 Real-time PCR检测 检测 MSCs中 CGRP的mRNA表达水平。CGRP重组慢病毒转染MSCs 48 h后收集细胞。按RNA抽提试剂盒操作说明,提取每一克隆的总RNA。通过逆转录酶行逆转录和按SYBR Green混合试剂盒说明书进行cDNA扩增。CGRP用特殊的低聚核苷酸引物,并大鼠18S rRNA作为内参照。引物序列 CGRP:5'-AGCCCCAGATCTAAGCGGTGTG-3'和 5'-TCCTTGGCCATATCCCTTTTCTTG-3';18S:5'-AAACGGCTACCACATCCAAG-3'和 5'-CCTCCAATGGATCCTCGTTA-3'。数据通过 Ct比较法进行分析、定量(2-ΔΔCt)。
2.5 ELISA检测CGRP水平 通过ELISA试剂盒检测被转染MSCs上清中CGRP水平。取第3代MSCs按5×105cells/well的密度接种于6孔板中,CGRP重组慢病毒转染MSCs 48 h后,弃培养基、PBS冲洗3次,重新加入培养基继续培养,48 h后收集上清,然后根据ELISA试剂盒说明书方法检测CGRP的浓度。
2.6 VSMCs增殖能力的检测 将慢病毒载体介导CGRP转染的MSCs与VSMCs进行共培养后,通过MTT法和台盼蓝染色来检测对VSMCs增殖和存活率的影响。慢病毒转染MSCs(MOI=300)后按1×105cells/well接种于 Transwell 6孔板上室中;取VSMCs按0.5~1×105cells接种于 Transwell 6孔板下室中,含0.1%FBS的DMEM培养同步化24 h;上、下室间为0.4μm的聚酯透明滤膜,上清由此可自由通过而细胞不能通过,CGRP修饰的MSCs分泌的CGRP与VSMCs共培养4 d,以单纯MSCs及空载病毒转染组为对照(MOI=300),每天各取1组按试剂说明书方法测吸光度(A)和存活率。
2.7 VSMCs迁移能力的检测 通过划痕实验检测VSMCs的迁移情况。VSMCs按(0.5~1)×105cells/well接种于Transwell 6孔板下室,培养过夜,划痕、PBS洗去脱落细胞;同时,将上述慢病毒转染的MSCs按1×105cells/well接种于Transwell 6孔板上室中,进行共培养3 d,每天观察其细胞迁移情况并拍照,采用图像分析软件通过测量48 h和24 h迁移距离之比来计算其迁移率。
2.8 蛋白印迹法(Western blotting) 通过Western blotting检测α-SMA和骨桥蛋白(osteoponin,OPN)的表达水平。收集上述共培养48 h VSMCs,提取蛋白并测定浓度(按BCA蛋白定量试剂说明书操作),配胶,制作电泳样品(所提蛋白与上样缓冲液1∶1混匀并煮沸5 min),上样,电泳,转至PVDF膜,5%脱脂奶粉封闭,分别按抗体说明书稀释后加入α-SMA和OPNⅠ抗,4℃孵育过夜,加入荧光标记的Ⅱ抗(1∶1 000稀释),室温孵育,PBS-T洗后,用奥德赛专用机器测灰度值,分别以标准浓度的β-actin作对照,实验重复3次。
3 统计学处理
采用SPSS 17.0统计软件分析,数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,两两比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
1 MSCs的形态及表型特征
原代细胞24~48 h换液后可见少量细胞贴壁生长,第7~8 d细胞铺满瓶底90%左右,形态呈长梭型,漩涡状排列,传代至第5代,细胞形态未见明显改变(图1A);流式细胞术检测第3代MSCs表型特征,结果显示 CD29达97.76%,CD90达98.53%,而CD45为12.34%,符合MSCs生物学特征(图1B)。
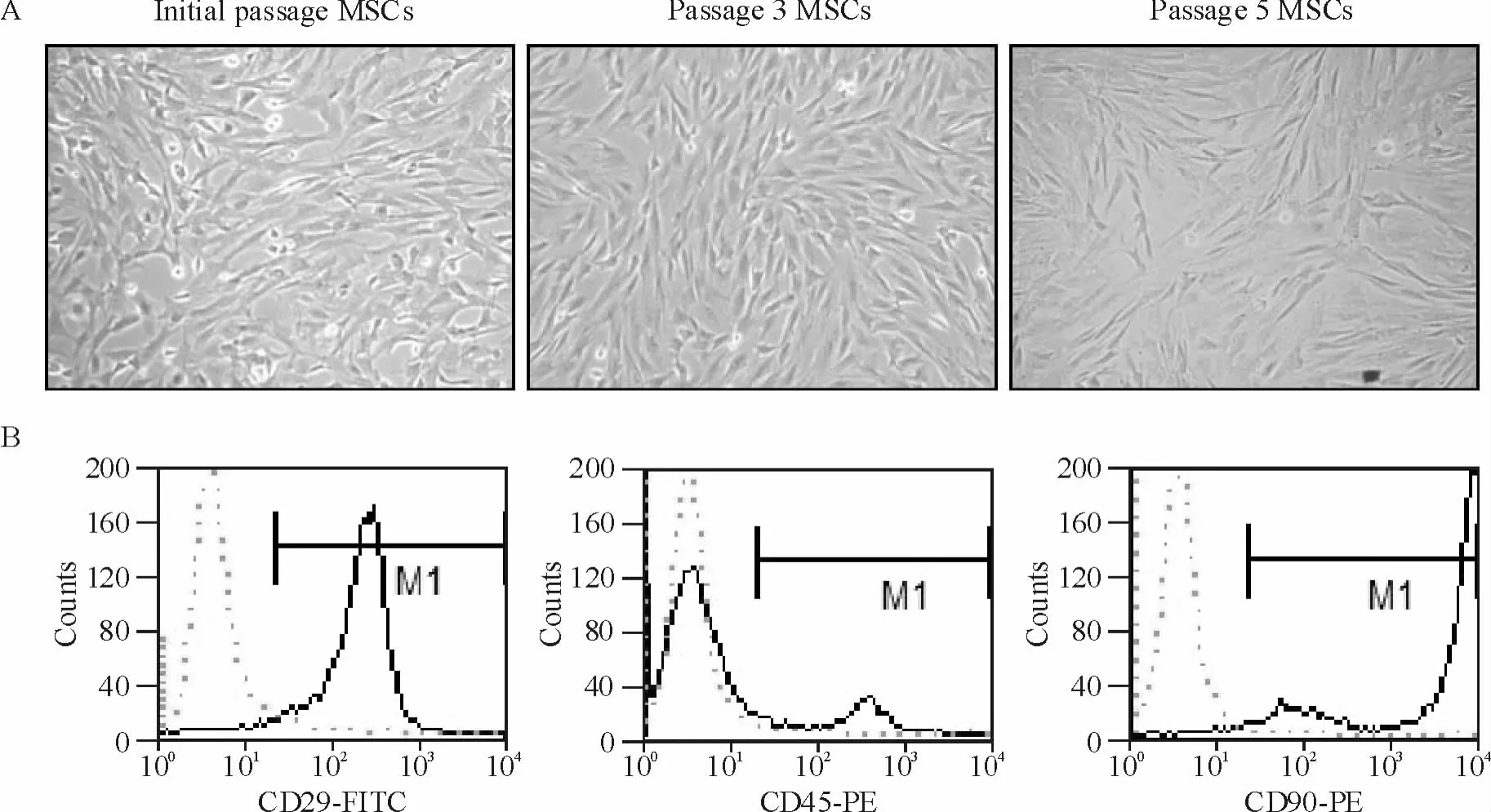
Figure 1.Morphological and phenotypic characterization of MSCs.A:the morphological change of MSCs.Passage cells were mostly spindle and uniformly distributed(×100).B:the3rd-passage MSCs detected by FCM highly expressed the surface marker molecules CD29(97.76%)and CD90(98.53%),and lowly expressed CD45(12.34%).图1 MSCs形态及表型特征
2 VSMCs的形态学及鉴定
原代培养至第4天,可见有细胞从组织块边缘游出,细胞形态可呈梭形、多角或不规则形,第10 d左右可铺满,呈现VSMCs典型“峰-谷”样生长,传代至第6代细胞形态稳定,未见明显改变(图2A)。
VSMCs的免疫荧光鉴定:激光共聚焦显微镜下观察细胞爬片,大部分细胞可见平滑肌细胞所特有,胞浆中大量绿色平行丝状α-SMA阳性染色,沿细胞纵轴分布的肌丝结构清晰(图2B)。
3 CGRP基因转染效率和CGRP修饰的MSCs中CGRP的表达
慢病毒LV-CGRP(MOI=30)转染 MSCs后,转染效率达85%以上(图3A)。Real-time PCR检测CGRP修饰MSCs后CGRP的mRNA表达水平,结果分别为:与MSCs组和MSCs-EGFP组相比较,MSCs-CGRP组的表达明显增加,约为前2组的9.85倍(图3B),差异有统计学意义(P<0.01)。ELISA检测它们的蛋白分泌情况,结果显示,MSCs组和MSCs-EGFP组培养48 h后的上清中几乎无CGRP表达,而MSCs-CGRP组培养48 h后的上清中有CGRP表达,浓度为25.30 ng/L(图3C),明显多于前2组(P<0.01)。
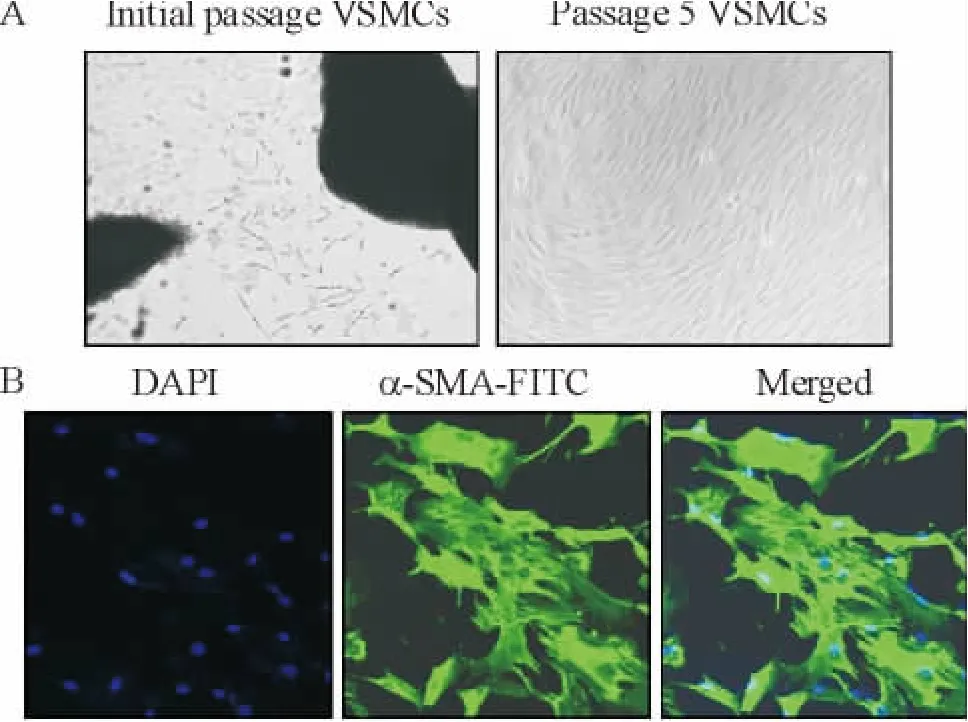
Figure 2.Morphological characterization and immunofluorescence verification of VSMCs(×100).A:the morphological change of VSMCs.Passage cells showed“valley peak”appearance under inverted microscope.B:expression ofα-SMA in the cytoplasm of VSMCs showed green with immunofluorescence staining.图2 VSMCs的形态及免疫荧光鉴定
4 CGRP修饰的MSCs在体外对血管平滑肌细胞增殖的影响
通过 MTT法检测 MSCs组、MSCs-EGFP组和MSCs-CGRP组中VSMCs的A值,连续观察4 d,在各个时点,与 MSCs组和 MSCs-EGFP组相比,MSCs-CGRP组中VSMCs的增殖能力降低(P<0.05);同时,每组细胞的细胞存活率通过台盼蓝检测均大于85%,由此可知,慢病毒介导的CGRP基因转染MSCs后对VSMCs的增殖有抑制作用,见图4。
5 CGRP修饰的MSCs在体外对血管平滑肌细胞迁移的影响
通过划痕实验观察共培养48 h与24 h之间VSMCs的划痕修复距离之比来判断其迁移能力,结果如图 5所示,与 MSCs组(51.60±0.80)% 和MSCs-EGFP组(49.56 ±0.93)% 相比,MSCs-CGRP组(21.80±0.65)%中VSMCs迁移明显降低(P<0.05),见图5。
6 CGRP修饰的MSCs在体外对VSMCs表型改变的影响
Western blotting检测各组的α-SMA(收缩表型)和OPN(合成分泌表型)蛋白的表达,结果显示,与MSCs组和MSCs-EGFP组相比,MSCs-CGRP组中α-SMA表达增加,OPN表达减少(均 P<0.05),见图6。
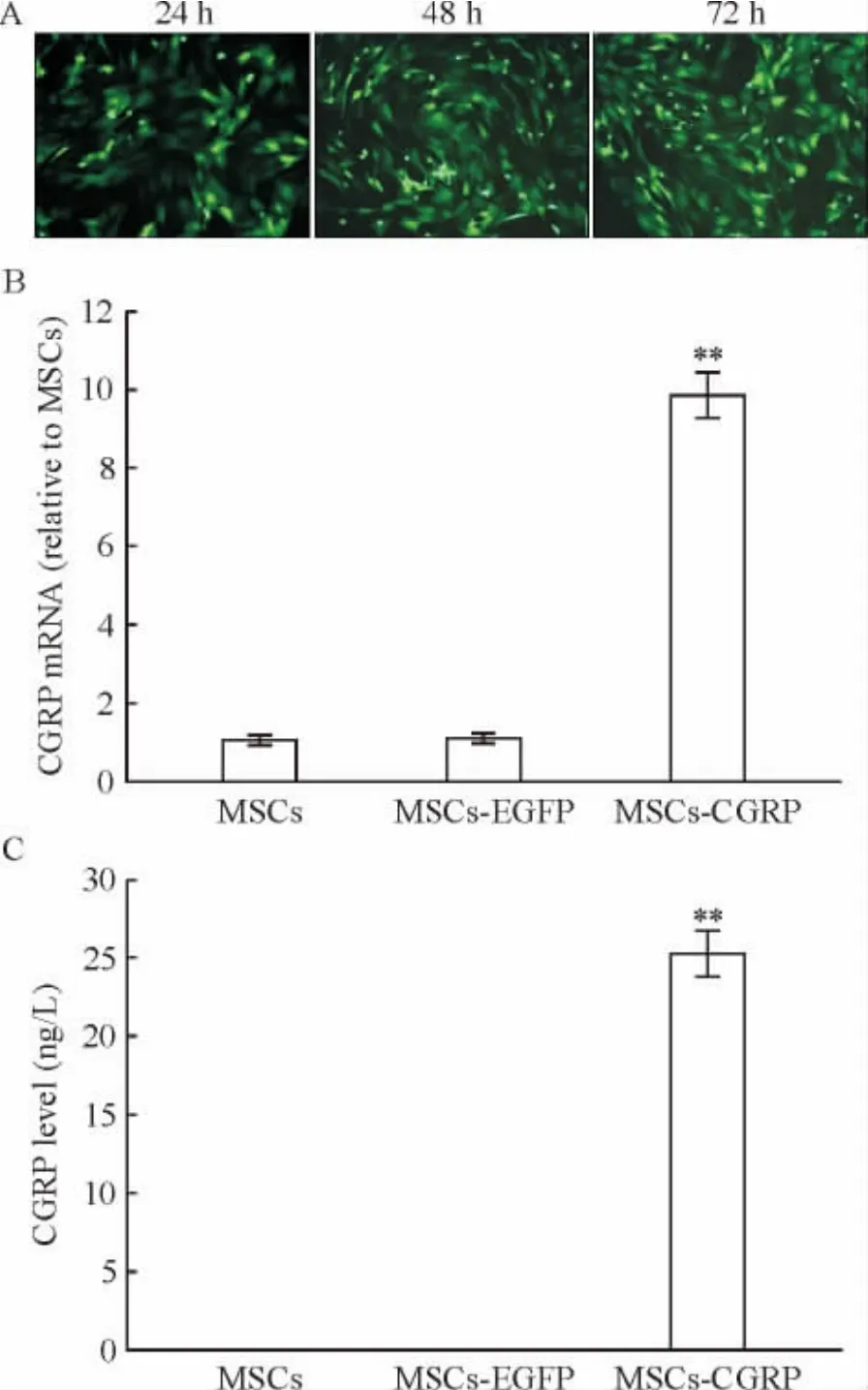
Figure 3.Transfection efficiency of CGRP gene and its expression in MSCs.A:after infection with CGRP recombinant lentiviral vector(MOI=30),MSCs over-expressed EGFP,and the infection rate was more than 85.0%(×100);B,C:compared with MSCs group and MSCs-EGFP group,the mRNA(B)and protein(C)expression of CGRPin CGRP-modified MSCs was obviously increased.Mean ± SD.n=3.**P <0.01 vs other groups.图3 CGRP基因转染效率和CGRP修饰的MSCs中CGRP的表达
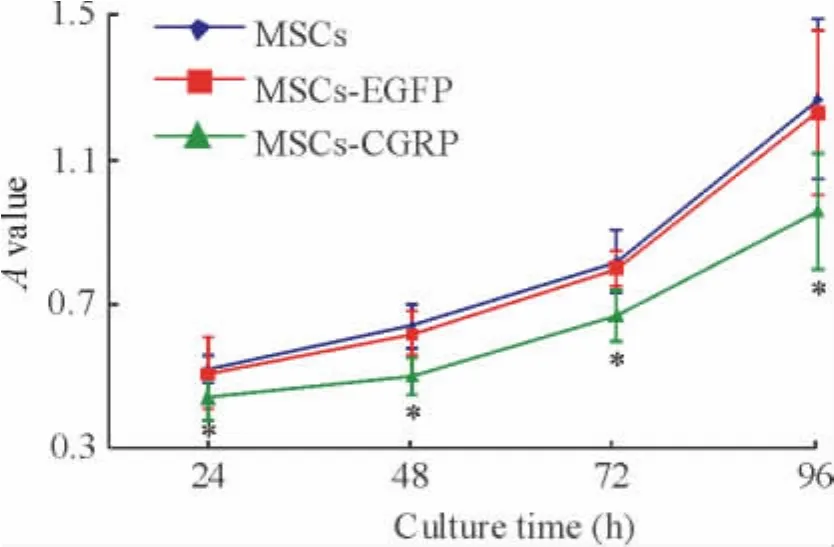
Figure 4.The proliferation of VSMCs detected by MTT assay.Mean ±SD.n=6.*P <0.05 vs other groups.图4 MTT法检测CGRP修饰的MSCs对VSMCs增殖的影响
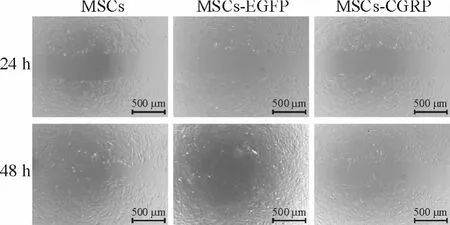
Figure 5.The migratory ability of VSMCs detected by scarification assay.图5 划痕实验检测CGRP修饰MSCs对VSMCs迁移的影响
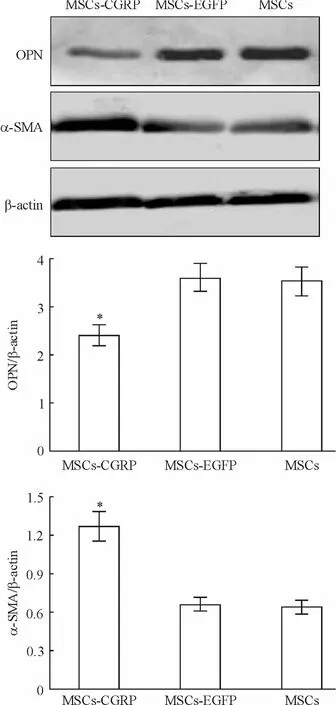
Figure 6.The expression ofα-SMA and OPN in VSMCs after coculture for 48 h was evaluated by Western blotting.Mean ±SD.n=3.*P <0.05 vs other groups.图6 Western blotting检测共培养后48 h VSMCs的α-SMA和OPN的表达
讨 论
血管损伤后的异常内膜增生在血管闭塞性疾病的发展过程中起着重要作用,比如动脉粥样硬化和再狭窄(restenosis,RS),其中血管平滑肌细胞增殖在上述发病机理中起重要作用。目前研究表明,VSMCs异常增殖、迁移、合成并分泌大量细胞外基质(extracellular matrix,ECM)是导致 RS的主要原因[5],此病理过程中VSMCs表型转化又是血管平滑肌细胞增殖和迁移的起始步骤[6]。VSMCs具有2种表型,分别是收缩型(分化型)和合成型(去分化型),两者之间具有可变性。在正常成熟血管壁中,VSMCs以前者为主,又称纺锤样细胞,呈典型“峰-谷”样生长,表达一系列特异性收缩蛋白,如α-SMA等来维持其收缩功能。当血管内皮受损(如动脉粥样硬化、球囊损伤等)或将VSMCs进行体外培养时,VSMCs增殖并发生表型转化,由收缩型转化为合成型,其分化型标志基因表达下调甚至消失,而合成型标志基因重新开放,收缩功能消失,这种状态的VSMCs称为合成型VSMCs,它能合成、分泌大量细胞外基质并获得迁移和增殖能力,其特异性蛋白为OPN[7-8]。
CGRP是体内广泛存在的一种的血管活性肽,参与各种生理、病理过程,包括抑制炎症、细胞增殖、血管活性物质(血管紧张素Ⅱ)等,是目前最强的内源性扩血管肽之一。CGRP具有抑制VSMCs增殖及表型转化(从收缩表型向合成表型转化)的作用,其作用可能通过抑制周期蛋白D、E,使VSMCs停留于G0/G1期,通过限制细胞周期进程而达到抑制VSMCs增殖的作用。多项研究也显示,CGRP能显著抑制血管紧张素Ⅱ及胎牛血清诱导的VSMCs增殖及表型转化,其机制可能与阻滞细胞周期进展、减少细胞内Ca2+含量,抑制胞内丝裂原活化蛋白激酶和蛋白磷酸化及蛋白激酶C的活性等有关[9-10]。还有研究显示,CGRP可能通过抑制血管平滑肌细胞细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和核因子κB信号通路的激活,从而抑制血管紧张素Ⅱ诱导的VSMCs的表型转化。以上研究资料显示,CGRP对VSMCs增殖及表型改变等方面表现出较强的干预作用[11]。
近年来,MSCs在心血管疾病中的应用是基础和临床研究的热点[12-13]。MSCs具有不断自我更新、多向分化潜能、免疫耐受性以及易于外源基因的转染和表达而其多能性不受影响等特点[14],并且可能成为心血管损伤后修复的理想细胞[15]。本研究小组前期研究显示:MSCs移植能在一定程度上促进损伤动脉内皮的修复,从而减轻术后血管内狭窄的程度,但其对VSMCs的作用相对较弱。
本实验首先通过real-time PCR和ELISA证实慢病毒载体介导的CGRP成功转染MSCs,转染的MSCs中高表达CGRP且能分泌CGRP蛋白,与MSCs组和MSCs-EGFP组相比有显著差异(P<0.01);然后通过将CGRP修饰的MSCs与VSMCs进行共培养发现:与MSCs-CGRP共培养的VSMCs增殖和迁移能力明显下降,与MSCs组和MSCs-EGFP组相比有显著差异(P<0.05),而后2组间比较无显著差异(P>0.05),说明CGRP修饰的MSCs对VSMCs的增殖和迁移有抑制作用。Deng等[16]研究也发现,体外腺病毒载体介导CGRP基因转染MSCs后分泌的CGRP蛋白具有抑制VSMCs增殖的效应。同时本实验通过Western blotting检测血管平滑肌细胞的表型标志还发现,MSCs-CGRP组的α-SMA较其余2组增加,而OPN较其余2组减少(P<0.05),其余2组间差异无统计学意义(P>0.05),表明CGRP转染的MSCs在体外可使VSMCs由合成分泌型向收缩表型转换,有助于减少VSMCs的分泌和合成,从而抑制VSMCs的增殖。
综上所述,CGRP修饰的MSCs能分泌CGRP蛋白,分泌的CGRP在体外可能通过抑制VSMCs的表型改变(分化型向去分化型转化),从而抑制VSMCs的增殖和迁移,为体内基因治疗以VSMCs增殖为主要病理改变的血管闭塞性疾病奠定了体内实验基础。
