二氧化硫对大鼠肢体缺血再灌注所致肺损伤的影响及其作用机制*
2013-12-01黄新莉周君琳范伯元
黄新莉, 周君琳, 黎 宁, 范伯元
(1河北医科大学病理生理教研室,河北石家庄050017;2首都医科大学附属北京朝阳医院骨科,北京100020;3石家庄市第三医院骨科,河北石家庄050011)
肢体缺血是临床常见的病理征象,尽管恢复其血液循环是挽救肢体所必须的,但是缺血再灌注(ischemia-reperfusion,IR)不仅可能加重局部缺血组织的损伤,严重时尚可引起全身炎症反应综合征,甚至远隔的多脏器功能障碍综合征,其中肺是易受累的首位靶器官,表现为急性肺损伤(acute lung injury,ALI)甚至急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1],病死率极高。尽管关于肢体IR后ALI的发病机制迄今尚未完全阐明,但现在较为公认的看法是肢体IR使机体的炎症反应细胞处于激活状态,继而出现了失控的全身炎症反应。此时多形核中性粒细胞(polymorphonuclear neutrophil,PMN)在肺部大量聚集是肺损伤发生的中心环节[2]。肺是气体交换的场所,气体分子对肺的影响尤为重要,“气体信号分子家系”的发现将肺损伤等疾病的研究带入了一个全新的阶段[3]。自上世纪80年代以来,已陆续证实代谢产生的内源性气体分子一氧化氮(nitric oxide,NO)、一氧化碳(carbon monoxide,CO)和硫化氢(hydrogen sulfide,H2S)可以作为信号分子参与机体稳态调节,并且具有重要的生理和病理生理意义,由此开创了“气体信号分子家系”的新领域。新近,另外一个小分子气体物质二氧化硫(sulfur dioxide,SO2)的生物学效应开始引起人们的关注。SO2是全球性的常见大气污染物,其暴露的主要毒害是对人和啮齿类动物的呼吸道产生刺激和腐蚀作用,并与一些呼吸系统疾病(例如气管炎、哮喘、肺气肿等)的发生有关[4],但SO2也可由健康人体含硫氨基酸的代谢转化产生。最新研究显示[5],内源性SO2具有改变心率、降低血压、扩张血管等效应,可能是一种新的信使分子关于内源性SO2对肺损伤作用的研究较少。Jin等[6]研究显示,SO2可以使野百合碱诱导的肺动脉高压大鼠肺及血浆中超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶水平明显增高,具有一定的抑制氧化损伤作用。本课题组研究证实外源性SO2可抑制脂多糖所致大鼠肺损伤时肺组织中的炎症反应从而减轻肺损伤的程度[7]。本实验旨在观察大鼠肢体IR致ALI时SO2及其生成关键酶天冬氨酸氨基转移酶(aspartate aminotransferase,AST)的变化以及SO2供体亚硫酸钠/亚硫酸氢钠(Na2SO3/NaHSO3)和AST抑制剂异羟肟酸(hydroxamate,HDX)对此种肺损伤的影响,以探讨内源性和外源SO2对大鼠肢体 IR所致 ALI的作用及可能机制。
材料和方法
1 材料
Na2SO3/NaHSO3、HDX及其它化学试剂均购自Sigma。临用前Na2SO3/NaHSO3用无菌注射用水以3∶1(0.54 mmol/kg∶0.18 mmol/kg)新鲜配制混合液,作为外源性 SO2供体。HDX按 0.47 mmol/kg以无菌注射用水新鲜配制,无菌注射用水和生理盐水购自本院药房。丙二醛(malondialdehyde,MDA)、AST、细胞因子试剂盒和细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)单克隆抗体均购自北京中杉公司。体重为250~300 g的健康SD雄性大鼠(河北医科大学动物试验中心)。其它试剂均为分析纯。
2 方法
2.1 动物模型 按照 Cohen等[8]提供的方法复制肢体IR致ALI动物模型。体重为250~300 g的健康SD雄性大鼠(河北医科大学动物试验中心)用苯巴比妥钠(40 mg/kg,腹腔注射)麻醉。分离左侧颈外静脉及右侧颈总动脉插管以补液(乳酸林格氏液2 mL/h)、给药及采血。以橡皮止血带绑扎双后肢根部造成肢体缺血,4 h后松开止血带使肢体血流再灌注。应用激光多普勒(Pri Flux 5001型,Perimed)探测血流以保证肢体的缺血和再灌注。
2.2 实验分组 将96只SD大鼠随机分为6组:假手术(sham)组、sham+SO2组、sham+HDX组、IR组、IR+SO2组和IR+HDX组。对照组动物给予同样的麻醉和操作,只是不造成肢体缺血。IR组动物双后肢缺血4 h再灌注4 h。于再灌注前10 min和相应的对照时点静脉给予药物处理:IR+SO2和sham+SO2组分别给予Na2SO3/NaHSO30.5 mL;HDX+IR和HDX+sham组动物分别给予 HDX 0.5 mL;sham组和IR组动物分别给予等量溶剂对照(无菌生理盐水0.5 mL)。实验结束时,各组8只动物用于24 h存活情况观察,另8只动物进行下述指标检测。
2.3 检测指标和方法
2.3.1 肺系数测定 自气管分叉以上第5、6软骨环间剪断气管,将肺脏组织完整取出,用滤纸吸干其表面血污后称质量。肺系数=全肺湿质量(g)/体质量(kg)。
2.3.2 肺组织学检查及其PMN计数 取右肺下叶,10%甲醛固定,常规石蜡包埋、切片及HE染色,光镜下观察肺组织形态学变化,并随机计数10个高倍镜视野(HP)中肺泡间隔PMN平均数目,用以衡量PMN在肺组织中的聚集情况。
2.3.3 肺组织匀浆上清液的制备及蛋白定量 取右肺组织中叶,用预冷的生理盐水洗去残血,滤纸吸干,分析天平称重后。4℃,用电动匀浆器制成10%(W/V)的匀浆。4℃、4 000 r/min离心10 min,吸取上清,进行分装,采用改良酚试剂法测定蛋白含量,其余 -80℃避光储存。
2.3.4 肺组织匀浆中MDA含量的检测 MDA是氧自由基攻击生物膜中多不饱和脂肪酸引发脂质过氧化所形成的产物,故其含量变化可反应组织氧化损伤的程度。应用MDA检测试剂盒按照其操作说明,采用硫代巴比妥酸比色法检测肺组织匀浆上清中MDA含量,结果以μmol/L表示。
2.3.5 肺组织SO2水平测定 高效液相色谱(highperformance liquid chromatography,HPLC)荧光法检测组织SO2水平。100μL肺组织匀浆上清加入70 μL 硼氢化钠(0.212 mol/L,溶于0.05 mol/L、pH 8.5的Tris液)室温孵育30 min。加入10μL单溴二胺(70 mmol/L,溶于乙腈),充分混匀,42℃孵育10 min。加入 40μL高氯酸(1.5 mol/L)混匀,12 400 r/min,离10 min,取上清液,加入 10μL Tris液(2.0 mol/L,pH 3.0)轻轻混匀,12 400 r/min离心8 min,留取上清液进行HPLC(1100型高效液相色谱仪,惠普 Agilent公司)分析。流动相 A:甲醇、乙酸及水的体积比为 5.00∶0.25∶94.75,pH 3.4;流动相B:甲醇(甲醇梯度:0~8 min,50 mL/L;8~15 min,50~120 mL/L;15~20 min,120 mL/L;20~30 min,120~200 mL/L;30~32 min,200 mL/L;32~35 min,200 ~1 000 mL/L;35 ~40 min,1 000 mL/L;40~43 min,1 000~30 mL/L;43~45 min,30 mL/L)。激发波长392 nm,检测波长479 nm。结果以μmol/g蛋白表示。
2.3.6 肺组织AST水平检测 采用自动生化仪(Hitachi 7600,Tokyo)检测肺组织匀浆上清中AST活性,结果以103U/g蛋白表示。
2.3.7 血清中肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)-1水平的测定 使用ELISA试剂盒测定血清中TNF-α和IL-1浓度,按说明书进行操作。
2.3.8 肺组织ICAM-1蛋白表达的检测 采用免疫荧光流式细胞术检测肺组织中ICAM-1的表达:将于70% 乙醇中固定的标本用生理盐水冲洗后,用搓网法制备单细胞样品。取1×109/L肺组织细胞,用PBS洗涤2次,每次2 min,1 000 r/min离心去上清液,加入1∶50兔抗大鼠ICAM-1单克隆抗体,在37℃水浴中温育30 min,用PBS离心洗涤2次,弃上清,加入1∶100稀释的荧光染料FITC标记的羊抗兔IgG 100μL,37℃温育30min,离心洗涤2次,弃上清,除去未结合的多余荧光抗体,上机检测前加入1.0 mL PBS,经400目筛网过滤。同时设有:(1)PBS代替Ⅰ抗的阴性对照;(2)只加Ⅰ抗的阳性对照;(3)只加1∶100 FITC标记的IgG(Ⅱ抗)的阳性对照。以荧光指数(FI)表示ICAM-1蛋白的相对含量,FI=(样品蛋白表达的平均荧光强度-对照组平均荧光强度)/对照组平均荧光强度。
3 统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS 10.0统计软件分析。PMN数量和动物存活率行多样本均数比较的秩和检验(Kruskal-Wallis法)和两两比较的秩和检验(Nemenyi法),其它结果行单因素方差分析,有显著差异者再行q检验(Newman-Keul法)进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 肺组织形态学和PMN聚集的变化
光镜下观察可见,肢体缺血4 h再灌注4 h,肺组织出现水肿、出血及PMN浸润的组织学变化。应用Na2SO3/NaHSO3后则明显减轻,而应用HDX处理后上述肺组织学改变进一步加重。与sham组相比,IR组肺泡间隔中 PMN数目显著增高(P<0.05);与IR组相比,IR+HDX组肺组织PMN数目进一步增加(P<0.05),而IR+SO2组则明显减少(P <0.05);sham、sham+HDX 和 sham+SO2组之间无显著差异(P >0.05),见图1、表1。
2 肺系数和肺组织中MDA含量的变化
各组大鼠二者的变化趋势一致。与sham组相比,IR组明显增高(P<0.05),与IR组相比,I/R+HDX组进一步增高(P<0.05),而IR+SO2组则明显减少(P<0.05);sham、sham+HDX和 sham+SO2组之间无显著差异(P>0.05),见表1。
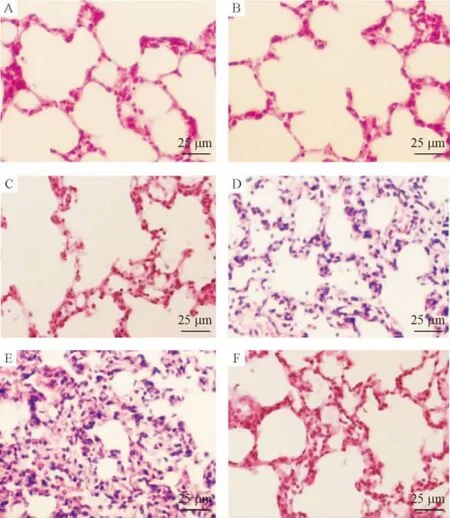
Figure 1.Effects of SO2 on rat lung tissue structure following IR of hind limbs(HE staining,×400).A:sham group;B:sham+SO2 group;C:sham+HDX group;D:IR group;E:IR+HDX group;F:IR+SO2 group.图1 SO2对大鼠肢体IR致肺损伤时肺组织结构的影响
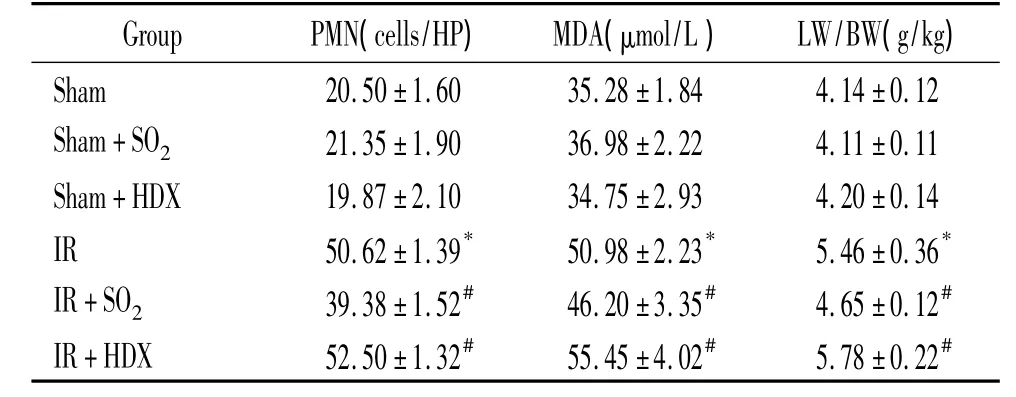
表1 SO2对大鼠肢体IR致肺损伤时肺组织PMN数目、LW/BW和MDA含量的影响Table 1.Effects of SO2 on lung PMN number,LW/BW and MDA content following IR of hind limbs in rats(Mean±SD.n=8)
3 动物24 h存活率
Sham组动物全部存活,存活率为100%;而IR后大鼠死亡4只,动物24 h存活率(50%)显著降低(P<0.05);与I/R组相比,动物24 h存活率IR+HDX 组(37.5%)降低,而 IR+SO2组(62.5%)则明显提高(均P<0.05);sham、sham+HDX和 sham+SO2组动物均全部存活。
4 肺组织SO2含量和AST活性的变化
与sham组相比,sham+SO2组SO2含量显著增高(P<0.05),AST活性无显著变化(P >0.05),sham+HDX组SO2含量和AST活性均显著降低(P<0.05)。与sham组相比,IR组SO2含量和AST活性均显著降低(P<0.05);与IR组相比,I/R+HDX组二者进一步降低(P<0.05),而IR+SO2组SO2水平显著提高(P<0.05),AST活性无显著变化(P >0.05),见表2。
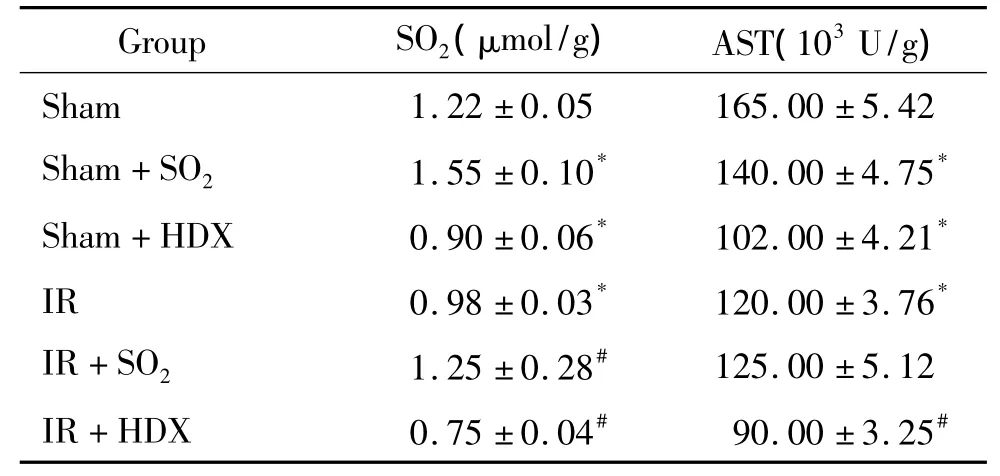
表2 各组大鼠肺组织中SO 2含量和AST活性的变化Table 2.Changes of SO2 concent and AST activity in lung of rats(Mean±SD.n=8)
5 血清细胞因子和肺组织中ICAM-1表达的变化
与sham组相比,IR组IL-1、IL-6和 IL-10水平升高,肺组织中ICAM-1蛋白表达量显著增加(P<0.01)。与IR组相比,I/R+HDX组IL-1和IL-6进一步增高(P<0.05)、IL-10水平无显著变化(P>0.05),IR+SO2组IL-1和IL-6显著降低、IL-10水平则显著增高(P<0.05);sham组和sham+HDX组之间相比无统计学差异(P>0.05),见表3。
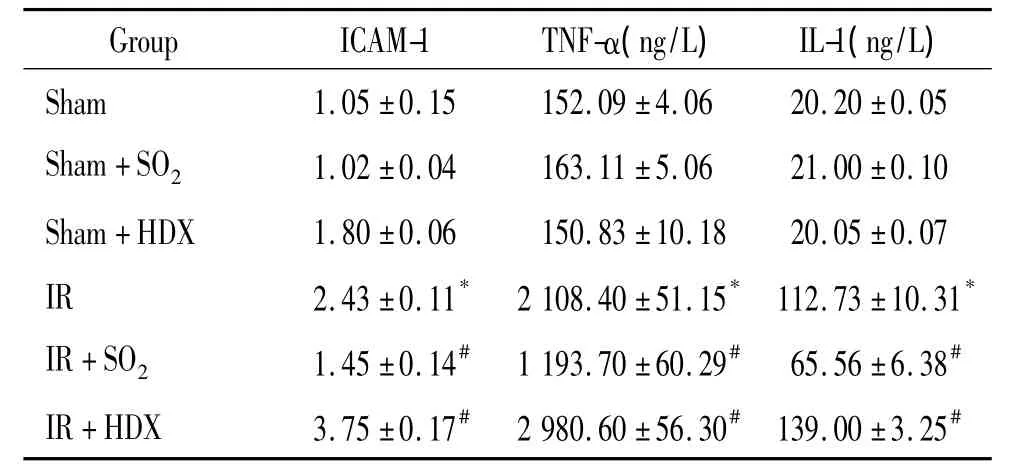
表3 SO2对肢体IR所致肺损伤鼠肺组织中ICAM-1蛋白表达和血清中IL-1、TNF-α含量的影响Table 3.Effects of SO2 on ICAM-1 expression in the lung tissues,and IL-1 and TNF-α levels in the serum of rats with IR-induced lung injury(Mean±SD.n=8)
讨 论
SO2是全球性的常见大气污染物,大剂量、长时间暴露会对环境和人体造成较大危害。已证实,高浓度的SO2及其衍生物,不仅可损害支气管和肺,还可损害胃肠道、肝、肾、心脏及神经系统,对机体各个脏器均可造成损伤[9]。一些学者提出了大气中SO2的健康危害阈值:成年人为0.8 mg/m3,儿童为0.6 mg/m3,超过该阈值,呼吸系统疾病的发病率会显著增加[10]。但是,SO2也可由健康人体含硫氨基酸的代谢转化产生。L-半胱氨酸在半胱氨酸氧化酶的作用下氧化为L-半胱氨酰亚磺酸,后者在GOT的作用下转氨基生成 β-亚磺酰丙酮酸,后者自发分解为丙酮酸和SO2。在体内,SO2与水结合产生其衍生物亚硫酸氢盐和亚硫酸盐(HSO3-/SO32-),二者量(摩尔)比为 1∶3。SO32-再经亚硫酸氧化酶的氧化作用生成SO42-排出体外,其中仍有一小部分SO2以游离形式存在。正常人血清亚硫酸盐浓度在 0~9.85 μmol/L 之间[11];大鼠血浆 SO2浓度为(16.77 ±8.24)μmol/L,胸主动脉血管组织 SO2浓度为(127.76 ±31.34)μmol/L[12]。那么,机体产生和存在的SO2有何作用呢?随着对新型小分子气体信使如NO、CO、H2S等作用的不断发现,学者们开始对SO2的生理作用产生兴趣。近来研究发现,内源性SO2是一种血管舒张因子,在生理相关浓度或低浓度下(1~2 mmol/L)具有显著的、剂量依赖性的血管舒张作用[13],具有降低肺动脉高压和高血压等作用。表明,SO2可能是继NO、CO、H2S之后新发现的又一重要信使分子。
本研究在大鼠肢体 IR所致ALI模型上发现大鼠肢体IR致肺损伤时,肺内SO2含量和GOT活性下降。为进一步阐明SO2/GOT通路变化的意义,本研究分别观察了补充SO2以及进一步抑制SO2对此种肺损伤的作用。通过预实验我们发现SO2供体Na2SO3/NaHSO3(mmol/kg∶mmol/kg)剂量分别为0.135∶0.045、0.27∶0.09、0.54∶0.18 和 0.61∶0.27时可呈剂量依赖性减轻大鼠肢体IR所致肺损伤时肺系数的增高(待发表)。结合预实验结果及相关文献报道[6],本研究采用 0.54 mmol/kg∶0.18 mmol/kg 的Na2SO3/NaHSO3为 SO2供体。结果显示,Na2SO3/NaHSO3可明显逆转大鼠肢体IR所致肺损伤时SO2含量的降低,同时明显减轻肢体IR所致肺损伤程度、提高动物的存活率;而应用AST活性抑制剂HDX抑制AST活性从而使SO2产生减少则明显加重此种肺损伤、降低动物的存活率,结果提示肢体IR后肺内SO2/AST体系的下调参与介导了肢体IR后ALI的发生,内源性和外源性 SO2具有抑制肢体 IR所致肺组织损伤的保护作用。0.54 mmol/kg∶0.18 mmol/kg Na2SO3/NaHSO3虽然可明显提高肺组织SO2水平,但从实验结果来看其仍在生理水平范围,理论上不会对正常组织造成损伤,实验结果也证实如此,即未发现 0.54 mmol/kg∶0.18 mmol/kg Na2SO3/NaHSO3对假手术对照组动物产生明显损害。张素清等[14]研究显示SO2可加重大鼠离体心肌的IR损伤,但作者并未检测组织中SO2的实际水平和变化,而且同一课题组随后的进一步研究报告显示,SO2可提高心肌组织内抗氧化酶活性、缓解异丙肾上腺素诱导的心肌损伤[15],与本研究结果基本一致。
肢体IR引起肺损伤的实质是肺组织中发生了失控的炎症反应,大量致炎因子和活性氧物质的产生以及PMN在肺部大量聚集是肺损伤发生的中心环节[2]。因此,抗炎、抗氧化、抑制PMN聚集是防治此种损伤的重要策略。本研究通过对肢体IR致ALI时肺组织病理学变化、PMN数目、氧化损伤产物MDA含量和肺系数以及炎症因子变化的检测进一步佐证了此种病理生理变化,同时发现抑制内源性SO2产生可使肺内MDA含量、PMN数目和炎症细胞因子IL-1、IL-6和TNF-α水平进一步增高、肺损伤进一步加重,而补充SO2可明显降低上述指标变化、减轻肺损伤程度,提示SO2具有抗炎、抗氧化、抑制PMN聚集的作用。
PMN在肺内的聚集是由位于PMN和肺微血管内皮细胞表面的一系列黏附分子(如L-选择素、P-选择素、ICAM-1、血管细胞黏附分子1和CD44等)表达上调所介导的;抑制肢体IR所致的黏附分子表达上调是抑制PMN聚集的重要策略。本研究结果发现,肢体IR可明显上调肢体IR后肺内ICAM-1表达,应用AST活性抑制剂HDX使SO2产生减少后肺内ICAM-1表达进一步增高,应用SO2供体Na2SO3/NaHSO3可使ICAM-1表达显著降低,提示SO2抑制肢体IR所致ALI及PMN聚集的机制与其抑制黏附分子表达有关。
