土壤盐碱对不同表型猴樟渗透调节物质的影响
2019-03-21韩浩章张丽华李素华王芳王晓立张颖
韩浩章,张丽华,李素华,王芳,王晓立,张颖
(宿迁学院建筑工程学院,江苏 宿迁 223800)
猴樟(Cinnamomun bodinieri Levl.) 为樟科樟属常绿乔木,主要分布在我国南方地区,最早被作为精油资源和林用树种进行研究与应用[1~3]。最近研究显示,猴樟的生长速度[4]、抗寒性[5]和抗盐碱性[6]均优于香樟,猴樟有可能替代香樟在我国苏北地区城区园林绿化中推广应用。樟属植物较适宜生长在微酸性土壤上,而我国苏北地区部分城区绿地土壤紧实度高、容重过大、有机质含量普遍较低、偏碱性[7],不利于樟属植物的引种推广。研究表明,樟属植物种内遗传多样性高[8],易受栽培环境的影响[9],地理类型多,北方种源较南方种源抗性更高,樟属植物实生后代变异程度大[10],这为猴樟耐盐碱、耐低温品种选育提供了有效资源。但是,我国对猴樟新品种选育的研究极少。基于此,以不同表型猴樟为试材,研究盐碱土壤环境下其渗透调节物质含量的变化,旨为猴樟新品种选育以及猴樟在苏北地区引种推广提供参考。
1 材料与方法
试验在宿迁学院樟属植物基地盐碱土壤环境试验区进行。土壤pH 值8.17,电导率1 153 μS/cm,含有机质13.85 g/kg、有效钾15.94 μg/g、有效铁12.07 μg/g、铵态氮61.75 μg/g、硝态氮266.75 μg/g、有效磷36.55 μg/g,可溶性盐含量15.89 mg/g。
2017 年4 月15 日播种猴樟;2018 年9 月根据植物学特性进行表型区分,选择5 个表现较好表型20180901(表型1)、20180903(表型2)、20180904(表型3)、20180909(表型4) 和20180912(表型5) 的实生苗进行露地移栽,每个表型种植15 株,株、行距均为1.6 m,行间铺黑色园艺地布,正常水分管理;2019 年8 月15 日每个表型均各随机选取3 株,每株选取3 个树冠中部的当年生枝,每个枝上选取3 个功能叶片进行生理指标测定。3 次重复。其中,叶绿素含量测定采用乙醇法[11];丙二醛(MDA) 含量测定采用硫代巴比妥酸(TBA)法[11];可溶性糖含量测定采用蒽酮比色法[11];可溶性蛋白含量测定采用考马斯亮蓝法[11];脯氨酸含量测定采用磺基水杨酸法[11]。指标数据均取3 次重复的平均值。
利用Excel 2007 和SPSS 21.0 软件对数据进行统计分析;采用最小显著差异法(LSD) 进行差异显著性分析,小写英文字母不同表示在0.05 水平上差异显著,反之亦然。
2 结果与分析
2.1 盐碱条件下不同表型猴樟的MDA 含量变化
盐碱条件下,不同表型猴樟的MDA 含量差异达到了显著水平(图1)。其中,表型1 的MDA 含量最低,与其他表型差异均达到了显著水平;表型5 的MDA 含量最高,表型4 次之,二者差异显著,且均与其他3 个表型差异也达到了显著水平,指标值分别为表型1 的3.77 倍和1.86 倍;表型2 与表型3 的MDA含量差异不显著,但二者与表型1 差异均达到了显著水平,指标值分别较表型1 高85.54%和112.05%。
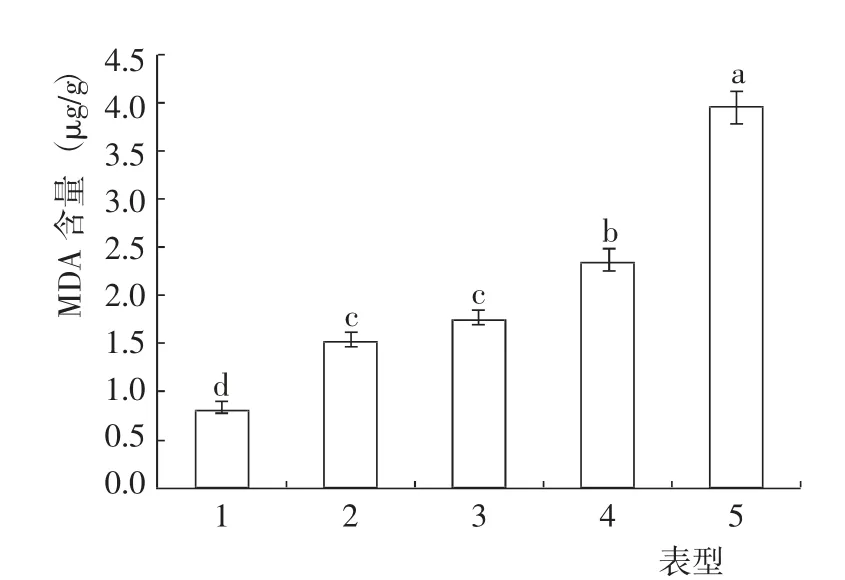
图1 盐碱条件下不同表型猴樟的MDA 含量变化Fig.1 Change of on MDA content of different phenotypes of C. bodinieri seedlings under on saline-alkali condition
2.2 盐碱条件下不同表型猴樟的可溶性糖含量变化
盐碱条件下,不同表型猴樟的可溶性糖含量差异达到了显著水平(图2)。其中,表型5 的可溶性糖含量最低,与其他表型差异均达到了显著水平;表型1 的可溶性糖含量最高,表型2 次之,二者差异不显著,但均与其他3 个表型差异达到了显著水平,指标值分别较表型5 高16.41%和14.94%;表型3 与表型4的可溶性糖含量差异不显著,但二者与表型5 差异均达到了显著水平,指标值分别较表型5 高9.05%和6.34%。
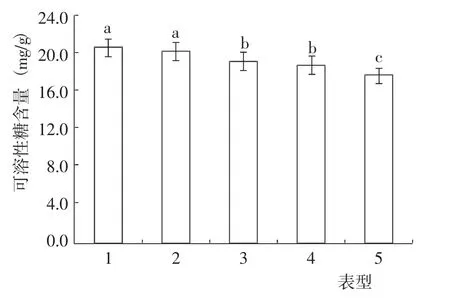
图2 盐碱条件下不同表型猴樟的可溶性糖含量变化Fig.2 Change of soluble sugar content of different phenotypes of C. bodinieri seedlings under on saline-alkali condition
2.3 盐碱条件下不同表型猴樟的可溶性蛋白含量变化
盐碱条件下,不同表型猴樟的可溶性蛋白含量差异达到了显著水平(图3)。其中,表型1 的可溶性蛋白含量最低,表型2 指标值较表型1 高13.06%,二者差异不显著,但均与其他3 个表型差异达到了显著水平;表型4 的可溶性蛋白含量最高,其次是表型3 和表型5,三者差异不显著,指标值分别是表型1 的1.64 倍、1.62 倍和1.49 倍。
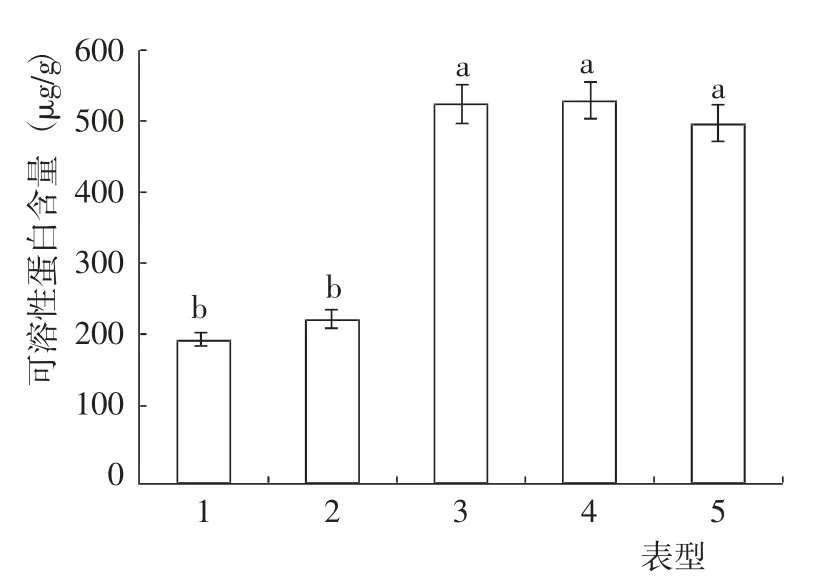
图3 盐碱条件下不同表型猴樟的可溶性蛋白含量变化Fig.3 Change of soluble protein content of different phenotypes of C. bodinieri seedlings under on saline-alkali condition
2.4 盐碱条件下不同表型猴樟的脯氨酸含量变化
盐碱条件下,不同表型猴樟的脯氨酸含量差异达到了显著水平(图4)。其中,表型4 的脯氨酸含量最低,与表型5(指标值较表型4 高11.84%) 除外的其他表型差异均达到了显著水平;表型1 的脯氨酸含量最高,表型2 次之,二者差异显著,且均与其他表型差异也达到了显著水平,指标值分别是表型4 的3.26 倍和2.49 倍;表型3 的脯氨酸含量与表型5 差异不显著,但显著高于表型4,指标值较表型4 高38.1%。
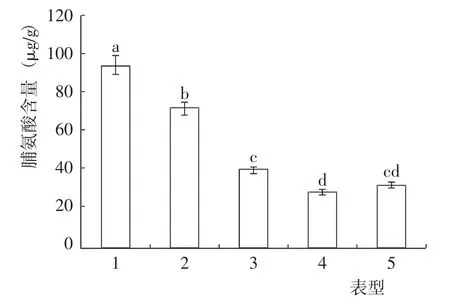
图4 盐碱条件下不同表型猴樟的脯氨酸含量变化Fig.4 Change of proline content of different phenotypes of C. bodinieri seedlings under on saline-alkali condition
2.5 盐碱条件下不同表型猴樟的叶绿素含量变化
盐碱条件下,不同表型猴樟的叶绿素含量差异达到了显著水平(图5)。其中,表型5 的叶绿素含量最低,其次是表型4(指标值较表型5 高6.33%) 和表型3(指标值较表型5 高7.59%),三者差异不显著,但均与其他2 个表型差异达到了显著水平;表型1 的叶绿素含量最高,表型2 次之,二者差异显著,指标值分别较表型5 高94.30%和37.97%。
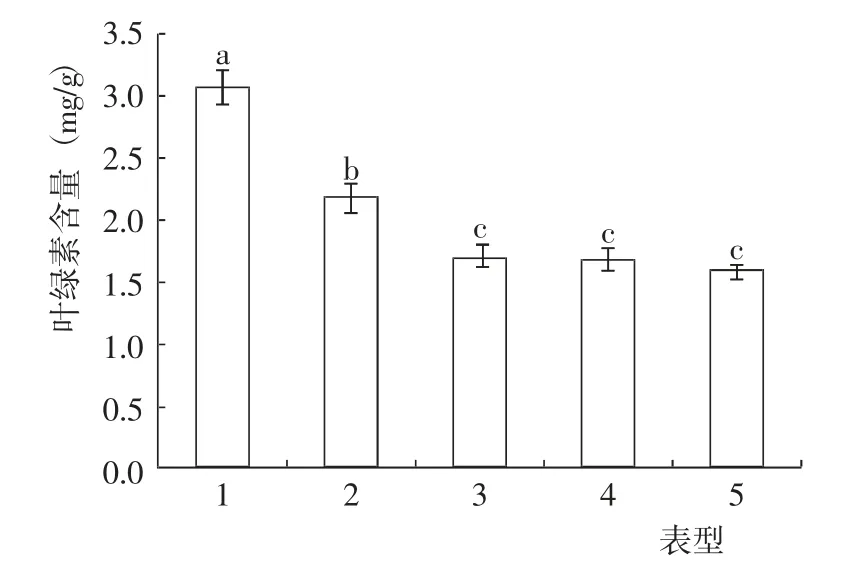
图5 盐碱条件下不同表型猴樟的叶绿素含量变化Fig.5 Change of chlorophyll content of different phenotypes of C. bodinieri seedlings uneder on saline-alkali condition
3 结论与讨论
土壤盐碱是限制樟属植物在我国苏北地区引种栽培的主要因子之一。盐碱条件下,土壤养分有效性差,有机质含量低,易板结[7],致使植物根系生长受到抑制,养分吸收和运输能力变差,叶绿素含量降低,光合速率下降[12~14],严重时引起植物叶片黄化,进一步导致光氧化伤害。植物受盐碱的影响首先是渗透胁迫,表现为细胞膜受伤,脂质过氧化,丙二醛含量提高[15,16]。渗透调节是植物抵御逆境的重要生理机制,植物可以通过合成渗透调节物质(脯氨酸、可溶性糖、可溶性蛋白等) 来调节细胞渗透平衡,提高耐盐碱性[17~19],盐碱胁迫时植物叶片中与脯氨酸、甜菜碱和肌醇合成相关的P5CS、BADH1、BADH2、IMP表达量也会高于对照[20]。通常认为,MDA、可溶性糖、可溶性蛋白、脯氨酸等渗透调节物质含量是反映植物抗逆性的指标。本研究中,表型1 和表型2 的MDA含量较低,可溶性糖、脯氨酸和叶绿素含量均较高,叶色深绿,表现较好,其中表型1 的表现优于表型2;其他3 个表型的MDA 含量较高,可溶性糖、脯氨酸和叶绿素含量均较低,叶色偏黄绿,其中表型5叶色最黄,表现最差。可以看出,表型1 和表型2的抗盐碱能力优于其他3 个表型,可以在我国苏北地区引种栽培。值得注意的是,表型1 和表型2 的可溶性蛋白含量并没有大幅度提高,而是远远低于抗性较差的其他3 个表型,究其原因可能是本研究是在猴樟生长速度最快的8 月进行,表型1 和表型2 抗盐碱能力强,二者生长发育受土壤盐碱的影响较小,光合速率依然较高[21],其生长发育消耗了大量的碳素和氮素[22],因而留在叶片中的可溶性蛋白含量较低;而抗盐碱能力较差的3 个表型,生长发育受土壤盐碱影响较大,光合速率较低,消耗的碳素和氮素较少,并且三者需要大量的可溶性蛋白以调节细胞渗透势,因而叶片中可溶性蛋白含量高。另外,我们在本研究还发现,表型1 和表型2 的脯氨酸含量远远高于其他3 个表型,推测脯氨酸可能在樟属植物抗盐碱过程的初期阶段起主要作用[20,23]。
