TGF-β1介导的RhoA/ROCK通路在大鼠肺肌成纤维细胞分化中的调节作用*
2013-12-01马文东邓海静于婉莹魏中秋
马文东, 袁 媛, 杨 奕, 徐 洪, 邓海静, 于婉莹, 孙 月, 魏中秋, 杨 方△
(河北联合大学1医学实验研究中心,2教务处,3病理学教研室,河北唐山063000)
以往的研究认为,在致肺纤维化各种刺激因素的作用下,肺间质成纤维细胞的增殖与合成大量细胞外基质是肺纤维化发生发展的关键环节。然而近期的研究发现,在长期受到致纤维化因素刺激时,肺间质成纤维细胞和上皮细胞,会发生表型转变并分化为肌成纤维细胞(myofibroblast)。肌成纤维细胞能特异表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),被认为是(矽)肺纤维化形成过程中产生过量细胞外基质最主要和最重要的细胞[1-2]。而转化生长因子β(transforming growth factorβ,TGF-β)是研究最多、最为深入并诱导肌成纤维细胞分化效果最为明显的细胞因子之一[3-5]。近年来研究发现TGF-β介导的Rho相关卷曲螺旋形成蛋白激酶(Rho-associated coiled-coil-forming protien kinase,ROCK)信号转导通路在器官纤维化形成中发挥着重要作用[6]。本实验旨在观察与探讨TGF-β1刺激诱导的RhoA/ROCK信号转导途径在调控肺成纤维细胞向肌成纤维细胞分化过程中的作用,为进一步深入研究(矽)肺纤维化形成机制提供一些实验的依据。
材料和方法
1 肺成纤维细胞培养
取新生Wistar大鼠,胰酶消化法获得原代培养的肺成纤维细胞,取第4代细胞用于实验。诱导前将细胞调整同步化后,实验被分为2部分:第1部分给予TGF-β1诱导刺激肺成纤维细胞0 min、5 min、15 min、30 min、45 min、1 h、3 h、6 h、12 h、24 h 和 48 h。第2部分将细胞分为3组:(1)对照组:0.4%血清浓度的DMEM培养液;(2)TGF-β1诱导刺激组:0.4%血清浓度的 DMEM培养条件下,给予 TGF-β1(5μg/L)刺激后孵育细胞;(3)Y-27632干预组(Rho/ROCK通路阻滞剂组):为0.4%血清浓度的DMEM培养条件下,给予RhoA/ROCK通路特异性阻滞剂Y-27632(10 mg/L)预孵育1 h后,再给予TGF-β1(5μg/L)共同孵育,选择诱导6 h、12 h和24 h 3个时点进行实验。
2 主要试剂
重组人 TGF-β1(Peprotech)、Y-27632(Cayman Chemica);GAPDH I抗(Santa Cruz)、β-actin I抗(Santa Cruz);I型、III型胶原 I抗(BA2023、BA0326,武汉博士德)、α-SMA I抗(Epitomics)、ROCK-I I抗(Epitomics)、血清反应因子(serum response factor,SRF)I抗(Santa Cruz);p-RhoA(Ser188)I抗(Affinity)、RhoA I抗(Affinity);肌球蛋白磷酸酶靶亚基(myosin phosphatase target subunit,MYPT;亦称为myosin-binding subunit of myosin light chain phosphatase,MBS)I抗(Anbo);p-MBS(Thr850)I抗(Millipore)。
3 主要方法
3.1 免疫细胞化学染色法检测α-SMA在肺成纤维细胞的表达 常规制备细胞爬片,多聚甲醛固定2 h。免疫细胞化学染色按说明书进行,其中α-SMA抗体浓度为1∶200,DAB显色。染色时设置阴性对照,PBS取代I抗。将染色后的细胞爬片经IPP 7.0图像分析软件进行图像采集。
3.2 Western blotting检测 ROCK、SFR、α-SMA、I型和III型胶原蛋白的表达 RIPA蛋白裂解液裂解、离心,吸取上清。以考马斯亮蓝R-250染色测定蛋白浓度后,以每泳道50μg蛋白含量上样,常规电泳并转膜。5%牛血清白蛋白37℃封闭1 h,在膜上滴加封闭液稀释的抗大鼠的抗体(β-actin和GAPDH抗体1∶500稀释;余抗体1∶100稀释),4℃孵育过夜。II抗(1∶3 000 稀释)37 ℃孵育1 h。BCIP/NBT(1∶50稀释)显色。见有清晰条带出现即用双蒸水终止显色。用扫描仪对PVDF膜上蛋白表达条带进行图像扫描,以ImageJ软件对蛋白表达条带进行平均吸光度值(average absorbance,A)的定量分析,经内参平衡(GAPDH或β-actin)后,以对照组的倍数作为该蛋白的相对表达量)。
4 统计学处理
数据以均数±标准差(mean+SD)表示,用SPSS 13.0软件进行完全随机设计的单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 TGF-β1诱导不同时点 p-RhoA、ROCK、p-MBS、SRF、α-SMA、I型和III型胶原蛋白表达的变化
免疫细胞化学染色结果显示(图1),经TGF-β1诱导后大鼠肺成纤维细胞形态由未加刺激时的瘦长梭形逐渐转变为宽大、多边形,胞体内出现大量平行或交叉排列的α-SMA抗体标记的肌丝。其中诱导3 h即可见胞体内肌丝,24 h几乎所有的细胞胞体内均有肌丝,细胞都转化为肌成纤维细胞。Western blotting法结果显示(图2、表1),经 TGF-β1分别刺激0 min、5 min、15 min、30 min、45 min、1 h、3 h、6 h、12 h、24 h和48 h,p-RhoA、ROCK、p-MBS、SRF、α-SMA、I型和III型胶原蛋白表达均在刺激5 min后表达即开始上调。其中p-RhoA、ROCK和p-MBS蛋白多在6 h左右达到峰值,是诱导前的2倍左右;SRF蛋白在12 h达到峰值,是诱导前的4.55倍;α-SMA表达在24 h达到峰值,是诱导前的4.06倍;I型胶原蛋白和III型胶原蛋白表达在24 h达到峰值,分别为诱导前的2.19和3.04 倍。
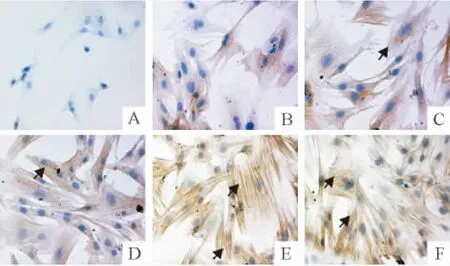
Figure 1.The expression ofα-SMA in rat pulmonary fibroblasts induced by TGF-β1 measured by immunocytochemistry(× 400).Treatment with TGF-β1.A:0 min;B:3 h;C:6 h;D:12 h;E:24 h;F:48 h.The arrows indicate the positive expression ofα-SMA.图1 TGF-β1刺激后肌丝样结构随时间变化在大鼠肺成纤维细胞内分布与表达情况
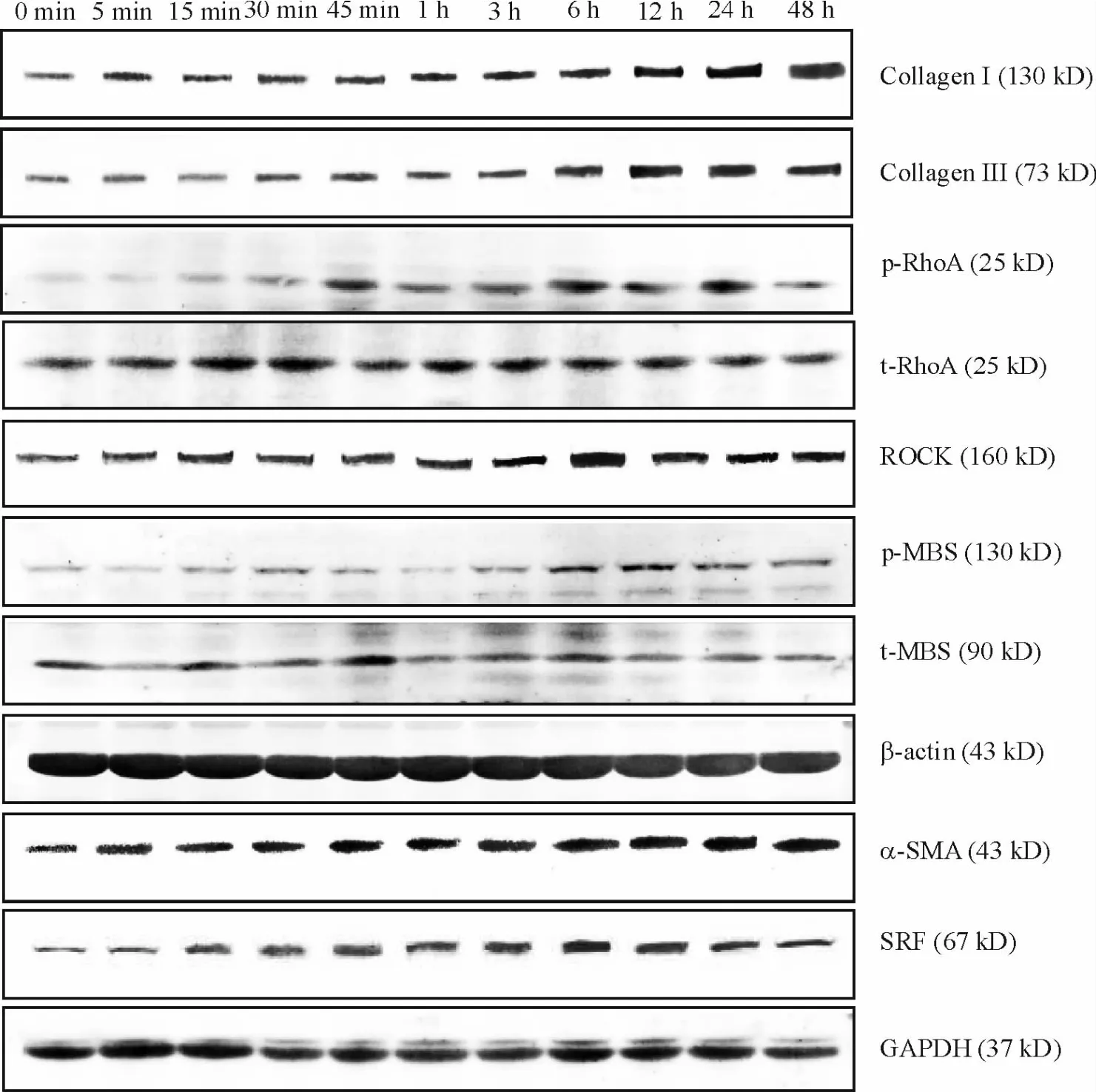
Figure 2.The expression of p-RhoA,ROCK,p-MBS,SRF,α-SMA,collagen I and collagen III in rat pulmonary fibroblasts time-dependently induced by TGF-β1.图2 TGF-β1诱导刺激不同时点 p-RhoA、ROCK、p-MBS、SRF、α-SMA、I型和III型胶原蛋白的表达
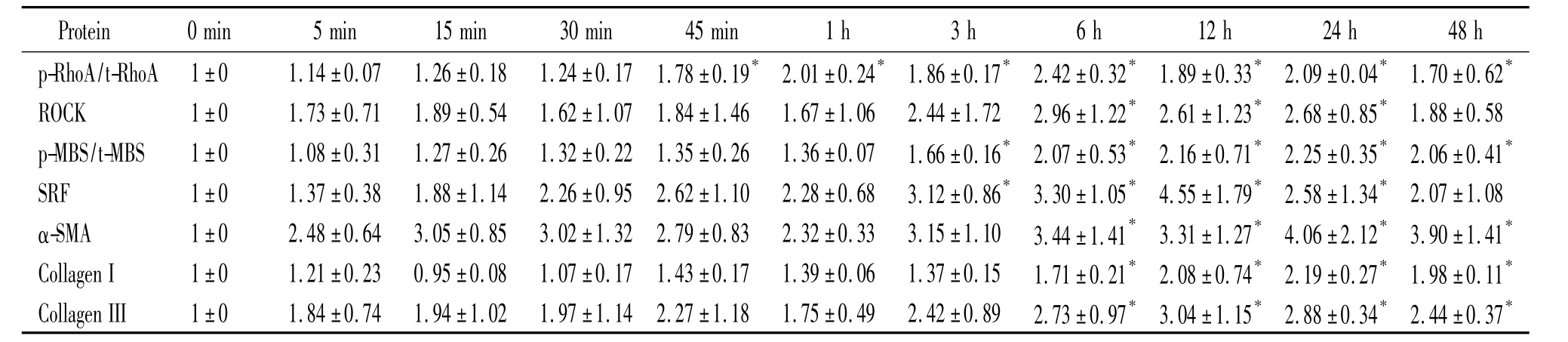
表1 TGF-β1诱导刺激不同时点 p-RhoA、ROCK、p-MBS、SRF、α-SMA、I型和III型胶原蛋白表达的变化Table 1.The expression of p-RhoA,ROCK,p-MBS,SRF,α-SMA,collagen I and collagen III in rat pulmonary fibroblasts time-dependently induced by TGF-β1(Mean ± SD.n=3)
2 Y-27632 对 TGF-β1诱导 ROCK、p-MBS、SRF、α-SMA、I型胶原和III型胶原蛋白在细胞中表达的影响
Western blotting法结果显示(图 3、表 2),经TGF-β1诱导6 h、12 h和24 h后,ROCK 表达增加,分别是相应时点对照组的1.98倍、1.46倍和1.72倍。给予Y-27632预处理后,ROCK表达显著下降,在6 h、12 h和24 h各时点分别是TGF-β1诱导组的48.48%、54.79% 和 50.62%,差异有统计学意义(P <0.05)。
TGF-β1诱导6 h、12 h 和24 h 后,p-MBS/t-MBS表达增加,分别是相应时点对照组的2.25、2.78和1.95倍。给予Y-27632预处理后,p-MBS/t-MBS表达显著下降,在6 h、12 h和24 h各时点分别是TGF-β1诱导组的64.00%、45.02%和54.86%,差异有统计学意义(P<0.05)。
TGF-β1诱导6 h、12 h和 24 h后,SRF 表达增加,分别是相应时点对照组的2.01、2.76和2.62倍。给予Y-27632预处理后,SRF表达显著下降,在6 h、12 h和 24 h各时点分别是 TGF-β1诱导组的60.70%、43.75%和33.20%,差异有统计学意义(P <0.05)。
TGF-β1诱导6 h、12 h 和24 h 后,α-SMA 表达增加分别是相应时点对照组的1.48倍、1.53倍和2.13倍。给予Y-27632预处理后,α-SMA表达下降,在6 h、12 h和 24 h各时点分别是 TGF-β1诱导组的43.24%、59.18%和45.83%,差异有统计学意义(P <0.05)。
经 TGF-β1诱导6 h、12 h 和24 h 后,I型胶原表达逐渐增加,分别是相应时点对照组的1.83倍、1.64倍和1.89倍。给予Y-27632预处理后,I型胶原表达下降,在6 h、12 h和24 h 3个时点分别是TGF-β1诱导组的43.17%、56.29%和51.89%,差异有统计学意义(P<0.05)。经TGF-β1诱导6 h、12 h和24 h后,III型胶原表达增加,分别是对照组的1.89倍、1.57倍和2.20倍。给予Y-27632预处理后,III型胶原表达下降,在6 h、12 h和24 h各时点分别是 TGF-β1诱导组的 60.32%、41.03% 和43.96%,差异有统计学意义(P<0.05)。
讨 论
矽(尘)肺是由于长期吸入含二氧化硅(SiO2)粉尘而引起的以肺组织弥漫性纤维化为主要表现的疾病,其主要的病理学变化为肺间质细胞增殖和细胞外基质(包括胶原蛋白)过多沉积导致肺的纤维化。在矽(尘)肺形成过程中,SiO2粉尘刺激肺泡巨噬细胞产生的各种细胞因子和活性物质是矽肺纤维化发生的重要因素,其中TGF-β1是目前公认的最为重要的致矽肺纤维化的因子之一[1-3]。体外研究也证实,采用SiO2刺激巨噬细胞或提取的灌尘老鼠肺泡灌洗液中的巨噬细胞,其培养上清 TGF-β1含量明显增加,能够显著诱导成纤维细胞的增殖和胶原合成,以及促进成纤维细胞向肌成纤维细胞的分化[4-5]。而肌成纤维细胞其收缩、迁移和合成细胞外基质的能力与功能远远大于肺间质的成纤维细胞,是器官纤维化形成过程中产生过量细胞外基质的最主要和最重要的细胞,在器官纤维化的发生与发展过程中具有重要意义[2-4]。Wang 等[7]报道,在大鼠单侧输尿管结扎致肾小管间质纤维化模型中,肾组织中TGF-β1、单核细胞趋化蛋白1、核因子κB和α-SMA的表达均较对照组(没有进行输尿管结扎)明显升高,肾小管间质内胶原的分布增多,胶原沉积增加。Peng等[8]应用TGF-β1诱导刺激人胚胎心脏成纤维细胞24 h后,细胞胞浆内出现较明显的α-SMA和胚胎型平滑肌肌球蛋白表达阳性的肌丝结构,其蛋白表达水平明显增加,同时细胞合成、分泌的胶原含量升高。Lomas等[9]最近报道在人特发性肺纤维化患者肺组织纤维化聚集区,TGF-β1表达明显升高,而α-SMA和I型胶原表达也明显增加。认为在特发性肺纤维化形成过程中,TGF-β1刺激间质细胞的分化和胶原的合成与积聚密切相关。以往较多研究表明TGF-β1可以通过对Smad、细胞外信号调节激酶和蛋白激酶A等信号转导通路的调节促进靶器官间质细胞向肌成纤维细胞的分化[8,10]。然而,近年来有学者发现TGF-β1能够通过介导Rho信号转导通路的激活,调控肌成纤维细胞的分化。其可能的调节路径为,TGF-β1通过其受体介导,激活靶细胞胞浆内的Rho(也称之small GTPase),活化的Rho依次激活其下游的靶蛋白即ROCK,ROCK活化后抑制胞浆内肌动蛋白磷酸酶的活性,从而诱导了肌动蛋白轻链的磷酸化和张力纤维的聚集,促进了靶细胞α-SMA蛋白的表达和胞浆骨架蛋白的重构[6,10-13]。SRF是 α-SMA上游的核转录因子,参与介导α-SMA表达的调控[10]。
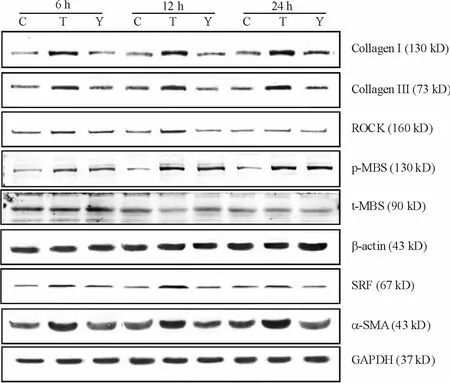
Figure 3.Effects of Y-27632 on the expression of ROCK,p-MBS,SRF,α-SMA,collagen I and collagen III in rat pulmonary fibroblasts induced by TGF-β1.C:control;T:TGF-β1;Y:TGF-β1+Y-27632.图3 Y-27632对TGF-β1诱导的大鼠肺成纤维细胞ROCK、p-MBS、SRF、α-SMA、I型和III型胶原表达的影响

表2 Y-27632对TGF-β1诱导的大鼠肺成纤维细胞ROCK、p-MBS、SRF、α-SMA、I型胶原和III型胶原蛋白表达的影响Table 2.Effects of Y-27632 on the expression of ROCK,p-MBS,SRF,α-SMA,collagen I and collagen III in rat pulmonary fibroblasts induced by TGF-β1(Mean ±SD.n=3)
本研究发现,随着 TGF-β1刺激细胞时间的延长,肺成纤维细胞开始由瘦长梭形逐渐转变为宽大、多边形,细胞表型发生了较明显的转变。当诱导刺激3 h时,胞体内可见明显α-SMA抗体标记的肌丝出现,并随着时间延长平行与交叉排列的肌丝成分越来越多,当诱导刺激24 h时,几乎所有细胞胞体内均有肌丝表达,即细胞均转化为了肌成纤维细胞。
与对照组相比较,TGF-β1刺激后的细胞中RhoA/ROCK/p-MBS蛋白表达量显著增多,在诱导刺激6 h左右,RhoA/ROCK相关信号转导蛋白表达量就明显上调。作为其下游效应因子的核转录因子SRF蛋白的表达量也明显增多,在12 h左右SRF蛋白表达量达到峰值。同时,细胞中α-SMA蛋白的表达量随时间增加逐渐增多,I型和III型胶原蛋白的表达量也明显增加,均在24 h达到峰值。这一过程似乎提示了TGF-β1诱导激活ROCK通路后,随后活化SRF,并进一步调控α-SMA的表达,刺激诱导了肺成纤维细胞向肌成纤维细胞的分化,进而促进I型和III型胶原蛋白的合成与表达。
当给予ROCK通路特异性阻滞剂Y-27632干预后,ROCK、p-MBS、SRF、α-SMA 以及 I型和 III型胶原蛋白的表达在各相应时点均明显减少。这提示ROCK通路特异性抑制剂Y-27632可以有效抑制这一过程,也从另一个方面证实了 TGF-β1介导的ROCK信号转导通路的激活对于调控肺成纤维细胞向肌成纤维细胞分化、促进胶原蛋白合成、进而促进(矽)肺纤维化的形成具有重要的意义。
