首发精神分裂症患者抗精神病药物治疗与代谢相关指标变化的关系
2013-12-01杨剑虹刘建君沈鑫华钱敏才宋娟芳
杨剑虹, 苏 伟, 李 良, 刘建君, 沈鑫华, 钱敏才, 宋娟芳
(湖州市第三人民医院,浙江 湖州313000)
近年来,不典型抗精神病药(atypical antipsychotics,AAPS)已被广泛用于精神分裂症患者治疗中。在临床实践中发现,不典型抗精神病药物虽然与传统抗精神病药物相比不良反应少,但仍存在潜在的严重不良反应——代谢综合征[1]。有研究显示某些抗精神病药物如氯氮平、奥氮平,存在药物相关的代谢综合征高风险,但临床中也发现某些服药的患者有高的代谢病易患因素,而他们并未发生这些不良反应。对该类药物所引起的代谢相关疾病如体重和糖脂代谢的异常已越来越受到国内外专家和学者的重视[2-3]。AAPS导致体重增加等代谢相关疾病的机制复杂且不明确,但是,研究发现可能与中枢神经系统的调控有关[4]。我们选择非典型抗精神病药奥氮平和阿立哌唑治疗精神分裂症,探讨二者对病人的瘦素及生长激素刺激肽和体重指数的影响及其相关性。
材料和方法
1 对象
选择2010年1月至2011年12月在本院住院首次发作的精神分裂症患者。入组标准:(1)符合中国精神障碍分类与诊断标准第3版的精神分裂症诊断标准;(2)初次发病,入组前未经过任何抗精神病药物治疗;(3)阳性和阴性症状量表(Positive and Negative Syndrome Scale,PANSS)总分≥70分;(4)性别不限,年龄18~65岁;(5)经检查血常规、心、肝、肾功能正常;(6)经湖州三院伦理委员会同意,全体参加研究者监护人(研究开始入组时由于患者大多处于急性期,无法与其谈知情同意,故只征求了家属的知情同意。)均签署书面知情同意书。排除标准:(1)合并内分泌疾病、营养不良、已确诊糖尿病或高脂血症者;(2)合并严重内外科疾病的患者;(3)排除伴有其它轴Ⅰ诊断如强迫症、物质滥用及有严重自杀倾向者等,无过敏及激素治疗史,未接受过免疫制剂治疗,无其它躯体疾病。脱落标准:(1)治疗1个月后患者疗效不佳,需要换用其它抗精神病药;(2)服药后出现不能耐受的不良反应,如严重焦虑、自伤自杀观念或行为、白细胞下降、严重感染等;(3)患者出院后不能坚持治疗,中途停药;(4)研究者认为需要停药或中止研究的其它情况。合并治疗:治疗过程中出现的锥体外系反应给予苯海索、东莨菪碱或普萘洛尔等对症处理,失眠的患者可合并苯二氮卓类药物,但不允许合用其它抗精神病药或对糖脂代谢有影响的药物。本研究共有120例患者入组,脱离21例,实际完成研究99例。
2 方法
2.1 分组和随访 患者随机分到奥氮平组和阿立哌唑组。随机化过程采用随机数字表法,在与符合入组条件的患者谈好知情同意后,按随机数字表进入各药物治疗组。纳入分析的99例中:(1)奥氮平组54例,男40例,女14例,平均年龄为(30.2±9.6)岁,平均病程(8.76±3.07)个月。基线入组60例,其中有3例因疗效不佳未满4周即退出研究,3例自动出院后失访。(2)阿立哌唑组45例,男35例,女10 例,平均年龄为(27.53 ±6.48)岁,平均病程(7.93±2.73)月。同样基线入组60例,其中7例因疗效欠佳而在4周末前退出研究,3例自动出院后失访,3例因严重失眠、坐立不安需换药而退出研究,2例撤回知情同意而退出研究。2组一般资料见表1,入组时各项资料无显著差异(P>0.05)。
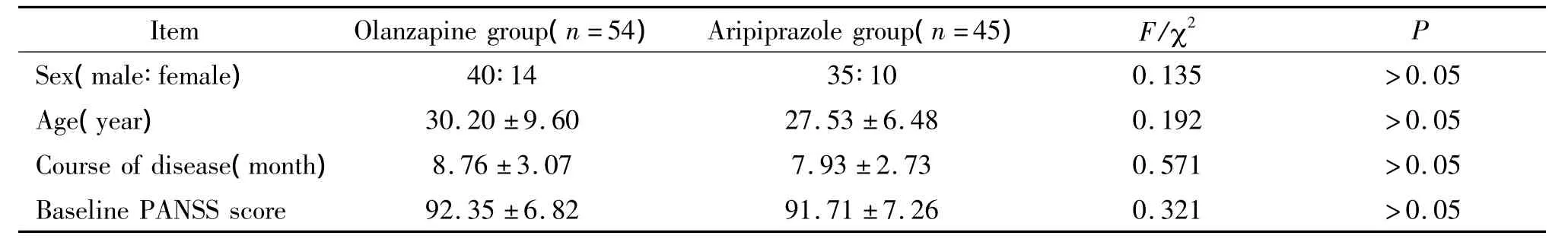
表1 奥氮平组和阿立哌唑组患者基线资料比较Table 1.Baseline data of the patients in olanzapine and aripiprazole groups
2.2 抗精神病药物治疗 单用奥氮平(美国礼来公司生产,商品名再普乐)组,治疗剂量为10~20 mg/d,研究结束时平均剂量为(17.96 ±3.44)mg/d;单用阿立哌唑(成都大西南制药生产,商品名博思清)组,治疗剂量为20~30 mg/d,研究结束时平均剂量为(26.88 ±4.58)mg/d。
2.3 临床疗效评定 于基线期和治疗第2、4、8及24周末对每组病人分别做PANSS评定。PANSS减分率(%)=(第1次评分-第2次评分)÷第1次评分×100%。PANSS减分率≥75%为临床痊愈,50% ~74%为显著进步,25% ~49%为进步,<25%为无效。由本院主治以上资格的精神科医生操作,研究前进行培训并对8例精神分裂症患者进行一致性测试,其PANSS评分一致性检验系数为0.95。
2.4 瘦素(leptin)、生长激素刺激肽(ghrelin)和体重指数(body mass index,BMI)测定 瘦素及生长激素刺激肽测定:于基线期、治疗第4、8及24周末对每组的病人分别抽取清晨空腹静脉血1次,通过ELISA方法,使用DRG公司瘦素和生长激素刺激肽检测试剂盒。同时测定肝肾功能、空腹血糖、血清胰岛素、总胆固醇及甘油三酯。采用CL-8000全自动生化分析仪完成测定。入组患者测量身高、体重,BMI=体重(kg)/[身高(m)]2。
3 统计学处理
数据分析使用SPSS统计软件。脱落病例资料不纳入统计分析;各组实验数据均进行正态性检验(Shapiro-Wilk法)和方差齐性检验(Levene法),若符合正态分布和方差齐性,则采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD检验,相关分析采用Pearson回归分析;若不符合正态分布或方差齐性,则采用多个独立样本非参数检验(Kruskal-Wallis检验),组间两两比较采用 Nemenyi检验,相关分析采用 Spearman法。以P<0.05为差异有统计学意义。
结 果
1 临床疗效
奥氮平组临床痊愈率 59.2%,有效进步率79.6%;阿立哌唑组临床痊愈率57.8%,有效进步率80.0%。三组间疗效差异无统计学意义(P>0.05)。但阿立哌唑组由于疗效不佳而脱离的患者有7例,相对奥氮平组脱离率较高。
2 两组患者各时点血清 leptin、ghrelin、胰岛素及BMI的变化
2.1 两组组内比较结果 基线期测定血清瘦素及生长激素刺激肽,并测体重,计算BMI,两组无显著差异。与基线期相比,两组24周末时体重及BMI均存在显著差异(P<0.05),相对而言,阿立哌唑组的体重变化较小,见表2。于治疗4、8及24周末测定血清瘦素及生长激素刺激肽,两组的血清瘦素指标在4周末时即出现差异有统计学意义,且持续至24周末。奥氮平组的生长激素刺激肽在各个时点测定与基线期相比差异无统计学意义,而阿立派唑组的生长激素刺激肽在8周末时与基线期相比差异有统计学意义,并持续至24周末,见表3。
2.2 组间比较结果 两组间体重变化比较无显著差异(P>0.05),8周末时体重及体重指数比较无明显变化,24周末奥氮平组的体重指数升高相对更为明显,与阿立哌唑组比较差异有统计学意义,见表2。
两组血清瘦素的变化较为一致,组间无显著差异。阿立哌唑组的生长激素刺激肽变化出现显著差异,组间比较也显示显著差异。奥氮平组胰岛素水平升高,阿立哌唑组未发现明显变化,组间比较有显著差异,见表3。
2.3 各指标间的相关性分析 基线期各组瘦素与治疗后体重未发现明显相关性,但与体重指数存在一定的相关性,基线期生长激素刺激肽水平与体重及体重指数均未发现有相关性,见表4。阿立哌唑组24周末研究结束时生长激素刺激肽与治疗后体重指数存在负相关(r= -0.291,P <0.05)。
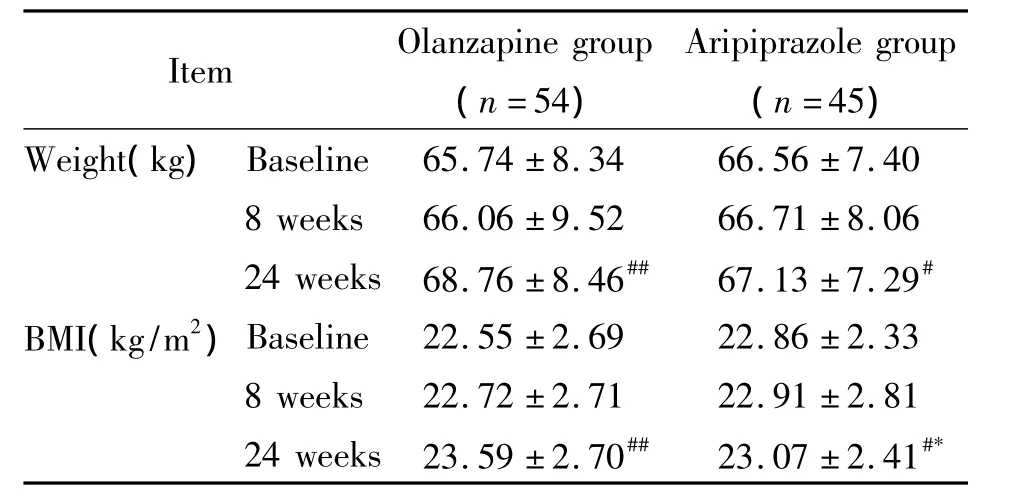
表2 两组基线期、8周末及24周末体重及体重指数的比较Table 2.Body weight and body mass index(BMI)at baseline,8 weeks and 24 weeks after treatment(Mean±SD)
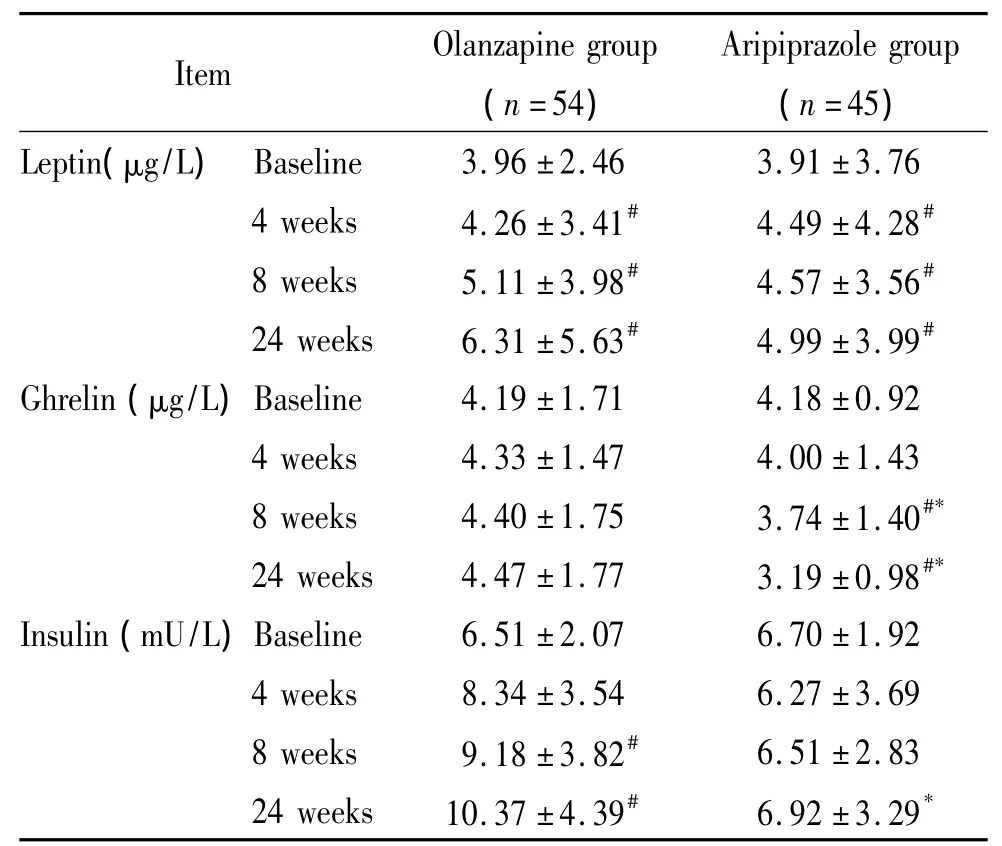
表3 两组基线期、4周末、8周末及24周末血清瘦素、生长激素刺激肽及血清胰岛素比较Table 3.Serum leptin,ghrelin and insulin at baseline,4 weeks,8 weeks and 24 weeks after treatment(Mean±SD)

表4 两组基线期瘦素、生长激素刺激肽与24周末体重指数的相关性Table 4.Correlation between baseline leptin/ghrelin and BMI at 24 weeks in the two groups
讨 论
长期服用非典型抗精神病药物的患者50%可引起体重增加甚至肥胖,是非典型抗精神病药物的主要不良反应,干扰患者治疗的依从性,是目前治疗精神病不彻底的重要原因之一,但是,非典型抗精神病药物导致体重增加的机制复杂且不明确。对首发精神病患者的分析中,非典型抗精神病药物所致体重增加与多巴胺D2型受体基因Taq I多态性A1等位基因所致体重增加无相关性。有报道AAPS可通过影响中枢神经递质、脂糖代谢、内分泌等多种途径使体重增加[5],瘦素和胰岛素水平升高及脂联素水平降低是出现肥胖的原因之一,其中瘦素与肥胖尤其关系密切[6-7]。Ghrelin又称为胃饥饿素或脑肠肽,循环中的ghrelin主要是由胃黏膜产生,在下丘脑、垂体、肠、肾、心脏、胎盘、性腺也有分泌,表明ghrelin具有广泛的生理学作用[8]。生长激素刺激肽被认为是外周血中唯一一个促进食欲的激素,作为体重增加的一个刺激因素,也是肥胖发生的一个有意义的指标[9]。生长激素刺激肽作用的一个重要方面是促进脂肪分解,脂肪细胞ob基因表达的瘦素蛋白具有调节摄食、代谢、生长等生物学作用。目前关于生长激素刺激肽对血中瘦素水平的影响报道很少,已有的少量报道也主要是在老年人或生长激素缺乏的病人上得到的,且结果并不一致。在国外一些小样本、前瞻性的研究中,已经发现抗精神病药物治疗与ghrelin水平的相关性[10]。血清leptin含量与多种疾病的相关性,是目前国内外研究的热点。有关抗精神病药源性肥胖的研究是当今精神病治疗效果的重要研究热点之一。
本研究结果表明2种药物整体在疗效上没有显著差异(P>0.05)。但在各种代谢指标上的影响方面则各不相同。奥氮平导致体重增加及血清胰岛素升高的风险较大。本结果显示从治疗的第4周末时体重及体重指数2组均无显著变化,到第24周末3组患者的体重指数值均高于基线期,奥氮平组的体重指数变化更为明显,且血清胰岛素水平高于基线期,治疗前后数值的比较有统计学差异(P<0.01),阿立哌唑组体重及体重指数的变化相对较小(P<0.05),胰岛素水平治疗前后没有显著变化。这提示奥氮平和阿立哌唑虽然对体重和血清胰岛素的影响并不一致,但总体均呈现升高趋势,这与之前国内的研究相一致。抗精神病药物引起糖、脂代谢异常的机制目前尚不明了,有较多学者认为可能与抗精神病药物增强胰岛素抵抗及对5-羟色胺受体作用有关。在本研究中,奥氮平治疗组较早出现胰岛素水平升高的现象,在阿立哌唑组则没有观察到,提示接受奥氮平治疗的患者在早期就出现胰岛素分泌失衡,因此,通过早期监测空腹胰岛素水平也可达到监测代谢综合征的作用。
本研究显示经非典型抗精神病药物治疗后,首发精神分裂症患者治疗前后存在瘦素的增加,血清瘦素的变化早于体重及体重指数的变化,且这种变化从治疗4周末持续至24周末 (P<0.05),生长激素刺激肽与体重指数的相关性在阿立哌唑治疗组可以观察到,但在奥氮平治疗组则无明显相关性,瘦素升高与体重指数存在明显正相关(P<0.05)。经不同的抗精神病药物治疗前后,瘦素的变化均有统计学意义(P<0.05),提示非典型抗精神病药物奥氮平和阿立哌唑对精神分裂症患者代谢指标的影响可能通过瘦素来调节,而阿立哌唑可能同时通过生长激素刺激肽的作用进行调节,有研究发现经奥氮平治疗后的精神分裂症患者的瘦素水平增加,而生长激素刺激肽水平降低[11],与本研究结果并不一致,以往相关的研究也较少,提示非典型抗精神病药物引起的代谢综合征也可能与外周血中的生长激素刺激肽水平失衡有关。本研究结果显示奥氮平组和阿立哌唑组均存在瘦素水平的升高,且奥氮平组的瘦素变化高于阿立哌唑组,其机制可能为:通过对胰岛细胞的直接作用引起胰岛素释放和分泌的增加,从而导致血脂尤其是甘油三酯的升高,刺激脂肪组织合成瘦素。有报道指出奥氮平可致分裂症患者BMI增加,并与血清瘦素增加呈正相关,本研究与之结论相一致[12]。有人[13]对单一药物治疗的精神分裂症患者进行研究,结果提示leptin基因-2548G/A多态性与抗精神病药治疗精神分裂症引起的BMI增加相关,与本研究结果一致,但也可能两者互为因果,从本研究结果看,提示精神分裂症患者经过抗精神病药物治疗后存在瘦素的变化早于体重的变化,可能是引起代谢综合征的独立因素之一。
本研究显示阿立哌唑对血清胰岛素水平的影响比较小,但仍会引起体重的增加,治疗后生长激素刺激肽的变化与治疗后体重指数存在负相关,提示生长激素刺激肽在代谢综合征的发生中可能也起到一定的调节作用。有研究提出经奥氮平治疗的患者存在生长激素刺激肽水平的下降[10],也有认为生长激素刺激肽水平与精神分裂症患者的肥胖及代谢综合征的发生没有关联[14],与本研究结果不一致。Kiewiet等[15]发现快速注入酰化ghrelin和去酰化ghrelin混合物可导致胰岛素浓度明显下降,我们推测阿立哌唑治疗组可能通过生长激素刺激肽来调节血清胰岛素水平,或降低患者的食欲,从而起到控制体重、降低代谢综合征发生的风险,有待进一步的研究确认。目前综合相关研究提示并不是所有的非典型抗精神病药物均存在生长激素刺激肽的变化,提示精神分裂症患者的体重增加及糖脂代谢的变化存在多途径因素,不仅与药物相关,与患者的生活方式、饮食习惯等其它非药物因素也密切相关。这为临床医生合理选择用药及早期进行干预提供了指导。
在本研究中,观察例数较小,观察时间也较短,可能对代谢综合征的追踪时间不够长。曾有追踪2年的研究发现,精神分裂症患者与健康对照组相比,存在较高的瘦素水平,而生长激素刺激肽在两组间并不存在差异[10],提示瘦素水平是较为敏感的指标。同时近年来已有研究提出,瘦素和生长激素刺激肽相关基因位点可能与肥胖及代谢综合征的发生相关[16]。本研究对瘦素和生长激素刺激肽相关的基因多态性等指标并没有进行相关测定,故对于代谢综合征的发生机理也只是考虑到其中一方面,在今后的研究中应该进一步完善。
