人脂肪间充质干细胞的分离培养及冻存前后生物学变化
2013-11-23谢甬淋戚飞腾童洋萍毕涌张旭
谢甬淋 戚飞腾 童洋萍 毕涌 张旭
人脂肪间充质干细胞(human adipose-derived stem cells,hADSCs)最初是由Zuk等[1]从人脂肪组织中分离得到的一种具有自我更新和多向分化潜能的多能干细胞[2]。hADSCs在一定条件下可以分化成脂肪细胞、成骨细胞、骨细胞、肌细胞、神经细胞等,并且具有特殊的免疫调节作用[3],常用于自身免疫性疾病的研究。hADSCs自抽脂手术废弃的脂肪中分离[1],取材丰富,无痛苦,不受伦理学限制,是具有巨大开发潜能的组织基因工程种子细胞。hADSCs体外培养周期较长,达到实验所需细胞数量需要3~4周,要实现随时为临床和基础研究提供足量的hADSCs,建立行之有效的冻存方法非常必要。确保冻存后细胞的存活率、增殖能力及细胞表面分子不受影响,是相关实验研究顺利进行的保障。本实验旨在建立一种高效地分离及冻存hADSCs的方法,分析冻存前后hADSCs的生物学特征,为进一步探究其生物学作用奠定基础。
1 材料和方法
1.1 材料 脂肪组织来自温州医学院附属第一医院整形科,捐赠者无重大疾病史,经捐赠者同意。实验设计通过温州医学院附属第一医院伦理委员会批准。Ⅰ型胶原酶购自Worthington公司,胎牛血清、低糖DMEM购自Gibico公司,hADSCs完全培养基购自广州赛业公司,细胞表面分子抗体购自eBioscience公司。
1.2 方法
1.2.1 hADSCs的分离培养:无菌条件下收集块状脂肪组织5~10g,浸泡在含有抗生素的低糖DMEM中。清除肉眼可见的血管组织,用含有抗生素的低糖DMEM反复冲洗3次以去除血细胞及其他杂质,无菌剪刀将组织块尽量剪碎。将脂肪组织置于双倍体积的0.1%(质量浓度)Ⅰ型胶原酶中,37℃震荡水浴锅中消化60min,每10min取出用力震荡以促使组织充分消化。消化后加入等体积含10%(体积分数)胎牛血清的低糖DMEM,400 g离心10min。弃去上层油脂及未消化的脂肪组织,沉淀用红细胞裂解液裂解10min后,400 g离心10min,低糖的DMEM清洗2次后,以100目筛网过滤、400 g离心10min。用hADSCs完全培养基重悬沉淀细胞后接种于T25培养瓶中,置于37℃、5%(体积分数)CO2恒温培养箱中培养。3d后首次换液,此后每隔2d换液1次,当细胞融合达80%~90%时,以0.25%(质量浓度)胰酶消化,按1∶2传代培养。
1.2.2 hADSCs冻存和复苏:取对数期生长的第3代细胞,以0.25%(质量浓度)胰酶消化、以300 g离心5min,加入预冷的冻存液〔70%(体积分数)DMEM、20%(体积分数)胎牛血清、10%(体积分数)DMSO;均为终浓度〕重悬,调整细胞密度1×106/mL。置于程序降温冻存盒中,-80℃过夜后转移至液氮冰箱贮存。6个月后从液氮中取出细胞,立即置于38℃~40℃水浴锅中迅速融化后转移至预先装有培养液的离心管中,以300 g离心5 min,hADSCs完全培养基重悬细胞转移至培养瓶中常规培养。
1.2.3 复苏后细胞存活率检测:复苏后,取适量细胞悬液,将细胞悬液与0.4%(质量浓度)台盼蓝溶液按9∶1比例混匀,3min内光镜下观察,计数被染成蓝色的死细胞数和拒染的活细胞数,根据公式计算复苏后细胞存活率。细胞存活率(%)=活细胞数/(活细胞数+死细胞数)×100%。
1.2.4 MTT法描绘细胞生长曲线:以0.25%(质量浓度)胰酶消化收集细胞,调整细胞密度至1×104/mL,接种至96孔板,每孔200μL,置37℃、5%(体积分数)CO2的恒温培养箱中培养。于第2天开始,每天于同一时间随机取1块96孔板,每孔加入5mg/mL的MTT液20μL,37℃孵育4h,吸去上清,每孔加入150μL DMSO,震荡混匀10 min。酶标仪上检测450nm处吸光度值。连测8 d,以吸光度值为纵轴,时间(d)为横轴绘制细胞生长曲线。吸光度值与细胞数量成正比。
1.2.5 hADSCs细胞表面分子检测:0.25%(质量浓度)胰酶消化细胞,300 g离心5min,PBS清洗2次,调整细胞密度至1×106/mL。分别加入抗人CD44-FITC、CD105-APC、CD29-FITC、CD73-PE、CD31-PE、HLA-DR-APC,以 FITC-IgG1、APCIgG1、PE-IgG1为同型对照。于4℃、避光孵育30 min,PBS清洗2次,最后加入200μL PBS重悬上机检测。
1.3 统计学处理 采用SPSS13.0软件进行分析。数据以均数±标准差表示。组间比较采用单因素方差分析。以P<0.05为有统计学差异。
2 结果
2.1 细胞形态 培养初期见大量悬浮细胞和脂肪滴,24h后细胞基本贴壁,呈圆形;3d后首次换液,可见少量长梭形细胞;6d后细胞融合基本达80%,细胞大小均等,成漩涡状、编织状生长。传代培养后,4d后可达80%融合,细胞形态较均一,呈纤维细胞样生长(图1A)。复苏后,hADSCs仍保持良好的生长状态,第二天观察贴壁良好,呈梭形(图1B)。
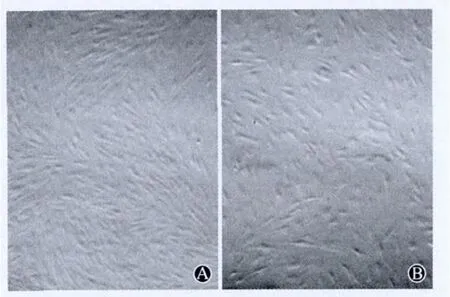
图1 第3代hADSCs冻存前(A)后(B)的形态(×100)
2.2 复苏细胞存活率 复苏后细胞存活率为(91.25±3.02)%。
2.3 冻存前后hADSCs生长曲线 冻存前后细胞生长曲线基本无差别,均呈“S”形。细胞经过2~3d潜伏期后进入指数生长期,7d后进入平台期,8d后细胞数稍有下降(图2)。
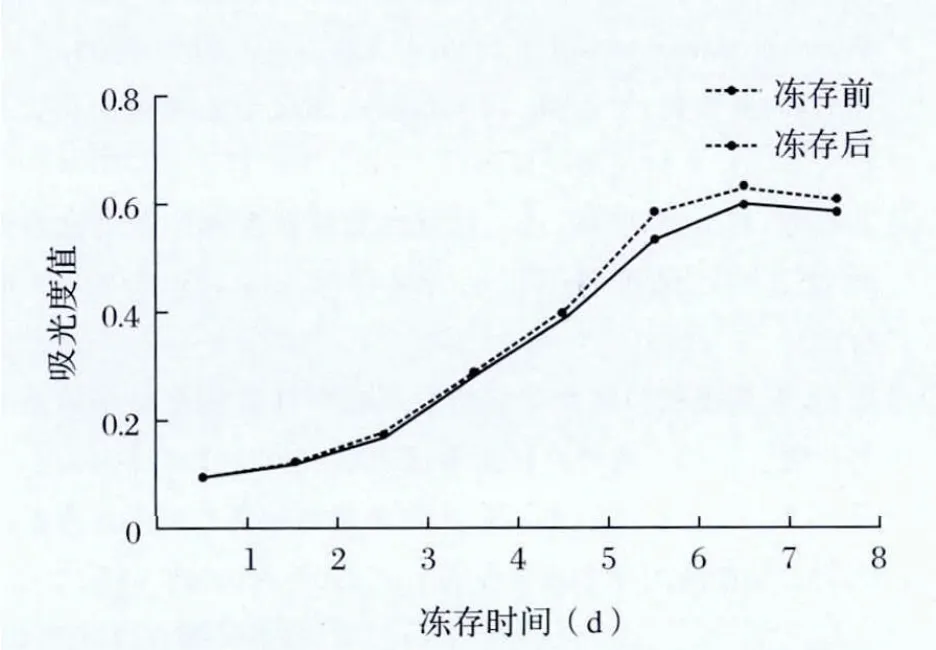
图2 冻存前后hADSCs生长曲线
2.4 冻存前后hADSCs细胞表面分子检测 冻存前,CD44、CD105 双阳性细胞占(99.850±0.001)%,CD29、CD73双阳性细胞占(92.600±0.028)%,CD31阳性细胞占(4.186±0.010)%、HLA-DR阳性细胞占(1.02±0.007)%。冻存后,CD44、CD105双阳性细胞占(98.060±0.028)%;CD29、CD73双阳性细胞占(91.224±0.041)%;CD31阳性细胞占(3.832±0.009)%、HLA-DR阳性细胞占(1.514±0.006)%。各指标冻存前后比较差异均无统计学意义(P>0.05)。上述结果表明冻存前后hADSC均高度表达CD44、CD105、CD29、CD73,CD31、HLA-DR几乎不表达。
3 讨论
干细胞研究为实现组织和器官的修复带来了新的技术革新。即使胚胎干细胞具有分化成为所有细胞类型的潜能,但由于其来源于胚胎组织,临床应用受到伦理限制,因此成体干细胞的研究将具有更加深远的意义。间充质干细胞(mesenchymal stem cells,MSCs)最初从骨髓中提取,随后研究证明在中胚层的其他组织如脂肪、胎盘、脐带、滑膜等都能提取,来源丰富[4]。相对于骨髓 MSCs,脂肪来源的 MSCs,即hADSCs,取材于抽脂术或外科手术中弃去的皮下脂肪,可使患者免受抽骨髓取材的痛苦[5]。近年来研究显示,MSCs具有调节免疫应答的能力,可在适应性免疫应答中抑制T细胞功能,改变辅助性T细胞(Th细胞)的平衡,诱导调节性T细胞(Treg)产生[6]。Najar等研究指出hADSCs相比骨髓MSCs具有更强的免疫调节作用[7],被视为治疗自身免疫疾病如多发性硬化、移植物抗宿主病等比较理想的种子细胞[8]。因此,成功分离出hADSCs,实现其在体外扩增,是进一步探究其生物学作用和进行移植研究的基础;而实现体外长期冻存hADSCs,随时为临床移植和科学研究提供充足干细胞,将是研究hADSCs的重要保障。
本实验采用胶原酶消化与离心相结合的方法,从人腹部脂肪组织中高效分离出MSCs,其贴壁生长、形态为长梭形,具有良好的增殖能力,可在体外连续扩增传代。冻存细胞时采用DMSO作为冷冻保护剂,利用程序降温冻存盒实现“慢冻”,使细胞内水分充分渗出,然后在液氮冰箱中长期保存细胞。与“4℃30min→-20℃2h→-0℃ 过夜→液氮保存”的缓慢降温法相比,程序降温冻存盒使用方便,避免了过多人为操作因素的影响。将细胞从液氮取出后在水浴锅中立即融化,以实现“快融”,使细胞外冰晶迅速融化后进入细胞内。此方法使复苏后细胞存活率高,均达90%以上。本实验通过描绘hADSCs细胞生长曲线发现,冻存前后细胞增殖能力未发生明显变化,冻存对细胞增殖未产生较大影响。流式细胞术检测细胞表面分子,显示冻存前后细胞均有 CD44、CD105、CD29、CD73高表达,CD31表达水平很低,HLA-DR几乎不表达。CD44、CD105、CD29、CD73是基质细胞的基本分子标记,hADSCs呈高表达;CD31为内皮祖细胞的表面标记,hADSCs表达阴性[9]。hADSCs在未受刺激的状态下不表达HLA-DR,但在INF-γ刺激时表达 HLA-DR[1]。本实验取未受任何刺激的hADSCs检测,结果与文献报道相符。MSCs没有特殊的表面标记,一般认为,长梭形贴壁细胞,同时表达CD44、CD105、CD29、CD73等表面分子,不表达CD31、HLA-DR等表面分子,可基本判定为 MSCs[10]。
综上,本实验成功分离出hADSCs,建立了将细胞长期冻存的方法,细胞复苏后仍具有良好的增殖能力,生物学性状未改变,这可能为hADSCs的基础研究和应用奠定了坚实的基础。
[1]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7:211-228.
[2]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13:4279-4295.
[3]Shi M,Liu ZW,Wang FS.Immunomodulatory properties and therapeutic application of mesenchymal stem cells[J].Clin Exp Immunol,2011,164:1-8.
[4]Dhanasekaran M,Indumathi S,Poojitha R,et al.Plasticity and banking potential of cultured adipose tissue derived mesenchymal stem cells[J].Cell Tissue Bank,2013,14,303-315.
[5]Gruber HE,Somayaji S,Riley F,et al.Human adipose-derived mesenchymal stem cells:serial passaging,doubling time and cell senescence[J].Biotech Histochem,2012,87:303-311.
[6]Batten P,Sarathchandra P,Antoniw JW,et al.Human mesenchymal stem cells induce T cell anergy and downregulate T cell allo-responses via the TH2pathway:relevance to tissue engineering human heart valves[J].Tissue Eng,2006,12:2263-2273.
[7]Najar M,Raicevic G,Boufker HI,et al.Adipose-tissue-derived and wharton’s jelly-derived mesenchymal stromal cells suppress lymphocyte responses by secreting leukemia inhibitory factor[J].Tissue Eng Part A,2010,16:3537-3546.
[8]Gruber HE,Deepe R,Hoelscher GL,et al.Human adiposederived mesenchymal stem cells:direction to a phenotype sharing similarities with the disc,gene expression profiling,and coculture with human annulus cells[J].Tissue Eng Part A,2010,16:2843-2860.
[9]Mitchell JB,McIntosh K,Zvonic S,et al.Immunophenotype of human adipose-derived cells:temporal changes in stromalassociated and stem cell-associated markers[J].Stem Cells,2006,24:376-385.
[10]Yang XF,He X,He J,et al.High efficient isolation and systematic identification of human adipose-derived mesenchymal stem cells[J].J Biomed Sci,2011,18:59.
