系统化临床检查对重症肌无力受累范围和分型判断的价值
2013-11-23刘培李海峰高翔刘涛刘静邓晖周晓斌
刘培 李海峰 高翔 刘涛 刘静 邓晖 周晓斌
重症肌无力(myasthenia gravis,MG)的诊断主要根据特征性的病态疲劳性、新斯的明试验、抗体检测及重复神经刺激(repetitive nerve stimulation,RNS)检查[1]。明确受累肌群对判断 MG的临床分型很关键,还可为选择治疗方案提供参考。但临床实践发现病史不一定能反映真实的受累范围。系统进行疲劳试验和RNS检查可发现潜在的受累肌群,新斯的明试验有助于区分肌肉无力/疲劳是由MG还是其他原因所致。该研究评价了系统化临床检查(在病史基础上逐步增加疲劳试验、新斯的明试验和RNS,基于上一步结果并结合该步结果做出判断)在MG受累肌群和分型判断中的价值,并评价Osserman分型和MGFA分型在MG诊治经验不同医师间的可重复性。
1 对象和方法
1.1 研究对象 收集2010-12-2011-09首次就诊于作者医院的MG患者64例,其中男19例、女45例,年龄15~78岁,平均(49.9±17.6)岁。病程5d~15年,中位数为3个月,四分位数间距为8个月。初次发病且未接受治疗者38例,经治疗症状改善停药后复发且尚未再次接受治疗者6例,治疗后病情稳定或好转期者20例。确诊标准:根据症状的病态疲劳性、新斯的明试验阳性且RNS或乙酰胆碱受体(AChR)抗体阳性,或新斯的明试验阳性且随访证实为MG。
1.2 方法
1.2.1 临床资料的收集:由一位有10年以上MG诊治经验的医师A对MG患者详细询问病史,进行疲劳试验、新斯的明试验及RNS检查,排除不能配合完成这些检查者。记录每步检查的详细原始资料。(1)病史内容包括:①眼外肌:眼睑下垂、复视、斜视。②面肌:闭目无力、撅嘴无力。③球部肌群:咀嚼困难、吞咽困难、喝水返呛、呛咳、声音低沉、鼻音。④颈部肌群:颈部发酸、抬头困难。⑤上下肢带肌及远端肌群:举臂无力、上楼费力、站起费力、手指无力、握力差。⑥呼吸肌:气短、憋气。同时记录可能影响疲劳试验结果的其他疾病。(2)疲劳试验包括:上睑疲劳试验、眼球活动、复视、埋睫征、屈颈抬头、侧平举、直腿抬高、声音异常、憋气等9项内容,均定量评价并记录原始资料。(3)新斯的明试验:甲基硫酸新斯的明0.02mg/kg[2]肌肉注射,阿托品0.5~1mg肌肉注射对抗毒蕈碱样不良反应。于注射后20、40、60min再次行疲劳试验并记录原始资料。(4)RNS检查:以2、3或5Hz刺激面神经、腋神经、正中神经或尺神经,至少1条神经上有2个频率刺激引出波幅递减>10%才视作阳性[1,3]。
1.2.2 评价方法:由A医师对每个病例依下述4个步骤判断受累肌群以及进行改良的Osserman[4]和MGFA分型[5]。步骤1:根据病史判断。步骤2:根据病史+疲劳试验判断。步骤3:根据病史+疲劳试验+新斯的明试验判断。步骤4:根据病史+疲劳试验+新斯的明试验+RNS判断。
将64例患者上述各项检查的原始资料分发给2名MG诊治经验2年的神经科医师B1、B2,及2名MG诊治经验6个月以内的神经科医师C1、C2,每位医师据此结合自己经验和对文献的理解独立判断临床分型,判断前并未进行统一培训,各医师之间不允许讨论。
1.3 统计学处理 统计A医师通过上述每步检查对受累肌群和分型判断的结果。对步骤1~3中的每步与上一步进行比较,以及对最终步骤(步骤3)和步骤1进行比较,观察受累肌群和分型的改变。采用Kappa检验(SPSS 19.0软件)分析5位医师经过每一步检查后判断的分型在两两之间的可重复性。
2 结果
2.1 医师A对MG患者行Osserman分型和MGFA分型的结果 具体结果见表1。
2.2 医师A在各步骤对受累肌群及分型的判断
2.2.1 步骤2与步骤1比较:35例(54.7%)受累肌群发生改变,其中32例受累肌群增加(颈部肌群22例;面部肌群17例;上下肢带肌9例;眼外肌3例),3例受累肌群减少(颈部肌群2例;上下肢带肌1例)。11例Osserman分型发生改变,其中8例由Ⅰ型变为Ⅱa型,原因:发现病史未提示的肌肉受累;2例由Ⅱa型变为Ⅰ型,1例由Ⅲ型变为Ⅱb型,原因:病史提示肌肉受累但疲劳试验正常。21例MGFA分型发生改变,其中8例由Ⅰ型变为Ⅱa型,原因:发现病史未提示的受累肌群;2例由Ⅱa型变为Ⅲa型,5例由Ⅱb型变为Ⅲb型,1例由Ⅱb型变为Ⅳb型,1例由Ⅲb型变为Ⅳb型,原因:疲劳试验提示的肌无力程度较病史所示严重;1例由Ⅲb型变为Ⅱb型,1例由Ⅳb型变为Ⅲb,原因:疲劳试验提示的肌无力程度较病史所示轻微;1例由Ⅲa型变为Ⅰ型,1例由Ⅱb型变为Ⅰ型,原因:病史提示肌肉受累但疲劳试验正常。
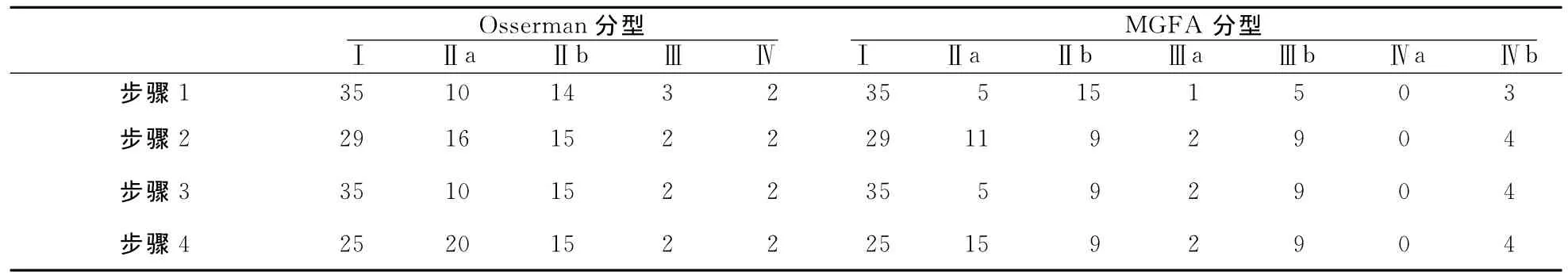
表1 医师A每一步骤判断Osserman分型和MGFA分型的结果(例)
2.2.2 步骤3与步骤2比较:9例(14.1%)受累肌群减少(颈部肌群8例,上下肢带肌2例)。6例Osserman分型和MGFA分型发生改变,均为Ⅱa型变为Ⅰ型。原因:疲劳试验发现的受累肌群在注射新斯的明后无改善,进一步询问发现其中3例有颈椎病,2例有腰椎病,另1例未发现潜在影响疾病。由Ⅱa型变为Ⅰ型者与“2.2.1”中由Ⅰ型变为Ⅱa型者均非同一患者。
2.2.3 步骤4与步骤3比较:25例(39.1%)受累肌群增加(面部肌群7例,上肢近端肌群11例,四肢远端肌群13例)。如果将有RNS异常者作为全身型,则10例Osserman分型和MGFA分型发生改变,均由Ⅰ型变为Ⅱa型,原因:RNS发现病史和疲劳试验均未发现的亚临床受累(肢体或面部肌肉RNS递减)。
2.2.4 步骤3与步骤1比较:31例受累肌群改变,其中26例受累肌群增加,5例受累肌群减少。7例Osserman分型改变;17例MGFA分型改变。纵观各步骤,两种分型系统判断为Ⅰ型者的改变相似,主要源自对眼肌以外肌群受累的判断;Ⅲ和Ⅳ型的判断相近且各步改变不大。Osserman分型的改变主要在Ⅰ型和Ⅱa型之间,而MGFA分型的改变显著多于Osserman分型的改变。
2.3 不同诊治经验的医师对MG分型判断的一致性 各医师之间两两进行Kappa检验,各步的平均Kappa值分别为:依据病史判断Osserman分型为0.809,判断 MGFA分型为0.668;依据病史+疲劳试验判断Osserman分型为0.701,判断MGFA分型为0.563;依据病史+疲劳试验+新斯的明试验判断Osserman分型为0.664,判断MGFA分型为0.532;均P<0.01。各步Osserman分型的重复性均优于MGFA分型。
3 讨论
详细询问病史是MG临床分型的基础。本研究发现,虽然该步骤医师间的可重复性较高,但通过第2步骤及第3步骤与第1步骤比较提示仅靠病史判断受累肌群和临床分型与后续步骤和最终判断的差别较大。所有检查者根据原始资料做出的判断均可出现错误,这是由于患者提供的病史未能充分反映其实际受累。
经疲劳试验检查后发现有半数以上病例的受累肌群增加,主要为颈部和面部肌群,其次为上下肢带肌,提示疲劳试验可发现潜在的受累肌群,避免将症状较轻的全身型 MG(generalized MG,GMG)诊为眼肌型MG(ocular MG,OMG,其定义为临床上仅有眼外肌受累而无其他肌群受累且不考虑电生理结果[4-5])。步骤2与步骤1比较,11例Osserman分型和21例MGFA分型发生改变,提示疲劳试验对MG分型影响较大;步骤3与步骤2比较仍存在差异,6例Osserman分型和MGFA分型发生改变,但较步骤2与步骤1比较时的改变少。故在分型时应重视进行规范完整的疲劳试验。
新斯的明作用时间相对长,可较好地观察患者肌无力症状的改善情况,且安全性好、敏感性高。Roh等[6]报道新斯的明试验诊断GMG的敏感性为98%,诊断OMG为79%。肌注新斯的明后多数患者在10~20min开始起效,20~40min作用最明显,40~60min后肌无力症状开始复原[7]。新斯的明试验后9例受累肌群减少,主要为颈部肌群和下肢带肌,6例Osserman分型和MGFA分型由Ⅱa型改为Ⅰ型,其中5例存在颈椎或腰椎疾病,提示MG患者的疲劳症状并非全部由MG本身所致,此时要进一步寻找合并疾病。新斯的明试验使受累肌群判断的特异性提高,修正了眼肌型和全身型的判断。至此,通过完善病史+疲劳试验+新斯的明试验检查能够对每个患者做出最准确的分型。
RNS在GMG中的敏感性高于OMG,特异性在 GMG和 OMG 均较高[8]。陈玉萍等[9]研究结果与之相符,并报道部分OMG患者眼外肌以外的肌肉存在RNS递减。根据公认的RNS阳性标准,本研究发现25例(39.1%)患者存在仅通过病史和疲劳试验未能发现的受累肌群,并在10例之前判断为OMG的患者发现低频RNS阳性。如果认为眼外肌以外的肌肉存在RNS递减现象就是GMG[10],则这10例的分型可转变为GMG。但目前缺乏只有临床上眼外肌受累者RNS阳性是否为真正的全身型或是否会发展成全身型的前瞻性研究,且Osserman分型和MGFA分型均无RNS的要求,故本研究采用了病史+疲劳试验+新斯的明试验作为分型的判断依据。
该研究结果显示,第1、2、3步骤Osserman分型判断的差异主要在Ⅰ型和Ⅱa型,且步骤1和步骤3总体分型判断的结果似乎更一致,但分析每位患者的资料发现,新斯的明试验后分型改变的患者与疲劳试验后分型改变的患者并不完全一致,提示具体到每个患者时,疲劳试验和新斯的明试验对最终分型的判断均有价值。步骤1和步骤2中MGFA分型结果差异较大,步骤2和步骤3的结果较一致,MGFA分型对眼肌型和全身型的判断与Osserman分型系统接近,但病情轻、中、重的判断主要受疲劳试验的影响,而新斯的明试验对疾病严重程度的判断意义不大。本研究还发现步骤2与步骤1比较MGFA分型改变的比例明显多于Osserman分型,表明根据病史判断获得的Osserman分型较MGFA分型更可靠,这与MGFA分型系统并未对严重程度进行详细定义而区分轻、中、重有关。综上所述,系统询问病史和疲劳试验在MG判断受累肌群及分型中有重要意义,新斯的明试验可使受累肌群判断的特异性提高,修正眼肌型和全身型的判断。低频RNS检查有助于发现潜在的受累肌群。经过系统的临床检查,将明显获得可靠的临床分型。
本研究采用医师A检查获得的原始资料,请另外4位有不同MG诊治经验的医师按照自己经验和对文献的理解来独立判断分型。各医师两两之间分型判断的平均Kappa值范围为0.532~0.809。按照 Landis等[11]对 Kappa值的划分,提示不同诊治经验的医师根据系统的临床检查结果判断MG分型可得到较一致的结论。
分析不同步骤各医师间分型判断的可重复性发现,每步Osserman分型均优于MGFA分型。Osserman分型主要依据受累范围、疾病进展速度等指标,简单明了,容易准确判断。而MGFA分型除了判断主要受累肌群外,还要判断疾病程度,该分型的提出者也认为严重程度的判断很难在不同评价者间取得一致[5]。分析各医师的MGFA分型结果发现分歧主要出现在Ⅱ、Ⅲ、Ⅳ型,故认为分型可重复性欠佳主要与各医师判断患者病情时存在主观差异有关。各医师根据病史+疲劳试验结果(步骤2)进行分型的可重复性(Osserman分型和MGFA分型的平均Kappa值分别为0.701和0.563)较单纯根据病史分型(步骤1)的可重复性(Osserman分型和MGFA分型的平均Kappa值分别为0.809和0.668)差,表明不同医师根据相同的疲劳试验结果判断同一患者病情轻重时存在的差异较判断是否仅有眼外肌受累时存在的差异更大。各医师根据病史+疲劳试验+新斯的明试验(步骤3)结果进行分型的可重复性(Osserman分型和MGFA分型的平均Kappa值分别为0.664和0.532)与步骤2接近。
本研究入选患者的临床分型和病程具有代表性,符合临床实践,疲劳试验和新斯的明试验均规范进行,经过多层次多方面的比较可得到可靠的结论。但本研究亦存在以下不足:(1)新斯的明试验阳性标准还不成熟,各医师对其结果的判断均根据自身临床经验获得,可能会使可重复性下降,但这符合临床工作实际,且本研究发现分型主要依赖疲劳试验,新斯的明试验的影响较小,故对分型可重复性的分析具有合理性。(2)评价医师间可重复性时采用一人采集资料多人评价的方法,并非真正意义上的多人评价。但MG具有易疲劳的特点,患者多次被测后因疲劳后而使测得的结果并不能真实反映患者病情,人为导致可重复性下降。即使不在同一天检查,也会因学习曲线使患者提供的病史越来越完全。而且不可能让同一患者完成5次新斯的明试验。一人检查记录原始资料分发给多人评价的方法在MG已有应用,认为其能可靠反映操作的可重复性[12]。(3)由 MG诊治中心的有一定诊治经验的专业医师完成,非MG专业医师间的可重复性可能较上述结果差。正是为此,医师要经过系统培训后对MG患者进行规范化的临床检查才能更准确判断分型。(4)纳入本研究者为15岁以上患者和合作较好者,对儿童和合作差的患者,可重复性可能较本研究结果差。
[1]中华医学会神经病学会神经免疫学组,中国免疫学会神经免疫学分会.中国重症肌无力诊断和治疗专家共识[J].中国神经免疫学和神经病学杂志,2011,18:368-372.
[2]Debates MH,Oosterhuis HJGH.Myasthenia Gravis[M].Boca Raton:CRC press,1993.207.
[3]AAEM Quality Assurance Committee,American Association of Electrodiagnostic Medicine.Practice parameter for repetitive nerve stimulation and single fiber EMG evaluation of adults with suspected myasthenia gravis or Lambert-Eaton myasthenic syndrome:summary statement[J]. Muscle Nerve,2001,24:1236-1238.
[4]Osserman KE,Genkins G.Studies in myasthenia gravis:review of a twenty-year experience in over 1200patients[J].Mt Sinai J Med,1971,38:497-537.
[5]Jaretzki A 3rd,Barohn RJ,Ernstoff RM,et al.Myasthenia gravis:recommendations for clinical research standards.Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America[J].Neurology,2000,55:16-23.
[6]Roh HS,Lee SY,Yoon JS.Comparison of clinical manifestations between patients with ocular myasthenia gravis and generalized myasthenia gravis[J].Korean J Ophthalmol,2011,25:1-7.
[7]彭丹涛,许贤豪,佘子瑜.新斯的明试验改良结果判定法研究[J].中国神经免疫和神经病学杂志,2007,14:1-3.
[8]Benatar M.A systematic review of diagnostic studies in myasthenia gravis[J].Neuromuscul Disord,2006,16:459-467.
[9]陈玉萍,王卫,魏东宁.低频重复电刺激检查在重症肌无力诊断中的临床意义[J].中华医学杂志,2011,91:1178-1180.
[10]许贤豪.神经免疫学[M].北京:北京医科大学中国协和医科大学联合出版社,1993.123.
[11]Landis JR,Koch GC.The measurement of observer agreement for gategorical data[J].Biometrics,1977,33:159-174.
[12]D’Alessandro R,Casmiro M,Benassi G,et al.Reliable disability scale for myasthenia gravis sensitive to clinical changes[J].Acta Neurol Scand,1995,92:77-82.
