重度子痫前期患者胎盘组织中Wnt1的表达*
2013-11-21张琳琳贾莉婷
张 展,李 鹤,张琳琳,贾莉婷,王 鹏
1)郑州大学第三附属医院检验科 郑州 450052 2)郑州大学第三附属医院妇产科 郑州 450052
子痫前期是一种常见的人类妊娠期特有疾病,它属于妊娠期高血压疾病的一种,其发病率国内报道为9.4%,国外报道为7%~12%[1],可引起严重的母儿并发症,是导致孕产妇和围生儿死亡的主要原因之一[2-3]。胎盘是母胎接触面,临床观察发现在妊娠结束胎盘娩出后,子痫前期的病情可得到迅速控制,所以不少学者[4]认为,子痫前期的发病与胎盘功能失调密切相关。滋养细胞是胎盘的主要细胞类型,其正常分化、增殖、凋亡、迁移和浸润能力是胚胎着床及胎盘形成的关键。而滋养细胞侵袭不足,胎盘组织凋亡导致胎盘浅着床及胎盘着床部位子宫螺旋动脉重铸障碍,是子痫前期发病的关键[5-6]。Wnt信号传导通路是调控细胞生长发育和分化的关键途径之一[7]。Wnt1是Wnt经典通路的始动因子之一,在多种恶性肿瘤组织中高表达,参与肿瘤的形成[8]。最近研究[9-12]发现Wnt信号通路在滋养细胞分化及侵袭过程中也起到了重要作用。而该通路是否参与了子痫前期的发病过程,以及在子痫前期发病过程中作用的相关研究还鲜有报道。该研究通过检测重度子痫前期及正常孕妇妊娠晚期胎盘组织中Wnt1的表达情况,初步探讨Wnt1在重度子痫前期发病过程中的作用。
1 对象与方法
1.1研究对象选择2010年1月至2011年12月在郑州大学第三附属医院产科住院,临床确诊为重度子痫前期的患者30例作为病例组(sPE组),患者年龄20~38(29.2±5.5)岁,孕(36.6±1.1)周,重度子痫前期诊断标准参照人民卫生出版社出版的第7版《妇产科学》[13]。同期选取行择期剖宫产的正常晚孕孕产妇30例为正常对照组(N组),孕产妇年龄23~37(30.7±3.4)岁,孕(37.2±1.0)周。2组孕产妇均为单活胎、剖宫产,既往均无高血压病、糖尿病、肾病、抗磷脂综合征、多囊卵巢综合征以及其他妊娠合并症病史。
1.2主要试剂Trizol为Invitrogen公司产品,逆转录试剂盒购自大连宝生物工程有限公司,引物由上海生工生物工程技术服务有限公司合成,UltraSYBR Mixture(With ROX)试剂购自北京康为世纪生物科技有限公司,兔抗人Wnt1多克隆抗体购自Abcam公司,兔抗人β-actin多克隆抗体购自博奥森生物技术有限公司,辣根酶标记山羊抗兔IgG购自北京鼎国昌盛生物技术有限责任公司,Pro-light HRP化学发光检测试剂购自天根生化科技有限公司,免疫组化二步法试剂盒及浓缩型DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3标本采集经孕产妇知情同意,在胎盘娩出后15 min内避开胎盘边缘及钙化、出血、坏死处,分别于胎盘母体面3、6、9、12点处以及中心位置取5块胎盘全层组织,大小约2 cm×2 cm×1 cm,无菌滤纸反复吸取组织上的血液,取下的胎盘组织一部分放入体积分数10%的甲醛溶液中固定备用,剩余的组织分装入无菌冻存管后迅速放入液氮罐内,然后置于-80 ℃冰箱冻存备用。
1.4胎盘组织中Wnt1mRNA表达的检测在液氮预冷的研钵中加入100 mg胎盘组织研磨至粉末状,Trizol法提取胎盘组织总RNA。10 g/L琼脂糖凝胶电泳检测所提RNA质量,将所提RNA逆转录为cDNA,-80 ℃冻存备用。Wnt1上游引物序列5’-TCCTCCAC GAACCTGCTTAC-3’,下游引物序列5’-CGGATTTTG GCGTATCAGAC-3’,扩增片段大小为105 bp;GAPDH上游引物序列5’-TCGTGGAAGGACTCATGACC-3’,下游引物序列5’-AGGGATGATGTTCTGGAGAG-3’,扩增片段大小为116 bp。按照荧光定量PCR试剂盒反应说明书配制反应体系,总体积为20 μL。阴性对照以RNase-free H2O代替cDNA模板,加样至96孔板中,每个样品均设2个复孔,上Real-time PCR 仪反应,反应条件为95 ℃ 10 min,95 ℃ 20 s,60 ℃ 1 min,35个循环。反应结束后记录扩增曲线及熔解曲线。根据扩增曲线可得到扩增产物达到设定阈值所经历的循环数(Ct),采用2-ΔΔCt方法[14]分析Wnt1 mRNA相对表达量。
1.5免疫组化二步法检测胎盘组织中Wnt1蛋白的表达情况石蜡包埋的胎盘组织切片,厚度约4 μm且包含母体面至胎儿面全层。操作步骤按免疫组化PV二步法试剂盒说明书进行, Wnt1一抗按照1︰100稀释,DAB显色。再经苏木素复染、盐酸乙醇分化,梯度乙醇脱水、二甲苯透明,中性树胶封固晾干后在显微镜下观察。用PBS代替一抗作为阴性对照,以胎盘组织中细胞膜、细胞质或细胞间质内出现棕黄或棕褐色着色为阳性显色。采用半定量积分法。染色强度评分:无着色0分,浅黄色1分,棕黄色2分,棕褐色3分。每张切片在高倍镜(×400)下选择5个视野,每个视野计数100个细胞,按阳性细胞所占百分比评分:<20%1分,20%~2分,40%~3分,65%~4分。结果取2项评分的乘积,<3分为阴性,≥3分为阳性。
1.6蛋白印迹法检测胎盘组织中Wnt1蛋白的表达情况使用RIPA细胞裂解液及PMSF裂解胎盘组织,提取组织中总蛋白,BCA法测定蛋白浓度后-80 ℃冻存备用。取100 μg总蛋白,100 ℃变性后上样,使用100 g/L分离胶、50 g/L积层胶进行SDS-PAGE凝胶电泳,电泳后将蛋白转移至硝酸纤维素膜(NC膜),使用脱脂奶粉37 ℃封闭NC膜1 h,加入一抗4 ℃孵育过夜,Wnt1一抗稀释比例1︰100,β-actin为1︰1 000,一抗孵育完毕TBST洗10 min×3次后加入二抗37 ℃孵育1 h,TBST洗膜10 min×3次后加增强化学发光显色液,暗室内曝光显影,胶片晾干后拍照,使用Image J测灰度值,以目的蛋白条带与β-actin条带灰度值比值作为目的蛋白的相对表达水平。
1.7统计学处理采用SPSS 17.0进行统计学分析。2组胎盘组织中Wnt1 mRNA及蛋白相对表达水平的比较采用两独立样本的t检验, 2组胎盘组织中Wnt1蛋白在合体滋养层细胞及绒毛外滋养细胞中的阳性表达率的比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 2组胎盘组织中Wnt1mRNA的表达2组孕产妇胎盘组织中均可检测到Wnt1 mRNA的表达,sPE组Wnt1 mRNA表达水平低于N组,见表1。
2.2 2组胎盘组织中Wnt1蛋白表达的定位Wnt1蛋白主要表达在胎盘合体滋养层细胞上,此外其在侵入底蜕膜的绒毛外滋养细胞上也有表达,免疫组化结果显示合体滋养层细胞及绒毛外滋养细胞的细胞膜及细胞质呈棕黄色着色。Wnt1蛋白在2组胎盘组织中均有表达(图1)。2组胎盘组织中Wnt1蛋白在合体滋养层细胞及绒毛外滋养细胞中的阳性表达率比较见表2。

图1 Wnt1蛋白在胎盘合体滋养层细胞及绒毛外滋养细胞上的表达(PV二步法,×200)

表1 2组胎盘组织中Wnt1mRNA和蛋白的相对表达量比较
表2Wnt1蛋白在合体滋养层
细胞及绒毛外滋养细胞的表达

阳性例数(%)
2.3 2组胎盘组织中Wnt1蛋白相对表达量比较
2组孕产妇胎盘组织中均可检测到Wnt1蛋白的表达,且sPE组Wnt1蛋白相对表达量低于N组,见图2及表1。
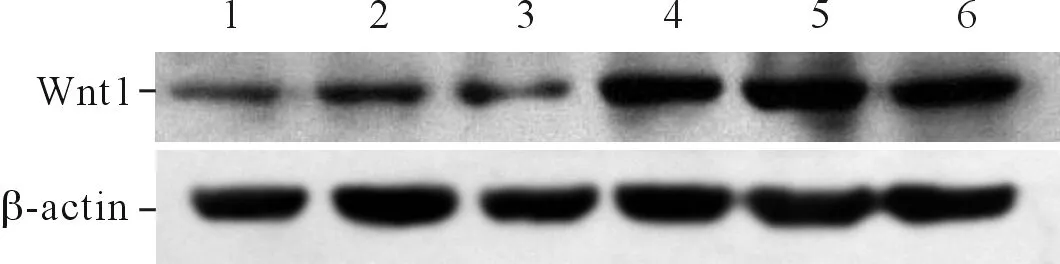
图2 2组胎盘组织中Wnt1蛋白的表达
3 讨论
3.1Wnt信号通路在妊娠过程中的作用有学者[6]利用半定量PCR技术检测了所有已知的Wnt配体及其卷曲受体在人胎盘组织及不同阶段的滋养细胞系中的表达情况,发现19种已知Wnt配体中的14种及10种已知卷曲受体中的8种在胎盘组织中都有表达,且其表达特性会随着孕龄及滋养细胞系类型不同发生变化。Wnt信号通路的另一种配体Wnt3a可刺激滋养细胞侵袭和迁移过基底膜基质,这提示了Wnt信号通路可能参与了滋养细胞增殖、分化、侵袭、迁移的过程,该通路过度激活可能导致滋养细胞过度增生和局部侵犯[7]。Wnt信号通路作为调控滋养细胞及胎盘定植过程的重要通路之一,在妊娠过程中起重要作用,而子痫前期是妊娠期特有的疾病,滋养细胞侵袭力下降,凋亡增加,胎盘血管重铸障碍,胎盘功能紊乱从而导致子痫前期的发病。
3.2Wnt1与子痫前期发病的关系Wnt1基因定位于人类12q13染色体上,它是Wnt信号通路的始动因子,其通过激活Wnt/β-catenin经典通路来抑制细胞凋亡,促进细胞侵袭及血管生成等作用参与肿瘤的形成。在不同的人类癌症细胞系中(包括乳癌、间皮瘤、非小细胞肺癌、肉瘤)应用Wnt1的单克隆抗体和RNAi抑制Wnt1的功能,发现细胞凋亡增加,故可以推测Wnt1可以抑制细胞凋亡[15]。将血管内皮细胞放在含有Wnt1的培养基培养,发现内皮细胞的Wnt经典信号通路活化,细胞增殖及毛细血管稳定性加强[16]。Wnt1的表达可促进毛细血管样网络的形成,IL-8作为一种血管生成因子,是Wnt信号通路在血管内皮细胞作用的靶点,Wnt1可诱导IL-8的转录和分泌[17]。最近发现Wnt1在体外培养的人类早孕及晚孕期滋养细胞及纤维母细胞、早孕期绒毛外滋养细胞、早孕及晚孕期胎盘组织中均有表达,而在具有绒毛外滋养细胞特性的SGHPL-5 细胞系和JEG-3 绒毛膜癌细胞系中不表达[9]。
该研究发现,sPE组及N组孕产妇晚孕期胎盘组织中均可检测到Wnt1 mRNA表达,这与以往报道[12]一致。作者比较了2组胎盘组织中Wnt1 mRNA及蛋白的表达水平,sPE组Wnt1 mRNA及蛋白表达水平均低于N组。由此推测,Wnt1 mRNA及蛋白表达水平下降,有可能影响到了滋养细胞正常功能,导致滋养细胞凋亡增加,增殖、侵袭、迁移能力下降,胎盘浅着床进而导致子痫前期的发生。另外该研究还发现,Wnt1蛋白主要表达在胎盘合体滋养层细胞上,此外其在侵入底蜕膜的绒毛外滋养细胞上也有表达。早期胎盘发育需要更多的母体血液供应,这种需要最终通过对母体子宫螺旋动脉的广泛重塑来完成。血管重塑需依靠一种具有类似肿瘤细胞生物学行为的绒毛外滋养细胞来完成,而很多子痫前期病例中,滋养细胞侵袭性下降,螺旋动脉重塑不足,以致胎盘循环量太小[18-20]。而该研究发现, Wnt1蛋白在sPE组合体滋养层细胞和绒毛外滋养细胞中的阳性表达率均低于N组,进一步提示Wnt1可能是通过影响滋养细胞功能来参与子痫前期的发病。
3.3结论总之,子痫前期是一个多因素参与的复杂的病变过程,而该研究提示,胎盘组织中Wnt1的表达量下降可能参与了子痫前期的发病过程。当然,早孕、中孕期胎盘组织中Wnt1的表达情况及完整的Wnt通路在子痫前期中发挥的作用还有待进一步研究。
[1] 冷雪梅.78例重症妊娠高血压疾病患者妊娠结局分析[J].吉林大学学报:医学版,2008,34(4):593
[2] 李留霞,吴改英,王宁,等.子痫前期患者胎盘组织中内皮分化基因2的表达[J].郑州大学学报:医学版,2012,47(4):497
[3] 陈丽红,邱中原,胡继芬.子痫前期患者胎盘中p38MAPK及COX-2的表达及意义[J].第三军医大学学报,2012,34(6):521
[4] 李雪兰,李春芳,王少丽,等.survivin蛋白及其mRNA在子痫前期患者胎盘中的表达[J].西安交通大学学报:医学版,2010,31(5):631
[5] Pennington KA, Schlitt JM, Jackson DL, et al. Preeclampsia: multiple approaches for a multifactorial disease[J]. Dis Model Mech, 2012, 5(1):9
[6]Niehrs C, Acebron SP. Wnt signaling: multivesicular bodies hold GSK3 captive[J]. Cell, 2010, 143(7):1044
[7] MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009, 17(1):9
[8] Korzh V. Winding roots of Wnts[J]. Zebrafish, 2008, 5(3):159
[9] Sonderegger S, Husslein H, Leisser C, et al. Complex expression pattern of Wnt ligands and frizzled receptors in human placenta and its trophoblast subtypes[J].Placenta, 2007, 28(Suppl A):S97
[10]Pollheimer J, Loregger T, Sonderegger S, et al. Activation of the canonical wingless/T-cell factor signaling pathway promotes invasive differentiation of human trophoblast[J]. Am J Pathol, 2006, 168(4):1134
[11]Fitzgerald JS, Germeyer A, Huppertz B, et al. Governing the invasive trophoblast: current aspects on intra- and extracellular regulation[J]. Am J Reprod Immunol, 2010, 63(6):492
[12]Sonderegger S, Pollheimer J, Knofler M. Wnt signalling in implantation, decidualisation and placental differentiation-review[J]. Placenta, 2010, 31(10):839
[13]乐杰.妇产科学[M].7版.北京:人民卫生出版社,2008:92
[14]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods, 2001, 25(4): 402
[15]He B, You L, Uematsu K, et al. A monoclonal antibody against Wnt-1 induces apoptosis in human cancer cells[J]. Neoplasia, 2004, 6(1):7
[16]Goodwin AM, Kitajewski J, D' Amore PA. Wnt1 and Wnt5a affect endothelial proliferation and capillary length; Wnt2 does not[J]. Growth Factors, 2007, 25(1):25
[17]Masckauchan TN, Shawber CJ, Funahashi Y, et al. Wnt/beta-catenin signaling induces proliferation, survival and interleukin-8 in human endothelial cells [J]. Angiogenesis,2005,8(1):43
[18]杨博萍,韩健,韩新美,等.重度子痫前期胎盘合体滋养细胞微绒毛膜脱落与Rho/ROCK分子表达的关系[J].解放军医学杂志,2012,37(3):190
[19]刘大艳,陈士岭,王晨虹,等.早发型与晚发型重度子痫前期患者绒毛组织代谢足迹差异的研究[J].南方医科大学学报,2011,31(9):1547
[20]冯亚玲,梁小勤,周昌菊.Rho-GDI在子痫前期蜕膜组织中的表达及其意义[J].南方医科大学学报,2011,31(1):167
