亚低温减轻氧糖剥夺所致的大鼠海马神经元损伤*
2013-11-07周天恩杨正飞蒋龙元
周天恩, 张 萌, 杨正飞, 蒋龙元
目前在临床上亚低温(31~32℃)已广泛用于治疗缺血、缺氧性脑病。亚低温可通过降低脑组织氧耗量,抑制氧自由基生成和释放以及抑制脑缺血缺氧后的炎性反应对中枢神经系统起保护作用,但其保护作用的分子机制尚不明确。近来有研究发现[1-2],亚低温可通过减少神经元凋亡从而改善缺血、缺氧性脑病的神经功能。细胞凋亡与caspase蛋白酶家族密切相关,所以亚低温神经保护作用的机制可能与 caspase蛋白酶家族相关。Caspase-3是caspase蛋白酶家族的重要成员之一,是执行凋亡的重要效应分子,本实验拟研究caspase-3在亚低温减轻大鼠海马神经元氧糖剥夺(oxygen-glucose deprivation,OGD)损伤中的作用。
材料和方法
1 材料
1.1 动物 SPF级健康新生(1~3 d)Sprague-Dawley(SD)大鼠,雌雄不限,由中山大学北校区实验动物中心提供。动物生产许可证号为SCXK(粤)2011-0029。将新生乳鼠消毒后剪开头皮与颅骨,分离取出海马组织。
1.2 主要仪器 Galaxy A三气培养箱 (RS Biotech);倒置荧光相差显微镜T2000U(Nikon);电子显微镜(中山大学北校区电子显微镜室);全自动酶标仪(Dragon);7600-010全自动生化分析仪 (Hitachi);流式细胞仪 Facscalibur(Becton Dickinson);Anke TDL-40B高速离心机(上海安亭);低温离心机(Eppendorf)。
1.3 主要试剂 DMEM/F12培养基 (Gibco);胎牛血清(HyClone);B27(Invitrogen);多聚赖氨酸(Sigma);阿糖胞苷(上海华联公司);Triton X-100(Amresco);兔抗微管相关蛋白2(microtubule-associated protein 2,MAP2)多克隆抗体(Chemicon);山羊抗兔Cy3连接Ⅱ抗(Chemicon);Hoechst 33258(Sigma);台盼蓝(武汉博士德);胰蛋白酶(Sigma);碘化丙啶(propidium iodide,PI;Sigma);Annexin V-FITC 凋亡检测试剂盒(Bender Medsystems);蛋白裂解液(Cell Signaling);caspase-3比色测定试剂盒(Biovision);PBS 液(自配):取 NaCl 8.00 g,KCl 0.20 g,Na2HPO4·H2O 1.56 g,KH2PO40.20 g,溶于三蒸水中,充分搅拌溶解后,加水至1 000 mL,调节pH值7.4,微孔滤器过滤除菌;无糖Earle's液(自配):取NaCl 6.80 g,KCl 0.40 g,CaCl20.20 g,MgSO4·7H2O 0.20 g,NaH2PO4·2H2O 1.14 g,NaHCO32.20 g,溶于三蒸水,搅拌溶解,加水至1 000 mL,调节 pH 值7.4,微孔滤器过滤除菌。
2 方法
2.1 细胞培养 0.1 g/L多聚赖氨酸包被培养皿3 d。取出生1~3 d SD乳鼠,消毒皮肤,依次剪开头皮与颅骨,迅速取出脑组织置于含4℃ PBS的培养皿。显微镜下分离海马组织,放入含DMEM/F12培养基的离心管中轻柔吹打,以1 500 r/min离心5 min,弃上清液,加入含10%胎牛血清的DMEM/F12重悬细胞。台盼蓝计数活细胞数量,以1×109/L密度将细胞接种于培养皿,置入37℃、5%CO2培养箱孵育。24 h后全量更换含2%B27的培养基,第3天加入5 μmol/L阿糖胞苷作用24 h,以后每3 d全量换液。观察神经元的生长及细胞形态,第8天行神经元MAP2免疫化学荧光鉴定。
2.2 实验分组及模型的建立 将实验细胞随机分为4组(n=6):即为正常对照组、单纯亚低温组、单纯OGD组和亚低温+OGD组。通过设置培养箱温度控制参数将亚低温组培养箱内温度自动控制在31~32℃。调设三气培养箱至缺氧状态(37℃,0.1%O2,5%CO2,94.5%N2),以此模拟细胞缺氧。将培养第8天的海马神经元取出,吸出培养基,加入无糖Earle's液2 mL,以此模拟神经元缺糖。本实验OGD时间为2 h,OGD后复氧、复糖24 h后处理送检,非OGD组与OGD组同时处理送检。
2.3 形态学观察 将各组细胞复氧复糖24 h后,去除细胞培养液,固定15 min,用细胞刮子将细胞刮下,以2 000~3 000 r/min的速度低温离心10 min,使细胞在离心管尖沉淀结块。4℃保存送电子显微镜室观察。
2.4 流式细胞术检测神经元凋亡 取各组细胞,复糖复氧24 h。胰酶消化后收集细胞离心,弃上清液,用结合缓冲液重悬细胞,加入Annexin V-FITC和PI,混匀后避光室温反应15 min,流式细胞仪检测凋亡率。凋亡率=早期凋亡率+中晚期凋亡率。
2.5 神经元胞浆内caspase-3活性检测 提取细胞浆内总蛋白,测定caspase-3的实际浓度,取200 μg caspase-3蛋白按caspase-3比色测定试剂盒要求处理,此后选择405 nm波长,在酶标仪上测定各孔吸光度值。Caspase活性升高倍数=实验组A值/正常对照组A值。
3 统计学处理
计量资料用均数±标准差(mean±SD)表示,样本均数间的比较采用方差分析,并行方差齐性检验,两组数据之间的相关研究采用直线相关分析。采用SPSS 13.0统计软件完成,以P<0.05为差异有统计学意义。
结 果
1 大鼠海马神经元培养与鉴定结果
培养第8天的大鼠海马神经元经MAP2免疫荧光染色后置于荧光显微镜下用绿光激发,神经元胞浆及轴突显红色荧光,胶质细胞的胞浆及轴突和所有细胞核不染色,见图1A;同时用Hoechst 33258进行的非特异性细胞核荧光染色,所有细胞核(包括胶质细胞核)染蓝色,见图1B。同一个视野2种染色结果比较后显示海马神经元占所培养细胞的90%以上。

Figure 1.Fluorescence microscopic images(×200).A:immunofluorescence staining of microtubule-associated protein 2(MAP2)in rat hippocampal neurons;B:Hoechst 33258 fluorescence staining of nuclei in all isolated cells.图1 MAP2免疫荧光染色及Hoechst 33258非特异性细胞核荧光染色结果
2 亚低温减轻OGD所致海马神经元形态学损伤并
降低神经元的凋亡率
各组海马神经元氧糖剥夺/复氧复糖培养24 h后分别用倒置光学显微镜和电子显微镜进行形态学观察,结果显示,神经元OGD后出现了胞体肿胀、包膜不完整、细胞器破坏等损伤表现,亚低温干预后细胞损伤程度明显减轻,见图2、3。流式细胞术结果显示,单纯亚低温组的神经元凋亡率(12.5% ±2.4%)与正常对照组神经元凋亡率(14.2% ±2.9%)比较无统计学差异;神经细胞OGD后凋亡率明显升高,单纯OGD组神经元凋亡率(42.9% ±4.3%)与亚低温+OGD组神经元凋亡率(28.3% ±3.2%)均明显高于正常对照组(P<0.01);亚低温+OGD组与单纯OGD组比较,神经元凋亡率下降,且差异有统计学意义(P <0.05),见图4。

Figure 2.The morphology of rat hippocampal neurons 24 h after reoxygenation and glucose reintroduction observed under light microscope(×400).A:control group;B:mild hypothermia group;C:OGD group;D:mild hypothermia+OGD group.图2 各组大鼠海马神经元复氧复糖24 h后的形态学变化

Figure 3.The ultrastructure of rat hippocampal neurons 24 h after reoxygenation and glucose reintroduction observed under electron microscope(×15 500~21 000).A:control group;B:mild hypothermia group;C:OGD group;D:mild hypothermia+OGD group.图3 各组大鼠海马神经元复氧复糖24 h后超微结构的变化
3 亚低温降低神经元凋亡率的同时降低神经元胞浆内caspase-3活性
单纯亚低温组caspase-3活性(121% ±17%)与正常对照组caspase-3活性(100% ±14%)比较无显著差异;神经细胞OGD后caspase-3活性明显升高,单纯OGD组caspase-3活性(353% ±31%)和亚低温+OGD组caspase-3活性(225% ±24%)均明显高于正常对照组(P<0.01);亚低温+OGD组与单纯OGD组比较,caspase-3活性下降,且差异均有统计学意义(P <0.05),见图5。
4 OGD后神经元凋亡率与神经元胞浆内caspase-3活性的相关性分析结果
OGD 2 h后神经元凋亡率(42.9% ±4.3%)与神经元胞浆内caspase-3活性(353% ±31%)呈显著正相关(r=0.823,P <0.05);亚低温 +OGD 2 h 后神经元凋亡率(28.3% ±3.2%)与神经元胞浆内caspase-3活性(225% ±24%)亦呈显著正相关(r=0.841,P <0.05)。
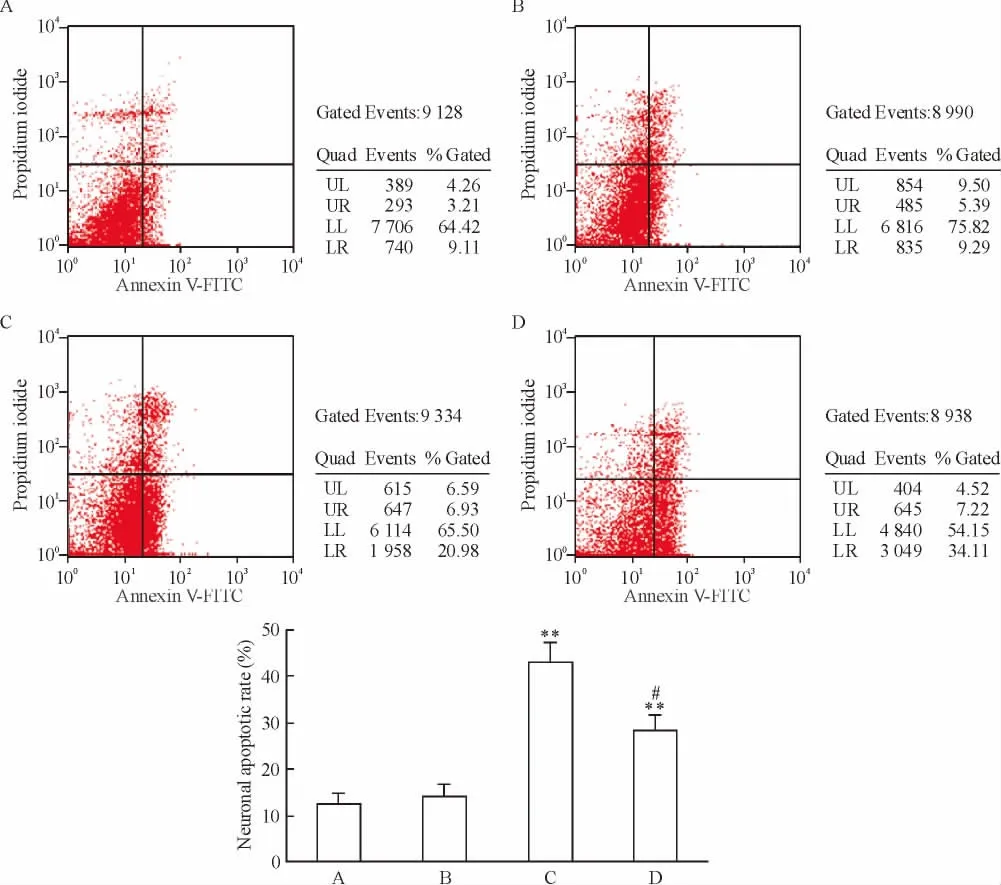
Figure 4.The apoptosis of rat hippocampal neurons detected by flow cytometry.A:control group;B:mild hypothermia group;C:OGD group;D:mild hypothermia+OGD group.Mean ±SD.n=6.**P <0.01 vs control group;#P <0.05 vs OGD group.图4 流式细胞术检测各组大鼠海马神经元的凋亡

Figure 5.Comparison of caspase-3 activity in the cytoplasm of rat hippocampal neurons.Mean ± SD.n=6.**P <0.01 vs control group;#P <0.05 vs OGD group.图5 各组大鼠海马神经元胞浆内caspase-3活性比较
讨 论
1 神经元OGD损伤模型的方法学评价
体外培养的神经细胞保留了体内神经元的相关生理特性,目前已被广泛培养用来代替体内神经细胞进行实验研究[3-6]。体外OGD模型与体内模型相比,其能更简单、更准确地控制细胞外环境,因此常用来研究缺血、缺氧引起的生物化学及细胞形态学改变,亦常用来研究相关的分子生物学机制[7]。目前用OGD模型模拟体内神经元缺血、缺氧是研究的热点,此模型目前已被广泛用来研究缺血、缺氧性脑病[8-11]。
2 亚低温对OGD损伤神经元的保护作用
目前亚低温仍是脑缺血、缺氧损伤后治疗的关键。在临床研究方面,Yokoyama等[12]在日本进行了一个多中心调查研究发现,452个心肺复苏后恢复自主循环的患者均接受了亚低温治疗,中心体温控制在(33.9 ±0.4)℃,持续时间(31.5 ±13.9)h,结果发现30 d后存活率为80.1%,具有良好神经功能的比例有55.3%,这明显高于既往报道的未接受低温治疗的患者。在大体动物研究方面,有学者研究发现[13],在失血性休克大鼠模型中,33℃的亚低温治疗能明显提高生存率。Noguchi等[14]在沙鼠全脑缺血模型中研究发现,亚低温可抑制缺血/再灌注损伤及细动脉血管收缩,从而改善全脑缺血损伤的存活率。在体外培养的动物神经细胞方面,Dalen等[15]在体外培养的神经细胞OGD模型中研究发现,亚低温能明显提高神经元OGD后的存活率并减少炎症介质的生成,且其保护作用与复氧后氧浓度的高低无关。Liu等[16]在体外培养的大鼠脑切片OGD模型中研究发现,亚低温能改善细胞的新陈代谢,且低温时机越早越好。
本研究发现,亚低温干预能明显减轻OGD导致的神经元损伤,包括改善神经元的形态,以及降低神经元的凋亡率。但是亚低温具有潜在的副作用,其具体温度的控制和亚低温治疗的时间仍需要更进一步的研究。
3 亚低温对OGD损伤神经元保护的分子机制
亚低温可通过减少神经元凋亡从而改善缺血、缺氧性脑病的神经功能,而细胞凋亡与caspase家族密切相关。Caspase是一个半胱氨酸蛋白酶家族,在细胞凋亡的过程中起着关键性的作用,是凋亡的共同通路,其成员是caspase-3执行凋亡的重要效应分子,激活caspase-3之前称为凋亡的可逆阶段,之后称为凋亡的不可逆阶段。因此,降低caspase-3的活性可以有效抑制凋亡的发生发展。由于caspase-3与凋亡有密切的相关性,很多学者已将caspase-3作为检测指标,用来评估某方法或药物对大脑缺血、缺氧性损伤的治疗效果[17-20]。有研究表明,亚低温可抑制缺血再灌注损伤引起的 caspase-3活化[21],可降低H2O2诱导的心肌细胞损伤中的 caspase-3活性[22],还可减少缺血、缺氧性脑病新生儿血清中的caspase-3活性[23]。因此,亚低温治疗可能是通过降低缺氧缺血后caspase-3的活性,从而起到脑保护作用。
本研究发现,神经细胞OGD后caspase-3活性明显升高,与神经元凋亡率升高呈正相关,这说明神经细胞OGD后可能通过激活caspase-3,从而引发神经元程序性死亡,导致凋亡明显增加;亚低温+OGD组与单纯OGD组比较,caspase-3活性下降,同时神经元凋亡率亦明显下降,说明亚低温可能通过降低caspase-3活性从而抑制神经元的凋亡。本实验结果表明,降低caspase-3活性是亚低温对神经元OGD损伤保护作用的分子机制之一。亚低温对OGD损伤的保护作用的分子机制极其复杂,目前尚未完全明了,需要进一步研究。
[1] Li H,Wang D.Mild hypothermia improves ischemic brain function via attenuating neuronal apoptosis[J].Brain Res,2011,1368:59-64.
[2] Lin CH,Wu WS,Lin MT,et al.Attenuating ischemia-induced H9c2 myoblasts apoptosis by therapeutic hypothermia[J].Am J Med Sci,2010,339(3):258-265.
[3] Bai Y,Meng Z,Cui M,et al.An Ang1-Tie2-PI3k axis in neural progenitor cells initiates survival responses against oxygen and glucose deprivation [J].Neuroscience,2009,160(2):371-381.
[4] Labrande C,Velly L,Canolle B,et al.Neuroprotective effects of tacrolimus(FK506)in a model of ischemic cortical cell cultures:role of glutamate uptake and FK506 binding protein 12 kDa[J].Neuroscience,2006,137(1):231-239.
[5] Wang ZF,Tang XC.Huperzine A protects C6 rat glioma cells against oxygen-glucose deprivation-induced injury[J].FEBS Lett,2007,581(4):596-602.
[6] Lei Z,Ruan Y,Yang AN,et al.NMDA receptor mediated dendritic plasticity in cortical cultures after oxygen-glucose deprivation[J].Neurosci Lett,2006,407(3):224-229.
[7] Montero M,Poulsen FR,Noraberg J,et al.Comparison of neuroprotective effects of erythropoietin(EPO)and carbamylerythropoietin(CEPO)against ischemia-like oxygenglucose deprivation(OGD)and NMDA excitoto-xicity in mouse hippocampal slice cultures[J].Exp Neurol,2007,204(1):106-117.
[8] Savoia C,Sisalli MJ,Di Renzo G,et al.Rosuvastatin-induced neuro-protection in cortical neurons exposed to OGD/reoxygenation is due to nitric oxide inhibition and ERK1/2 pathway activation[J].Int J Physiol Pathophysiol Pharmacol,2011,3(1):57-64.
[9] Baltan S,Murphy SP,Danilov CA,et al.Histone deacetylase inhibitors preserve white matter structure and function during ischemia by conserving ATP and reducing excitotoxicity[J].J Neurosci,2011,31(11):3990-3999.
[10] Ziu M,Fletcher L,Rana S,et al.Temporal differences in microRNA expression patterns in astrocytes and neurons after ischemic injury[J].PLoS One,2011,6(2):e14724.
[11] Gwak MS,Cao L,Li L,et al.Isoflurane preconditioning reduces oxygen-glucose deprivation-induced neuronal injury via B-cell lymphoma 2 protein[J].Environ Toxicol Pharmacol,2011,31(1):262-265.
[12] Yokoyama H,Nagao K,Hase M,et al.Impact of therapeutic hypothermia in the treatment of patients with out-of-hospital cardiac arrest from the J-PULSE-HYPO study registry[J].Circ J,2011,75(5):1063-1070.
[13] Iwamoto S,Takasu A,Sakamoto T.Therapeutic mild hypothermia:effects on coagulopathy and survival in a rat hemorrhagic shock model[J].J Trauma,2010,68(3):669-675.
[14] Noguchi K,Matsumoto N,Shiozaki T,et al.Effects of timing and duration of hypothermia on survival in an experimental gerbil model of global ischaemia[J].Resuscitation,2011,82(4):481-486.
[15] Dalen ML,Frøyland E,Saugstad OD,et al.Post-hypoxic hypothermia is protective in human NT2-N neurons regardless of oxygen concentration during reoxygenation[J].Brain Res,2009,1259:80-89.
[16] Liu J,Litt L,Segal MR,et al.Outcome-related metabolomic patterns from1H/31P NMR after mild hypothermia treatments of oxygen-glucose deprivation in a neonatal brain slice model of asphyxia[J].J Cereb Blood Flow Metab,2011,31(2):547-559.
[17] Kuo JR,Lo CJ,Chang CP,et al.Brain cooling-stimulated angiogenesis and neurogenesis attenuated traumatic brain injury in rats[J].J Trauma,2010,69(6):1467-1472.
[18] Wang Z,Shi Q,Li S,et al.Hyperthermia induces platelet apoptosis and glycoprotein Ibalpha ectodomain shedding[J].Platelets,2010,21(3):229-237.
[19]张 霞,钱 涛,高维娟,等.JNK通路促进大鼠脑缺血再灌注海马神经元凋亡[J].中国病理生理杂志,2012,28(8):1431-1435.
[20]闫凤霞,钱 涛,高维娟,等.黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元钙调蛋白表达的影响[J].中国病理生理杂志,2011,27(9):1705-1714.
[21] Kunimatsu T,Kobayashi K,Yamashita A,et al.Cerebral reactive oxygen species assessed by electron spin resonance spectroscopy in the initial stage of ischemia-reperfusion are not associated with hypothermic neuroprotection[J].J Clin Neurosci,2011,18(4):545-548.
[22] Diestel A,Drescher C,Miera O,et al.Hypothermia protects H9c2 cardiomyocytes from H2O2-induced apoptosis[J].Cryobiology,2011,62(1):53-61.
[23] Liu CQ,Xia YF,Yuan YX,et al.Effects of selective head cooling with mild hypothermia on serum levels of caspase-3 and IL-18 in neonates with hypoxic-ischemic encephalopathy[J].Zhongguo Dang Dai Er Ke Za Zhi,2010,12(9):690-692.
