黑视素基因转染给光双极细胞部分恢复MNU诱导的视网膜感光细胞变性小鼠的视觉*
2013-11-07熊国吟罗小鹏杨昇炎
熊国吟, 罗小鹏, 杨昇炎, 徐 颖, 董 军△
视网膜色素变性(retinitis pigmentosa,RP)是一种眼科常见的遗传性疾病。全球发病率约在1/3 500[1]。其病理过程为视网膜感光细胞逐渐凋亡,最终导致中心视力的全部丧失。其视网膜电图(electroretinogram,ERG)a波和b波波形减弱甚至熄灭,视觉眼电图(electro-oculogram,EOG)波形光峰值和暗谷值均减小,甚至呈平坦型。眼底可观察到骨细胞样色素沉积。RP的遗传方式多样,单基因遗传占大多数。目前尚无长期有效的预防和治愈RP的方法。大多数患者RP的发生是由于单个基因发生变异,从而引起相应蛋白无法合成,进而影响感光细胞的发育或正常结构与功能维持。而转入相应正常基因则很有可能挽救因基因变异导致凋亡的感光细胞,甚至使其恢复正常水平。目前已有大量相关研究均成功地将正常基因导入多种RP动物模型[2]。临床实验也证明了其有效性和安全性[3]。然而常规基因治疗的缺陷在于必须针对患者缺陷基因和患者自身条件选择载体并设计治疗方案,其效率底、成本高。
近年来随着光感受蛋白的发现,一种新的基因治疗概念被提出:将光感受蛋白基因转导入发生退行性变视网膜的神经元中,使其直接对光照产生反应,从而恢复视觉[4]。研究表明,将一种外源性光感受蛋白——视紫质通道蛋白(channelrhodopsin-2,ChR2)基因定向转染进入视网膜变性模型rd1小鼠视网膜给光型双极细胞,在较强光刺激下可以观察到动物视觉的恢复[5]。有研究者将光敏感度高的内源性光感受蛋白黑视素(melanopsin/opsin 4,Opn4)表达至rd1小鼠视网膜神经节细胞中,恢复了动物部分视力[6]。而将黑视素基因转导于节细胞上级神经元(如双极细胞)尚未见报道。
黑视素蛋白是一种内源性光感受蛋白,约0.8%~1.0% 的视网膜神经节细胞含有黑视素[7]。黑视素参与昼夜节律[8]、瞳孔对光反射[9]等行为。黑视素蛋白不仅对光反应迅速,也由于其内源性的特点在体内长期表达不会引起免疫负反应。而将给光双极细胞作为靶点可以使动物区分给光/撤光通路,恢复较为高级视觉行为;此外给光双极细胞内部含有的多种G蛋白调节因子(regulators of G-protein signaling,RGS;如 RGS7和 RGS20)、浦肯野细胞蛋白 2(Purkinje cell protein 2,PCP2)等,均可参与加速细胞的光反应[10]。因此,本研究将选取甲基亚硝基脲(N-methyl-N-nitrosourea,MNU)诱导的CD1小鼠作为视网膜色素变性模型,定向转导黑视素基因于其视网膜给光型双极细胞,以期恢复动物视觉行为。
材料和方法
1 动物
CD1小鼠购于广东省医学实验动物中心(合格证号为SCXK粤,2008-0002)。2雌1雄配种合笼饲养,不限食水,饲养温度保持在23~26℃,严格遵循12 h昼/夜节律,使用内部空气循环系统。动物实验操作过程严格遵从暨南大学医学院实验动物使用条例。
2 主要材料
质粒Grm6-Opn4-GFP和Grm6-GFP均由美国宾夕法尼亚大学神经科学系视网膜研究室提供。构建出的质粒已通过基因测序检测。其中Grm6为给光双极细胞特异性受体——代谢型谷氨酸受体 6(metabotropic glutamate receptor 6,mGluR6)的启动子;Opn4为黑视素基因序列;GFP为绿色荧光蛋白基因序列。
MNU购于Sigma,实验时用生理盐水(normal saline,NS)配制为1% 溶液。由于MNU商品中含有少量醋酸,在终溶液中含量为 0.1%,故配制含有0.1% 醋酸的NS溶液作为对照组注射用液。
3 方法
3.1 MNU诱导的视网膜色素变性模型的建立 取成年CD1小鼠,于腹腔注射1%MNU,60 mg/kg(体重)。于第7天处死动物,取眼球制冰冻切片。切片经DAPI染色显示由MNU诱导7 d后小鼠视网膜感光细胞完全死亡,外核层消失,内核层(双极细胞、无长突细胞、水平细胞)及节细胞层完好,证明CD1小鼠腹腔注射MNU可形成迅速稳定的视网膜色素变性模型,见图1。
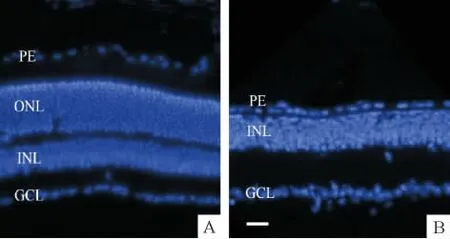
Figure 1.The retinal slices of normal(A)and MNU-induced CD1 mice at 7 d(B).The MNU-induced mouse lost the whole outer nuclear layer(ONL),while the inner nuclear layer(INL)and retinal ganglion cell layer(GCL)remained,suggesting that MNU could induce a model of RP.PE:pigment epithelium.Scale bar=20 μm.图1 正常和MNU诱导7 d的CD1小鼠的视网膜切片
3.2 乳鼠眼底注射质粒并电转 用生理盐水将目的质粒稀释至3 g/L,加入0.1%Fast green染料。Fast green是一种安全无毒的深绿色染色剂,用于评价眼底注射手术情况。取P0~P1乳鼠,随机分为治疗组(Grm6-Opn4-GFP)和阴性对照组(Grm6-GFP)。在手术显微镜下用注射器针头(0.5 mL)划开动物右眼眼睑并突出眼球,于眼球鼻侧角巩缘下方开口。微量注射器针尖由此开口进入眼球,迅速将0.5 μL质粒溶液注入乳鼠视网膜下腔。术后乳鼠立刻利用电转电融合仪(BEX-CUY21VIVO-SQ)进行眼部电转,手术眼为正极,对照眼为负极。电转参数设置:电压80 V,刺激时长50 ms,间隔时间950 ms,连续刺激5次。
3.3 行为学检测 动物行为学检测采用明暗箱测试,规格为16×16×25+16×16×25(长×宽×高;单位:cm),箱体间有门可供动物自由穿梭。2个箱顶均设有摄像头对动物运动轨迹进行追踪,并由动物行为轨迹分析系统(Noldus-EthoVision XT 7.0)进行分析。测试时长为5 min。共设计5个实验组:正常对照组(normal)、生理盐水Grm6-Opn4-GFP对照组(NS+melanopsin)、MNU诱导模型 Grm6-Opn4-GFP治疗组(MNU+melanopsin)、MNU诱导模型Grm6-GFP对照组(MNU+GFP)和 MNU诱导组(MNU)。诱导后连续7 d进行明暗箱测试。记录动物在仪器中运动轨迹,并计算第7天动物在暗箱中活动时间占总时长的百分比。
3.4 电眼生理系统检测ERG 动物于全暗条件下进行12 h暗适应,实验前6 h禁食禁水。检测前于暗红灯光下用3.5%水合氯醛对动物进行麻醉(12.5 μL/g体重)。待动物全麻后于其双眼眼表滴加复方托吡卡胺滴眼液散瞳。将动物放于活动搭载台上并连接电极。活动电极采用3 mm环形角膜接触电极,参考电极为不锈钢针电极,插于双耳耳后皮下,接地电极插于尾根皮下。散瞳完毕,于动物双眼各滴加10 g/L甲基纤维素溶液,可降低阻抗,保持眼球湿润。待参考电极阻抗稳定在2.3 kΩ以下,活动电极阻抗保持在7 kΩ以下,关闭所有光源给予动物5 min暗适应。实验中给予 Scotopic 0.003、0.03、0.3、1、3和10 cd·s/m2一系列刺激,经5 min强度为20 cd/m2的绿色背景光明适应后,再给予Photopic 0.3、1、3、10 和30 cd·s/m2刺激。刺激强度不高于 3.0 cd·s/m2时刺激光均为绿光,高于3.0 cd·s/m2时则为白光。刺激次数及间隔时间根据刺激光强分别为3~10次和2~10 s之间。用Clampfit 9.2软件对数据进行分析。从测试系统导出原始数据后,滤去50 Hz波,测量计算波形中主要反映给光双极细胞光反应的b波振幅及潜伏期并进行统计。
3.5 质粒转染效果的鉴定 取不低于5周龄的动物,用3.5%水合氯醛腹腔过量注射对其进行麻醉(20 μL/g)处死后全身灌流。待动物全身僵直灌注成功后,取出其右眼眼球,置于4%多聚甲醛中固定30 min。随后剥离视网膜,将视网膜平铺片,在荧光显微镜下观察GFP蛋白的表达并拍照。用共聚焦显微镜对转染成功的视网膜平铺片拍照并进行三维重建。40倍油镜,光切厚度为1.5 μm。重建时统一将立体图像沿Z轴旋转,通过双极细胞特有形态辨认转染成功的细胞。最后进行黑视素抗体免疫荧光检验并将视网膜进行震动切片(50 μm)。
4 统计学处理
用SPSS 16.0统计软件分析。数据以均数±标准误(mean±SEM)表示,使用SPSS 13.0统计软件进行分析,单因素分析检验组间差异,以P<0.05为差异有统计学意义。
结 果
1 黑视素可以定向表达于给光双极细胞
1.1 质粒定向转染进入给光型双极细胞 正常小鼠视网膜发育在5周时达到成熟,故选择5周以上的小鼠能够准确地反映视网膜发育、变性以及目的基因治疗的状况。首先取小鼠经质粒转染的右眼视网膜进行平铺片,在荧光显微镜下观察。观察到视网膜局部存在密集绿色荧光蛋白即可初步认定质粒转染成功,见图2A、B。将平铺片共聚焦断层扫描结果经Z轴旋转可清晰看到所有被绿色荧光标记的细胞都具有典型的给光型双极细胞形态,包括胞体两侧的树突、轴突以及分支在给光层的轴突末端,见图2C、D。
1.2 转染Grm6-Opn4-GFP的细胞表达黑视素蛋白
随后进行视网膜平铺片的黑视素抗体免疫荧光染色,以检验黑视素蛋白的表达。视网膜平铺片显示所有被绿色荧光标记的细胞都被黑视素抗体标记;对照质粒Grm6-GFP转染的细胞未被黑视素抗体标记,见图3。因此,电转染技术可以使黑视素蛋白特异地表达于给光型双极细胞。
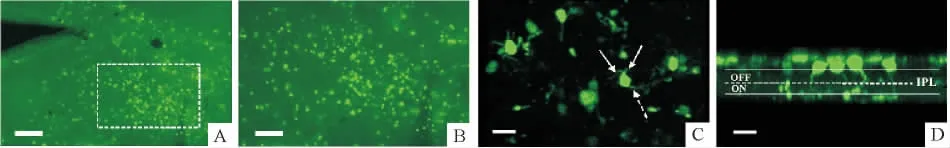
Figure 2.Grm6-Opn4-GFP plasmid was specifically transfected into ON-bipolar cells.A:the whole-mount retina showing successful transfection;B:enlarged image of the box region in A;C:confocal microscopy of the transfected region;D:the 3D reconstruction in Z axis.The solid arrows show the dendrites of the bipolar cells and the dotted arrow shows the axon of the bipolar cells.The solid lines in D show the inner plexiform layer(IPL)of retina,and the dashed line divides the ON and OFF sublayers.All transfected bipolar cells have axon terminals in the ON sublayer.Scale bars:200 μm(A),20 μm(B)and 100 μm(C,D).图2 质粒转染效率检查表明质粒能够定向表达于给光型双极细胞

Figure 3.Anti-melanopsin test on whole-mount retina(MNU-induced)transfected with Grm6-Opn4-GFP and Grm6-GFP plasmids.图3 Grm6-Opn4-GFP和Grm6-GFP质粒转染成功的小鼠视网膜平铺片上黑视素蛋白的表达
2 行为学检测(明暗箱测试)表明黑视素治疗小鼠的趋暗视觉行为有所恢复
小鼠为夜行性哺乳动物,其活动具有趋小、趋暗的特点。视觉能力正常的小鼠在除光亮度外其余条件均一致的明暗箱中自由活动时,对暗箱表现出明显的趋向性,见图4C;而完全失明的小鼠由于无法区分明暗,不表现出任何趋向性。因此,通过比较小鼠在暗箱的活动时间比,可以作为检测小鼠视觉行为的手段。MNU诱导的CD1模型组动物连续7 d的测试显示,经MNU诱导的小鼠视觉行为能力在注射后7 d内迅速下降,于7 d呈完全失明状态,这点与7 d后视网膜感光细胞完全消失相对应,见图4D。而经Grm6-Opn4-GFP转导的MNU模型小鼠则表现出一定程度的恢复趋势,在黑箱的活动时间显著长于未治疗组(P<0.05),见图4B、E;但未能达到正常组和生理盐水对照组水平(P<0.05),见图4A、C。这表明黑视素蛋白表达可以提高动物的基本视觉能力。
3 电眼生理系统检测表明黑视素治疗小鼠的ERG b波有所恢复
闪光视网膜电图(flash ERG)波形主体通常由1个向下的负波和紧随其后1个向上的正波构成。向下的负波被称为a波,其振幅及潜伏期反映了感光细胞的光反应情况;a波之后迅速向上的正波被称为b波,反映的是给光型双极细胞和无长突细胞的光反应,也是本文重点关注的部分。在明适应条件下,b波之后还可能会出现一个向下的负波,被称为明视负波反应(photopic negative response,PhNR),主要反映神经节细胞的光反应。正常小鼠感光细胞正常,flash ERG测试可以获得清晰的a波、b波和PhNR,见图5A。然而视网膜色素变性由于其感光细胞受损,将无法检测到任何波型。本实验预期受质粒转染并表达黑视素蛋白的给光型双极细胞可以直接对光产生反应后形成电信号,恢复b波,进而将信号传导至神经节细胞,恢复PhNR。
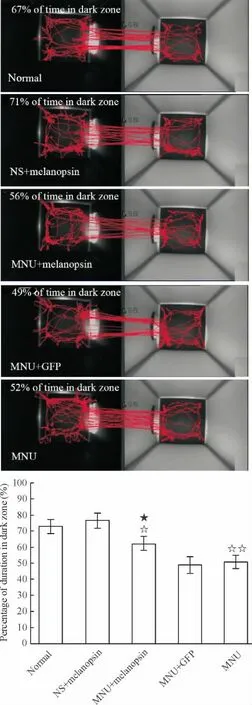
Figure 4.Transfecting melanopsin partially restored the visual behavior of MNU-induced retinitis pigmentosa mice.The running traces of CD1 mice in dark zones(left)and light zones(right)were shown.Mean±SEM.n≥10.☆P <0.05,☆☆P < 0.01 vs NS+melanopsin control;★P <0.05 vs MNU group or MNU+GFP group.图4 转染黑视素基因可以使MNU诱导的视网膜色素变性小鼠恢复部分视力
视网膜电图测试显示,随着闪光强度的增加,正常小鼠的a、b波幅度增强,潜伏期缩短;MNU诱导视网膜变性的小鼠ERG波形完全消失;经Grm6-Opn4-GFP质粒转染的MNU诱导的CD1小鼠在闪光刺激强度增高至1 cd·s/m2时,b波有局部恢复,见图5B。经统计分析表明,治疗组b波振幅与未治疗组相比有显著差异(P<0.01),表明动物视觉反应得到了一定恢复,但尚未能达到正常水平(约正常水平的10%),其潜伏期也有所推迟,见图5C、D。但是,在明适应条件下,治疗组未发现具有b波恢复的趋势,也未观察到反应神经节细胞活动的PhNR。
讨 论
本实验利用给光型双极细胞特异性受体mGluR6编码序列作为启动子,下游接目的基因黑视素及用于标记的绿色荧光蛋白序列,利用在体电转技术,使黑视素和绿色荧光蛋白在给光双极细胞中定向表达。电转技术是一项广泛应用的分子生物技术,其作用是将外源物质如药物、小片段DNA等转入目的受体中,病毒、真菌、离体培养的细胞和组织、在体动物细胞均可作为受体,具有高效、稳定等特点。
MNU属于亚硝酰胺类亚硝基化合物,是一种广泛分布于环境中的强烷化剂,对动植物具有强有力的致突变、致畸形和致癌作用。单次腹腔注射一定剂量MNU可迅速诱导视网膜感光细胞凋亡。其作用机理是MNU对感光细胞DNA产生烷化作用,生成7-甲基脱氧尿苷DNA嵌合物[11],从而破坏 DNA的结构,引起视网膜感光细胞的不可逆性凋亡。该过程伴有 Bcl-2下调、Bax上调[12]和 caspase-3、-6、-8通路的激活。此外,MNU诱导的RP模型适用于成年小鼠和大鼠,可重复性高,1周之内即可形成稳定的RP模型,在RP的实验研究中得到广泛应用。
本实验已经成功的将目的基因通过质粒载体利用电转染技术转导至MNU诱导的RP动物视网膜神经元中,并在给光双极细胞中定向表达。ERG测试显示经Grm6-Opn4-GFP转导的RP模型组在1~10 cd·s/m2光强部分恢复了b波,说明被转导的给光双极细胞能直接对光产生反应。明暗箱测试显示动物行为能力有明显恢复说明给光双极细胞将光反应信号转化为电信号,并通过视网膜神经元回路对信号进行加工,传递至视网膜神经节细胞,信号在节细胞处形成动作电位,经视神经传递至视皮层形成视觉,促使动物表现出明显的趋暗特性。
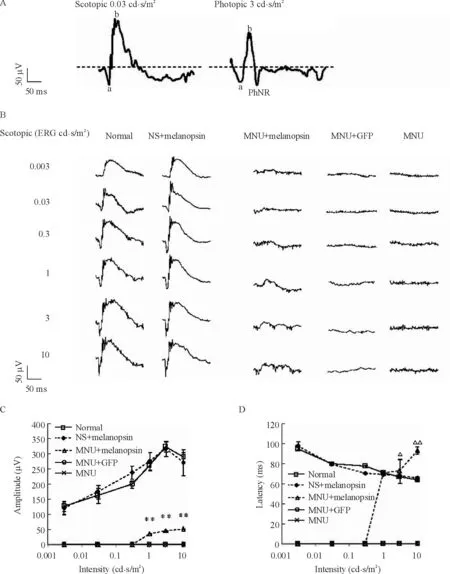
Figure 5.Transfecting melanopsin partially restored ERG responses in retinitis pigmentosa mice.A:a-wave,b-wave and PhNR of ERG responses in a normal mouse;B:the scotopic ERG waves in CD1 mice of various groups in response to flashes at increasing intensity;C:the amplitude of b-wave in CD1 mice of various groups;D:the latency of b-wave in CD1 mice of various groups.Mean ±SEM.n≥10.**P <0.01 vs MNU group or MNU+GFP group;△P <0.05,△△P <0.01 vs NS+melanopsin group.图5 黑视素基因转染的视网膜色素变性小鼠ERG测试中b波有部分恢复
ERG测试中,经Grm6-Opn4-GFP转导的模型组没有记录到反应神经节细胞光反应活动的PhNR。现分析原因如下:双极细胞根据与视锥细胞和视杆细胞的联系分为视杆-双极细胞和视锥-双极细胞。视杆-双极细胞均为给光型,大约占全部给光型双极细胞的43%[13];视锥-双极细胞在小鼠视网膜中共有9种亚型,而其中的5种为给光型[14]。即给光型双极细胞由全部的视杆-双极细胞和部分视锥-双极细胞构成。在明适应条件下,动物的视觉行为是由视锥细胞来完成的,相应的视锥-双极细胞对明适应视觉行为的参与应该多过于视杆-双极细胞,视网膜神经节细胞更多地接收来自视锥-双极细胞发出的信号。如果视杆-双极细胞的活动受到抑制,则发挥作用的给光型双极细胞数量会明显减小。由此可见,本实验中治疗模型组动物在明适应视网膜电图中未能表现出b波的恢复以及明视负波的反应,可能由于明适应条件下,转染成功的视杆-双极细胞受到了一定程度的抑制,从而减弱了整体转染成功的双极细胞的活动,进而影响下一级神经元神经节细胞的活动。
总而言之,利用电转染法,以给光双极细胞特异性受体mGluR6作为启动子,可以将内源性光感受蛋白黑视素基因定向转染至视网膜给光双极细胞中表达并恢复视网膜色素变性模型动物的部分视力。
[1] 叶 辉,夏小平,宋国祥,等.眼底荧光影像对原发性视网膜色素变性病情严重性的评估作用[J].中国病理生理杂志,2009,25(1):191-193.
[2] Acland GM,Aguirre GD,Ray J,et al.Gene therapy restores vision in a canine model of childhood blindness[J].Nat Genet,2001,28(1):92-95.
[3] Testa F,Maguire AM,Rossi S,et al.Three-year followup after unilateral subretinal delivery of adeno-associated virus in patients with leber congenital amaurosis type 2[J].Ophthalmology,2013,120(6):1283-1291.
[4] Bi A,Cui J,Ma YP,et al.Ectopic expression of a microbial-type rhodopsin restores visual responses in mice with photoreceptor degeneration[J].Neuron,2006,50(1):23-33.
[5] Lagali PS,Balya D,Awatramani GB,et al.Light-activated channels targeted to ON bipolar cells restore visual function in retinal degeneration[J].Nat Neurosci,2008,11(6):667-675.
[6] Lin B,Koizumi A,Tanaka N,et al.Restoration of visual function in retinal degeneration mice by ectopic expression of melanopsin[J].Proc Natl Acad Sci U S A,2008,105(41):16009-16014.
[7] Hannibal J,Hindersson P,Knudsen SM,et al.The photopigment melanopsin is exclusively present in pituitary adenylate cyclase-activating polypeptide-containing retinal ganglion cells of the retinohypothalamic tract[J].J Neurosci,2002,22(1):RC191.
[8] Barnard AR,Hattar S,Hankins MW,et al.Melanopsin regulates visual processing in the mouse retina[J].Curr Biol,2006,16(4):389-395.
[9] Young RS,Kimura E.Pupillary correlates of light-evoked melanopsin activity in humans[J].Vision Res,2008,48(7):862-871.
[10]Xu Y,Sulaiman P,Feddersen RM,et al.Retinal ON bipolar cells express a new PCP2 splice variant that accelerates the light response[J].J Neurosci,2008,28(36):8873-8884.
[11] Ogino H,Ito M,Matsumoto K,et al.Retinal degeneration induced by N-methyl-N-nitrosourea and detection of 7-methyl-deoxyguanos in the rat retina[J].Toxicol Pathol,1993,21(1):21-25.
[12]孟 晶,张 旭,陈青山,等.银杏苦内酯B对N-甲基-N-亚硝脲诱导的大鼠视网膜细胞凋亡的抑制作用[J].中国病理生理杂志,2012,28(4):694-699.
[13] Jeon CJ,Strettoi E,Masland RH.The major cell populations of the mouse retina[J].J Neurosci,1998,18(21):8936-8946.
[14] Ghosh KK,Bujan S,Haverkamp S,et al.Types of bipolar cells in the mouse retina[J].J Comp Neurol,2004,469(1):70-82.
