丙酮酸乙酯对缺氧缺血性脑损伤新生大鼠脑组织的保护作用*
2013-11-07欧阳颖苏浩彬薛红漫吴燕云方建培
欧阳颖, 苏浩彬, 薛红漫, 吴燕云, 方建培
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是围产期常见病,是引起儿童智力落后、癫痫、共济失调和脑性瘫痪的主要原因之一。目前针对该病的治疗主要为支持、对症治疗,疗效并不理想。因此,寻找更为有效的治疗方法成为当前迫切需要解决的问题。
丙酮酸乙酯(ethyl pyruvate,EP)去除乙酯基团后可形成丙酮酸,后者在氧供充足时氧化为乙酰辅酶A,维持三羧酸循环[1];同时EP具有抗氧化和清除自由基的能力,可用于与氧化应激有关的疾病的治疗[2-3]。但目前EP对缺氧缺血性脑损伤(hypoxicischemic brain damage,HIBD)新生大鼠保护作用的研究文献仅1篇,该研究表明EP拮抗神经细胞死亡,部分通过抑制炎症因子的生成、抑制炎症反应而发挥保护作用,其保护作用及机制尚未明确,需要进一步的研究[4]。因此,进一步明确EP的神经保护作用及发现可能的作用机制是非常必要的。本研究旨在通过建立新生大鼠HIBD模型,从抗氧化功能方面探讨EP对HIBD新生大鼠的神经保护作用及可能机制,以探讨HIE更为有效的治疗方法。
材料和方法
1 动物
7日龄SD乳鼠165只,体重为8~14 g,雌雄不限,由中山大学动物中心提供。
2 主要试剂及仪器
EP购于Sigma;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒和丙二醛(malondialdehyde,MDA)试剂盒由南京建成生物工程研究所提供;TUNEL试剂盒由Intergen提供。8%O2和92%N2的混合气体、电子天平、恒温缺氧装置、恒温烤箱、生物组织自动脱水机、切片机、电子显微镜等。
3 主要方法
3.1 动物分组以及缺氧缺血模型的建立 实验动物随机分为3组:假手术组(n=43)、HIBD模型组(n=61)和 HIBD+EP处理组(n=61)。参考 Rice等[5]方法制作新生大鼠HIBD模型。用乙醚麻醉7日龄新生大鼠,分离其左颈总动脉,结扎左颈总动脉两端,然后从中间剪断血管。每只动物休息1.5 h后,放入37℃水浴的密闭缺氧箱,箱内持续充以8%O2和92%N2的混合气体,气流量2.5 L/min,持续时间为2.5 h。EP组大鼠在缺氧缺血前30 min、缺氧后24 h、48 h、72 h腹腔注射50 mg/kg EP。假手术组在麻醉后仅切开颈部皮肤,分离左颈总动脉,然后缝合切口。
3.2 HE染色 将脑组织置于4%多聚甲醛0.1 mol/L PBS(pH 7.4)溶液中固定24 h,使用 Leica脱水机连续脱水17.5 h,常规石蜡包埋,冠状切片(5 μm厚),按常规方法进行HE染色。观察脑损伤组织特点和坏死神经元特征。
3.3 电镜的标本制作 乙醚麻醉大鼠后,剪开右心房,灌注4℃含100 U肝素的生理盐水500 mL,然后换用4℃电镜固定液,快速取出脑组织,由脑的前极向后极冠状切片,厚2 mm。取病灶坏死边缘区的皮层组织1 mm ×1 mm ×1 mm,浸泡于电镜固定液中,固定24 h后送检。
3.4 脑组织匀浆的制备 在72 h断头处死各组大鼠,取出左脑,取100 mg脑组织,用冰生理盐水作为匀浆介质,按1 g∶9 mL比例在匀浆管中充分匀浆,即制成10%脑组织匀浆,在4℃条件下,转速为3 500 r/min,离心15 min,收集上清液,检测SOD活性和MDA含量。
3.5 黄嘌呤氧化酶法测定SOD活性和化学比色法测定MDA含量 参考文献[6-7],按照南京建成生物化学公司试剂盒说明书提供的方法及步骤进行操作。SOD单位定义如下:每克组织蛋白在1 mL反应液中SOD抑制率为50%时对应的SOD量为1个活性单位(U)。
3.6 脑组织含水量测定 在大鼠缺氧缺血后72 h,乙醚麻醉后剪开心房放血,在冰盘上取出脑组织,切除嗅脑和后脑,以大脑纵裂及视交叉中点为标志,分开左右脑,用电子天平称取湿重后,置70℃干燥箱持续烤72 h,称取干重。脑含水量(%)=(湿重-干重)/湿重×100%。
3.7 细胞凋亡检测 缺氧缺血后72 h处死动物,在大脑左半球中间部位向后,取约3 mm厚度组织块、固定、包埋后制成石蜡切片,按TUNEL试剂盒说明书操作。凋亡阳性细胞免疫强度判定和计数:选择大脑半球中间部位,由前向后,每5张切片(每张厚5 μm)取1张,共选取5张切片,每张切片在200倍显微镜下随机观察5个视野,胞浆及胞核呈淡或深棕黄色为TUNEL阳性的凋亡细胞,淡绿色为甲基绿复染的存活细胞,计数每个视野的凋亡细胞数并统计均值。
3.8 脑萎缩程度的评估 缺氧缺血侧(左侧)大脑半球萎缩程度采用萎缩百分比评估,即右脑和左脑重量差与右脑重量之比,以百分数表示。在缺氧缺血后14 d,取脑组织,以电子天平称得左右大脑半球湿重,计算萎缩百分比。
4 统计学处理
用SPSS 16.0统计软件分析。数据以均数±标准差(mean±SD)表示,左右两侧脑含水量比较采用配对t检验,组间均数比较采用单因素方差分析(ANOVA),两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 HIBD模型的鉴定
开始结扎左侧颈总动脉时,新生大鼠无不适;缺氧30 min后,乳鼠头部颤抖,开始出现紫绀,躁动不安;缺氧90 min后,乳鼠活动明显减少,部分肢体抖动明显;缺氧2.5 h后,乳鼠被夹尾时肢体运动为向左侧旋转;2周后死亡率为29.5%(18/61)。病理切片HE染色可见大脑皮质及纹状体有散在的小梗死灶,局部组织疏松,神经元减少或缺失,大量小胶质细胞浸润、聚集;海马区有部分神经元死亡,细胞核固缩,结构不清,见图1。电镜检查见血管周围水肿、轴突水肿断裂、线粒体肿胀、胶质细胞吞噬现象、内皮细胞水肿等现象,见图2。

Figure 1.Histological changes of rat brain cortical(A,B)and hippocampal(C,D)tissues(HE staining,×200).A,C:sham operation group;B,D:HIBD group.The arrows indicate microglial aggregation.图1 大鼠脑皮层和海马组织学改变

Figure 2.Ultrastructural changes observed under electron microscope(×10 000).A:a normal neuron in sham operation group;B:perivascular edema in HIBD group;C:axonal edema and fracture in HIBD group;D:mitochondrial edema in HIBD group;E:particles of glial cell phagocytosis in HIBD group;F:endothelial cell edema in HIBD group.The arrows indicate the pathological changes.图2 电镜观察大鼠脑皮层组织超微结构的改变
2 脑组织匀浆SOD活性和MDA含量检测结果
在乳鼠缺氧缺血72 h后,HIBD组SOD活性明显减弱,EP处理组较HIBD组明显增强。HIBD组MDA含量较假手术组明显增多,EP处理组的MDA含量较HIBD组明显减少,各组比较差异有统计学意义(P <0.05),见表1。

表1 大鼠脑组织匀浆SOD活性和MDA含量Table 1.The SOD activity and MDA content in rat brain tissue homogenate(Mean±SD.n=11)
3 脑组织含水量测定
假手术组的左右大脑含水量无显著差异(P>0.05);HIBD模型组缺氧缺血侧(左侧)大脑出现显著水肿,该侧的脑含水量高于对侧(P<0.05),也高于假手术组任何一侧(P<0.05);HIBD+EP组左右两侧大脑含水量无显著差异(P>0.05),见表2。
4 TUNEL染色结果
阳性细胞胞体缩小,细胞核固缩,细胞核及胞浆中较多棕色颗粒,正常细胞为淡绿色。假手术组大脑皮质和海马区偶见少量的凋亡细胞;HIBD组损伤侧大脑皮质和海马区凋亡细胞数明显增多;HIBD+EP组损伤侧大脑皮质和海马凋亡细胞数较HIBD组明显减少(P<0.05),但仍较假手术组多(P<0.05),见图3和表3。

表2 左右脑含水量Table 2.The water content of the left and right brains(%.Mean±SD.n=11)
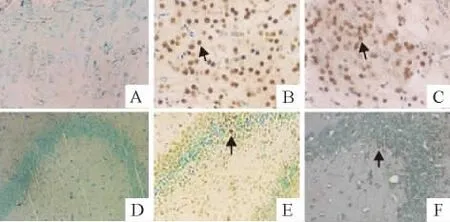
Figure 3.TUNEL staining of rat brain cortical(A,B,C)and hippocampal(D,E,F)tissues(×200).A,D:sham operation group;B,E:HIBD group;C,F:HIBD+EP group.The apoptotic cells were stained brown(indicated by the arrows),while the normal cells were green(methyl green counterstaining).图3 大鼠脑皮层和海马组织的TUNEL染色

表3 皮质和海马神经元凋亡数Table 3.The numbers of apoptotic neurons in cortex and hippocampus(Mean±SD.n=11)
5 脑萎缩程度的评估
在缺氧缺血后14 d,HIBD组缺氧缺血侧大脑明显萎缩,重量较对侧减轻 (P<0.01);而HIBD+EP组左侧大脑亦有萎缩,但程度低于HIBD模型组(P<0.05),见图4和表4。

Figure 4.Rat brain appearance in different groups.A:sham operation group,normal brain,the left hemisphere and right hemisphere of the brain was symmetrical;B:HIBD group,the left hemisphere of the brain was obviously atrophied;C:HIBD+EP group,part of the left hemisphere of the brain was atrophied.图4 各组大鼠大脑外观

表4 左右脑重量及脑萎缩程度Table 4.The weight of the left and right brains and atrophy percentage(Mean±SD.n=10)
讨 论
Rice等[5]使用的7日龄新生大鼠,其脑发育程度相当于37周左右刚出生的新生儿,结扎左侧颈总动脉,经过8%低氧处理2 h后,可产生类似于新生儿HIBD的改变,缺血敏感区(结扎侧大脑皮层、纹状体、海马和丘脑)内出现明显的缺血性改变,然而单纯缺氧或单纯结扎一侧颈总动脉引起的脑缺血均不能引起脑损伤。该模型稳定且易于制作,被广泛应用于新生儿HIE的发病机理研究,为各种干预方法的研究提供较稳定的模型。
EP是一种安全、稳定且极易被细胞摄取的物质。由于其较好的脂溶性,因此可更容易地进入细胞和穿过线粒体[8],其主要作用有:(1)保存组织ATP含量。EP作为丙酮酸前体物,可通过自发或酶解途径去除乙酯基团后形成丙酮酸,后者作为代谢底物进入三羧酸循环提供能量。(2)抗自由基损伤。此特性与它的化学结构和细胞代谢方式有关,其α-酮酸结构能通过直接的非酶促化学反应中和过氧化物,清除自由基。EP对其它活性氧基团如一氧化氮、H2O2、OH·等的产生也有抑制作用,具有抗氧化和清除活性氧作用[9]。有研究显示EP可激活核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)/抗氧化反映元件(antioxidant response element,ARE)通路,升高血红素加氧酶1,启动内源性抗氧化系统[10]。因此对多种氧化应激引起的神经损伤有明显保护作用。(3)EP能作用于p65,抑制NF-κB的活性而发挥抗炎的作用[11],还能降低早期炎症因子如TNF-α、IL-6的表达,抑制晚期炎症因子高迁移率族盒蛋白1(high-mobility group box 1 protein,HMGB1)的合成或释放等[12-13]。
本研究选用新生大鼠HIBD模型,共注射EP四次,观察其保护作用。在预实验中,我们采用25、50和100 mg/kg 3个治疗剂量,发现50 mg/kg这一剂量能明显能提高SOD活性,故在整个实验中选择50 mg/kg这一剂量。同时亦有文献报道,应用40 mg/kg EP可较好保护全身性炎性反应所引起的器官损伤[14],与本研究所选择的剂量相近。HIBD组脑组织含水量在术后6 h开始升高,3 d达高峰,所以本实验选用72 h这一时点检测脑含水量。
SOD是机体内自然存在的超氧自由基清除因子,是一种重要的抗氧化剂。其活力的高低反映了机体清除自由基的能力。MDA是脂质过氧化反应的终产物,反映脂质过氧化程度,同时也间接反映氧自由基生成的量。同时MDA的高低反映了机体受自由基攻击的严重程度。本实验结果显示缺氧缺血性损害使脑组织SOD活性下降,MDA含量增加,表明氧自由基引起的氧化性损伤为HIE的发病机理之一,与文献结果相符[15]。EP预处理可减轻SOD活性的下降,并减少MDA含量的增加,提示EP有较强的抗自由基作用,这可能与EP可激活Nrf2/ARE通路、升高SOD和还原型谷胱甘肽(reduced glutathione,GSH)等有关[10]。本研究中 EP有减少神经元凋亡、减轻血管壁的通透性和脑组织水肿的作用,这些保护作用与其抗氧化、清除自由基和减轻生物膜的损伤有关。
综上所述,本研究证实EP对HIBD新生大鼠脑组织具有保护作用,其机制包括抗氧化、减轻脑水肿和抑制细胞凋亡的发生。尽管目前EP的应用仅限于动物实验,其安全性和有效性尚有待进一步证实,本研究为其应用于新生儿HIE的临床治疗提供了实验依据。
[1] Taylor MD,Grand TJ,Cohen JE,et al.Ethyl pyruvate enhances ATP levels,reduces oxidative stress and preserves cardiac function in a rat model of off-pump coronary bypass[J].Heart Lung Circ,2005,14(1):25-31.
[2] Tawadrous ZS,Delude RL,Fink MP.Resuscitation from hemorrhagic shock with Ringer’s ethyl pyruvate solution improves survival and ameliorates intestinal mucosal hyperpermeability in rats[J].Shock,2002,17(6):473-477.
[3] Venkataraman R,Kellum JA,Song M,et al.Resuscitation with Ringer’s ethyl pyruvate solution prolongs survival and modulates plasma cytokine and nitrite/nitrate concentrations in rat model of lipopolysaccharide-induced shock[J].Shock,2002,18(6):507-512.
[4] Shen H,Hu X,Liu C,et al.Ethyl pyruvate protects against hypoxic-ischemic brain injury via anti-cell death and anti-inflammatory mechanisms [J].Neurobiol Dis,2010,37(3):711-722.
[5] Rice JE 3rd,Vannuce RC,Brierley JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):131-141.
[6] 夏金明,胡春林,李 欣,等.乌司他丁对心肺复苏后兔脑组织氧化应激损伤的影响[J].中国病理生理杂志,2012,28(10):1740-1745.
[7] 吴 柯,万立华,谢灵瑶,等.环氧化酶2在铝负荷致大鼠海马神经元损伤中的作用[J].中国病理生理杂志,2012,28(9):1695-1698.
[8] Olivencia-Yurvati AH,Blair JL,Baig M,et a1.Pyruvate enhanced cardioprotection during surgery with cardiopulmonary bypass[J].J Cardiothorac Vasc Anesth,2003,17(6):715-720.
[9] Song M,Kellum JA,Kaldas H,et al.Evidence that glutathione depletion is a mechanism responsible for the antiinflammatory effects of ethyl pyruvate in cultured lipopolysaccharide stimulated RAW 264.7 cells[J].J Pharmacol Exp Ther,2004,308(1):307-316.
[10]Shin JH,Kim SW,Jin Y,et al.Ethyl pyruvate-mediated Nrf2 activation and hemeoxygenase 1 induction in astrocytes confer protective effects via autocrine and paracrine mechanisms[J].Neurochem Int,2012,61(1):89-99.
[11] Han Y,Englet JA,Yang R,et al.Ethyl pyruvate inhibits nuclear factor-κB-dependent signaling by directly targeting p65[J].J Pharmacol Exp Ther,2005,312(3):1097-1105.
[12]Wang H,Li W,Goldstein R,et al.HMGB1 as a potential therapeutic target[J].Novartis Found Symp,2007,280:73-85.
[13] Wang LZ,Sun WC,Zhu XZ.Ethyl pyruvate protects PC12 cells from dopamine-induced apoptosis[J].Eur J Phamacol,2005,508(1-3):57-68.
[14] van Zoelen MA,Yang H,Florquin S,et al.Role of Tolllike receptor 2 and 4,and the receptor for advanced glycation end products in high-mobility group box 1-induced inflammation in vivo[J].Shock,2009,31(3):280-284.
[15]贾洪丽,赫 文,侯俊青,等.精胺对急性脑缺血再灌注损伤大鼠的保护作用[J].中国病理生理杂志,2011,27(7):1319-1322.
