益气活血方和补肾生髓方对脑缺血再灌注大鼠Notch3和Frizzled2 mRNA及蛋白表达的影响*
2013-11-07胡建鹏张红梅王丽娜
吕 磊,胡建鹏,王 键, 徐 伟,谭 辉, 张红梅,王丽娜, 何 玲
近年来,神经干细胞(neural stem cells,NSCs)在缺血性脑卒中中的修复作用已引起广泛关注[1]。随着近年分子生物学技术的发展和对干细胞研究的深入,使干细胞增殖分化信号途径与调控迅速成为揭示干细胞增殖分化分子机制的前沿课题。近年来研究表明Notch信号通路通过“旁侧抑制”机制对NSCs自我更新、增殖和分化进行调节[2]。益气活血法和补肾生髓法是中医临床上治疗缺血性脑卒中常用方法。以往我们的研究已证实益气活血方能促进和调节局灶性脑缺血后内源性神经干细胞的增殖分化,补肾生髓法及其代表复方具有促进脑缺血后突触重塑和神经细胞轴突的再生作用[3-5]。本实验采用线栓法大脑中动脉制作局灶性脑缺血再灌注大鼠模型,观察益气活血方和补肾生髓方对模型大鼠缺血侧额顶叶皮质或海马CA1区Notch3和Frizzled2 mRNA及蛋白表达的影响,探讨其对脑缺血损伤后内源性NSCs增殖分化的影响及其作用机制。
材料和方法
1 材料
1.1 动物 健康SD大鼠32只,南京医科大学实验动物中心提供,许可证号为SCXK(苏)2002-0031,雌雄各半,月龄4个月,体重(280~320)g。
1.2 试剂及仪器 Notch通路PCR芯片购自SABiosciences,Notch3和Frizzled2单克隆抗体、EnVision两步法试剂盒、DAB显色试剂盒购自北京中衫金桥公司。ND-1000型微量紫外可见分光光度计为Thermo产品,ABI PRISM 7700 system为美国应用生物系统公司产品,VANOX显微镜为Olympus产品,JD-801形态学显微图像分析系统为南京捷达科技发展有限公司产品。
1.3 药物 益气活血方(脑络欣通):黄芪30 g,三七10 g,川芎10 g,红花6 g。补肾生髓方:龟板胶10 g,鹿角胶10 g,金毛狗脊10 g,杜仲10 g。由安徽中医药大学中药制剂室制备,分别相当于原生药6.0 kg/L 和2.4 kg/L。
2 方法
2.1 动物分组与给药 随机分为假手术(sham)组、缺血再灌注(ischemia reperfusion,IR)组、益气活血方(Yiqi-Huoxue prescription,IR+Y)组和补肾生髓方(Bushen-Shengsui prescription,IR+B)组,每组11只。益气活血方和补肾生髓方取中等剂量(分别为8.54 g/kg和10.25 g/kg)。复制局灶性脑缺血前30 min给药1次,以后每天灌胃2次。Sham组和IR组按同样方法予以等量的生理盐水灌胃,均持续1周。
2.2 脑缺血再灌注模型复制与神经功能障碍评分
采用改良的Longa法[6]制备大鼠大脑中动脉线栓塞模型及进行神经功能缺损体征评分。在脑缺血2 h再灌注时进行评分,2~3分者入选,假手术组仅进行动脉分离。
2.3 取材 分别于脑缺血2 h、再灌注1周后,10%水合氯醛(3.6 mL/kg,ip)麻醉大鼠,每组取3只大鼠,迅速开颅取脑,在冰冻生理盐水中,取缺血侧额顶叶皮质,-80℃冰箱备用,用于实时荧光定量PCR检测。每组取8只大鼠,打开胸腔,于右心耳部剪一小口,从左心室插入导管至主动脉,向内快速注入37℃肝素化生理盐水200 mL,至右心耳流出液变清亮,然后注入4%多聚甲醛磷酸盐缓冲液250 mL,灌流固定30 min后断头取脑,除去小脑和脑干,取大脑,放入相同的固定液中固定1周,脱水、透明、浸蜡,石蜡包埋,从视交叉后2~3 mm左右在有海马区域做连续冠状切片,切片厚度5 μm,用于免疫组化染色。
2.4 Notch3和Frizzled2 mRNA和蛋白表达的检测2.4.1 Notch信号通路基因芯片PCR Assay 严格按照操作规程进行,主要包括:脑组织额顶叶皮质RNA抽提,DNase I消化RNA样品(去除其中可能含有的基因组DNA),RNA纯化,紫外吸收测定法检测RNA质量(浓度、纯度),cDNA合成,实时荧光定量PCR检测Notch3和Frizzled2 mRNA表达水平。
2.4.2 免疫组化染色 采用EnVision两步法进行免疫组化染色,DAB显色液显色,Notch3和Frizzled2抗体稀释浓度为1∶100,阴性对照采用正常山羊血清替代I抗进行,苏木素轻度复染。
3 统计学处理
数据经SPSS 11.0软件处理,Notch信号通路基因芯片PCR Assay检测结果采用2-ΔΔCt法计算组间mRNA的表达差异,以上调或下调倍数 >1.5或<-1.5为差异有统计学意义;免疫组化染色结果的处理采用南京捷达JD-801图像分析系统,在相同视野下对Notch3和Frizzled2免疫反应阳性细胞积分吸光度(integral absorbance,IA)进行分析,数据用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 2种中药复方对脑缺血再灌注模型大鼠额顶叶皮质Notch3和Frizzled2 mRNA表达的影响
Notch信号通路基因芯片PCR Assay检测结果显示,与sham组比较,IR组Frizzled2 mRNA表达显著增高(P<0.05),Notch3 mRNA 表达无显著差异(P>0.05);与IR组比较,益气活血方组Frizzled2 mRNA表达无显著差异(P>0.05),Notch3 mRNA表达显著增高(P<0.05);与IR组比较,补肾生髓方组Frizzled2 mRNA表达显著降低(P<0.05),Notch3 mRNA无显著差异(P>0.05);与益气活血方组比较,补肾生髓方组Frizzled2 mRNA表达显著降低(P<0.05),Notch3 mRNA无显著差异(P>0.05),见表1。
2 2种中药复方对脑缺血再灌注模型大鼠海马CA1区Notch3和Frizzled2蛋白表达的影响
阴性对照组未见Notch3和Frizzled2蛋白表达;sham组动脉分离侧海马CA1区可见Notch3和Frizzled2蛋白明显表达。IR组Notch3蛋白表达明显增强,主要表达于神经细胞胞核,其IA值显著高于sham组(P<0.05);两中药复方组海马 CA1区Notch3蛋白表达增加,其IA值均显著高于IR组(P<0.05),补肾生髓方组IA值显著高于益气活血方组(P<0.05)。IR组Frizzled2蛋白表达明显增强,主要表达于神经细胞胞核和胞浆,其IA值显著高于sham组(P<0.05);两中药复方组海马CA1区Frizzled2蛋白表达降低,其IA值均显著低于IR组(P<0.05),但2 组之间无显著差异(P >0.05),见图 1、2和表2。

表1 各组大鼠额叶皮质Notch3和Frizzled2 mRNA表达的变化Table 1.Changes of Notch3 and Frizzled2 mRNA expression in the cortex of frontal and parietal lobes of the rats in different groups(n=3)
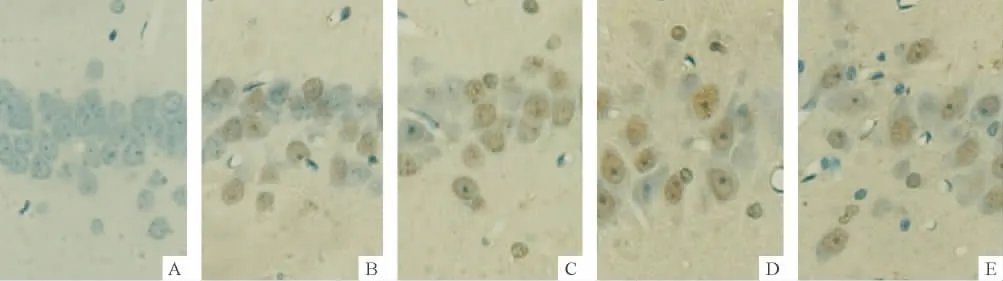
Figure 1.The expression of Notch3 protein at 1 week in CA1 area of the hippocampus detected by EnVision two-step method(DAB,×400).A:negative control group;B:sham group;C:IR group;D:IR+Y group;E:IR+B group.Positive staining is brown.图1 EnVision两步法检测海马CA1区Notch3蛋白的表达
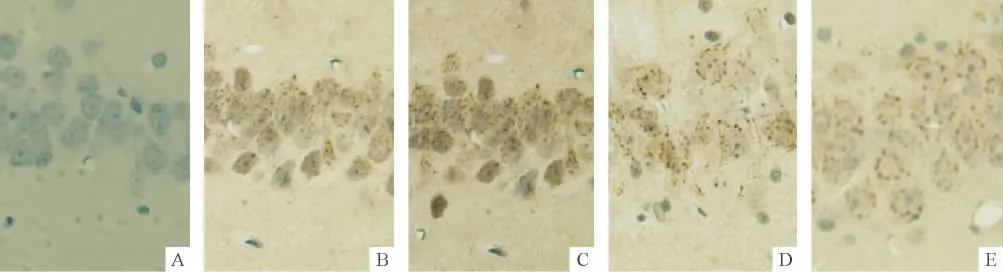
Figure 2.The expression of Frizzled2 protein at 1 week in CA1 area of the hippocampus detected by EnVision two-step method(DAB,×400).A:negative control group;B:sham group;C:IR group;D:IR+Y group;E:IR+B group.Positive staining is brown.图2 EnVision两步法检测海马CA1区Frizzled2蛋白的表达
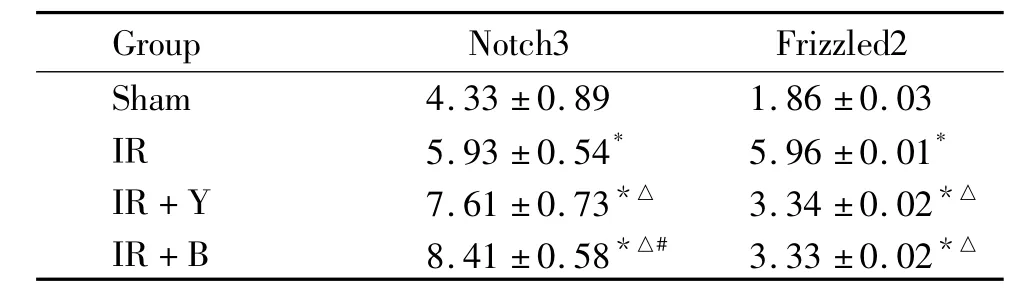
表2 各组海马CA1区Notch3和Frizzled2蛋白表达的积分吸光度值Table 2.Integral absorbance(IA)values of Notch3 and Frizzled2 positive cells in CA1 area of the hippocampus after local cerebral ischemia for 2 h followed by 1 week of reperfusion in different groups(mean±SD.n=8)
讨 论
脑血管疾病是中老年人的常见病,以高发病率、高复发率、高致残率、高死亡率为特点,已成为当前疾病三大死亡原因之一。本病以脑卒中为主,尤以缺血性脑卒中最为多见,且近年来呈上升趋势,占卒中80%。卒中后智力障碍与肢体致残是一严重的社会问题和医学难题。研究促进大脑功能重组和神经再生及其调节机制,促进机体功能恢复,对于减少残疾发生将是十分有意义的。
中医药在促进中风恢复期神经功能恢复、重建方面积累了一定的实践经验,取得了一些疗效,但由于作用机制不明确,使得用药缺乏规律性。益气活血法、补肾生髓法是临床治疗缺血性脑中风常用治法。近年来研究证实,成年动物以及人的神经系统中都有NSCs的存在,但绝大部分在体内处于静止状态,在损伤等病理条件下可以被激活并增殖、迁移及分化,可能使损伤造成的形态及功能上的缺失得以恢复。缺血后内源性NSCs的激活在脑缺血修复和功能重建中发挥了积极的作用,为实现脑损伤后的自身修复带来了希望。Notch信号转导通路作为胚胎发育过程中十分重要的信号途径,其相关分子的表达、运输和降解等过程受到诸多因素的调节,除了配体-受体水平的调节之外,尚受到多种蛋白质的调节[7]。Notch信号家族包括Notch受体、配体及其相应的细胞内信号分子,Notch受体激活后诱导的信号转导系统在调节NSCs的增殖分化中起到重要作用。体内研究表明,激活的 Notch受体能够促进NSCs向星形胶质细胞分化,抑制其向神经元和少突胶质细胞分化[8]。近年来,随着干细胞分化方面研究的逐步深入,逐渐认识到 Notch信号通路并非孤立存在的,而是处于一个复杂精细的信号网络之中,与Wnt信号通路在分子水平上存在联系,并且二者之间也存在串联和互相调控,其中Frizzled2为两者共同调控因子[9]。
本实验研究发现局灶性脑缺血再灌注大鼠海马Notch3和Frizzled2 mRNA及蛋白表达增加,说明局灶性脑缺血再灌注存在Notch信号通路变化。有研究表明,脑缺血后可以引起海马CA1区神经干细胞增殖,同时伴随着Notch信号通路被激活,抑制Notch信号途径可以增加神经元的数目[10]。益气活血方和补肾生髓方防治组多能增强Notch3 mRNA及蛋白表达,降低Frizzled2 mRNA及蛋白表达。但2中药复方也存在差异,在降低Frizzled2 mRNA表达和增强Notch3蛋白表达方面,补肾生髓方比益气活血方明显。以往我们的研究已证实益气活血方能促进大鼠局灶性脑缺血后内源性神经干细胞的增殖分化,补肾生髓方具有促进脑缺血后突触重塑和神经细胞轴突的再生作用[3,5],因此认为2种中药复方能通过促进Notch信号通路Notch3 mRNA及蛋白表达,抑制Frizzled2 mRNA及蛋白表达,进而影响局灶性脑缺血后NSCs增殖分化及神经可塑性,促进脑损伤康复,但Notch信号转导途径的激活对NSCs增殖与分化及神经可塑性结果的影响尚有待于进一步研究。
[1] Lie DC,Colamarino SA,Song HJ,et al.Wnt signalling regulates adult hippocampal neurogenesis[J].Nature,2005,437(7063):1370-1375.
[2] Woo SM,Kim J,Han HW,et al.Notch signaling is required for maintaining stem cell features of neuroprogenitor cells derived from human embryonic stem cells[J].BMC Neurosci,2009,10:97.
[3] 江爱娟,胡建鹏,王 键,等.两种中药复方对局灶性脑缺血再灌注大鼠Nestin、NSE和GFAP表达的影响[J].北京中医药大学学报,2009,32(10):679-682.
[4] 胡建鹏,周 会,王 键,等.益气活血方和补肾生髓方对局灶性脑缺血再灌注大鼠缺血半暗带Notch-1和Jagged1表达的影响[J].中国病理生理杂志,2010,26(3):483-486.
[5] 江爱娟,胡建鹏,王 键,等.益气活血方和补肾生髓方对大鼠脑缺血恢复期GAP-43和SYP表达的影响[J].中国中医药科技,2008,15(6):418-420.
[6] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7] Baron M,Aslam H,Flasza M,et al.Multiple levels of Notch signal regulation[J].Mol Membr Biol,2002,19(1):27-38.
[8] Tanigaki K,Nogaki F,Takahashi J,et al.Notch1 and Notch3 instructively restrict bFGF-responsive multipotent neural progenitor cells to an astroglial fate[J].Neuron,2001,29(1):45-55.
[9] 郭超伟,宋 凯,李 萍.Notch和 Wnt信号通路在血管形成中的协同调控作用[J].中国生物化学与分子生物学报,2010,26(6):523-530.
[10]Tatsumi K,Okuda H,Makinodan M,et al.Transient activation of Notch signaling in the injuried adult brain[J].J Chem Neuroanat,2010,39(1):15-19.
