石杉碱甲的抗炎作用及其对大鼠神经干细胞的保护作用*
2013-11-07林继宗陈庆状韦美丹
朱 宁, 林继宗, 陈庆状, 韦美丹, 王 勇△
阿尔茨海默病(Alzheimer disease,AD)是以认知功能进行性下降和情感障碍为特点的神经退行性疾病[1]。淀粉样 β 肽(amyloid beta-peptide,Aβ)沉积激活小胶质细胞引起的炎症反应是导致AD患者脑内神经损伤和凋亡的重要原因。研究报道,从中药千层塔中分离得到的一种石松类生物碱——石杉碱甲(huperzine A,HupA),为乙酰胆碱酯酶抑制剂,在AD治疗中效果显著[2]。但HupA的其它AD治疗机制尚不完全清楚,且目前关于HupA治疗AD的研究靶点主要局限于已经成熟的功能性细胞[3-4],很少关注HupA对神经细胞生成的影响,更少研究HupA对神经干细胞的作用。因此,本研究将建立大鼠小胶质细胞与神经干细胞共培养体系,在小胶质细胞层中加入Aβ1-42模拟AD患者脑内炎性微环境,观察HupA对炎症反应的作用,同时检测神经干细胞凋亡率,明确HupA对神经干细胞的保护作用。
材料和方法
1 主要试剂及材料
新生SD大鼠(出生24 h内)由南方医科大学实验动物中心提供,许可证号为SCXK(粤)2011-0015。OX-42和 nestin I抗(Abcam),抗小鼠 II抗(R&D Systems),0.4 μm Transwell培养板(Corning),Aβ1-42(US Biological),大鼠细胞因子检测试剂盒(LINCO),Bcl-2、Bax和 β-actin I抗(Cell Signaling),核蛋白提取试剂盒(凯基)。
2 主要方法
2.1 细胞培养
2.1.1 神经干细胞的培养 取新生SD大鼠海马,胰酶消化20 min,然后用10%FBS终止消化,过滤。滤液离心,细胞沉淀用含EGF、bFGF和B27的培养液重悬,调整细胞密度至1×109/L,接种,每隔3~4 d 半量换液[5]。
2.1.2 小胶质细胞的培养 取新生SD大鼠海马,制成单细胞悬液以5×108/L的细胞密度接种于预先经多聚赖氨酸包被处理的培养瓶中,2 d后全量换液,待培养至9~10 d,手摇法分离纯化小胶质细胞[6]。
2.1.3 免疫荧光染色鉴定小胶质细胞和神经干细胞 4%多聚甲醛固定细胞15 min;山羊血清封闭30 min,加入nestin I抗检测神经干细胞,或加OX-42 I抗检测小胶质细胞,4℃过夜,PBS漂洗,加入FITC(绿光)或TRITC(红光)标记的II抗,避光孵育1 h,DAPI染核5 min,荧光显微镜拍照。
2.1.4 共培养体系的建立 Transswell共培养体系的建立参照本课题组前期研究方法进行[6]。
2.2 实验分组 实验分3组,所有操作平行进行。(1)空白对照组(control):神经干细胞和小胶质细胞以1∶1的比例依次接种于Transwell板的上层和下层;(2)Aβ组:细胞培养方法同空白对照组,于小胶质细胞层中加入终浓度为10 μmol/L的Aβ1-42;(3)HupA组:细胞培养方法同空白对照组,在小胶质细胞层中加入 10 μmol/L Aβ1-42前 4 h 用1 μmol/L HupA预处理小胶质细胞[7]。各组培养24、48和72 h后检测白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)和巨噬细胞炎症蛋白 1α(macrophage inflammatory protein 1α,MIP-1α)的浓度,72 h后用流式细胞术和 Western blotting检测神经干细胞的凋亡情况。
2.3 液相芯片检测 IL-6、TNF-α和MIP-1α的表达
相对于ELISA技术,液相芯片技术具有高通量、检测过程简单快速、准确性高和重复性好等特点。收集各组细胞培养上清液,依照LINCOplex Kit说明书检测IL-6、TNF-α和MIP-1α浓度,主要步骤为:检测试剂恢复到室温,在测定板上滴加Buffer封闭滤板,室温振摇10 min;分别加25 μL细胞培养上清液、梯度稀释的标准品、空白和质控品到相应孔中;加混合微球,在振荡器上室温孵育2 h,用Wash buffer洗板2次,然后每孔加检测抗体的混合液,在振荡器上室温孵育2 h;加抗生物素蛋白链菌素,孵育30 min;洗板后加检测液,用Luminex液相芯片分析系统检测炎症因子浓度。
2.4 流式细胞术检测神经干细胞凋亡率 收集各组神经干细胞,参照annexin V-FITC/PI检测试剂盒说明书进行前期处理,用流式细胞术检测细胞凋亡率。
2.5 Western blotting检测Bcl-2和Bax表达 收集细胞,采用细胞核蛋白提取试剂盒提取各组神经干细胞核蛋白,BCA法蛋白定量,计算上样量,按SDSPAGE凝胶电泳跑胶后,采用半干法转膜,经封闭,Bcl-2、Bax和β-actin I抗孵育,II抗孵育后显影。
3 统计学处理
用SPSS 16.0统计软件分析,数据用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD),以P<0.05为差异有统计学意义。
结 果
1 神经干细胞和小胶质细胞的鉴定
以DAPI和小胶质细胞特异性标志物OX-42进行荧光双染,鉴定培养小胶质细胞的纯度,结果显示,所培养的小胶质细胞呈OX-42染色阳性且纯度大于95%,符合实验要求(图1A)。神经干细胞标志物nestin对成形细胞球的检测结果显示nestin染色阳性(图1B)。
2 HupA 抑制IL-6、TNF-α和 MIP-1α分泌
各组细胞处理 48 h后,Aβ组 IL-6、TNF-α和MIP-1α的浓度分别升高至空白对照组的3.8、4.6和4.9倍(P<0.01),且相对于24 h的浓度亦显著升高;HupA组的IL-6、TNF-α和MIP-1α的浓度分别升至空白对照组的2.2、1.6 和2.4 倍,相对于 Aβ 组显著降低(P<0.01)。而在72 h后,Aβ组IL-6、TNF-α和MIP-1α的释放量分别增至空白对照组的6.7、6.8和9.6倍(P <0.01);HupA 组 IL-6、TNF-α 和 MIP-1α的浓度分别为空白对照组的3.2、2.3和3.1倍,相对于Aβ组显著降低(P<0.01),见图2。
Figure 1.Identification of microglia and neural stem cells(NSCs).A:the microglial cells were positive for OX-42 staining(green);B:the NSCs were positive for nestin staining(red).图1 小胶质细胞和神经干细胞的鉴定
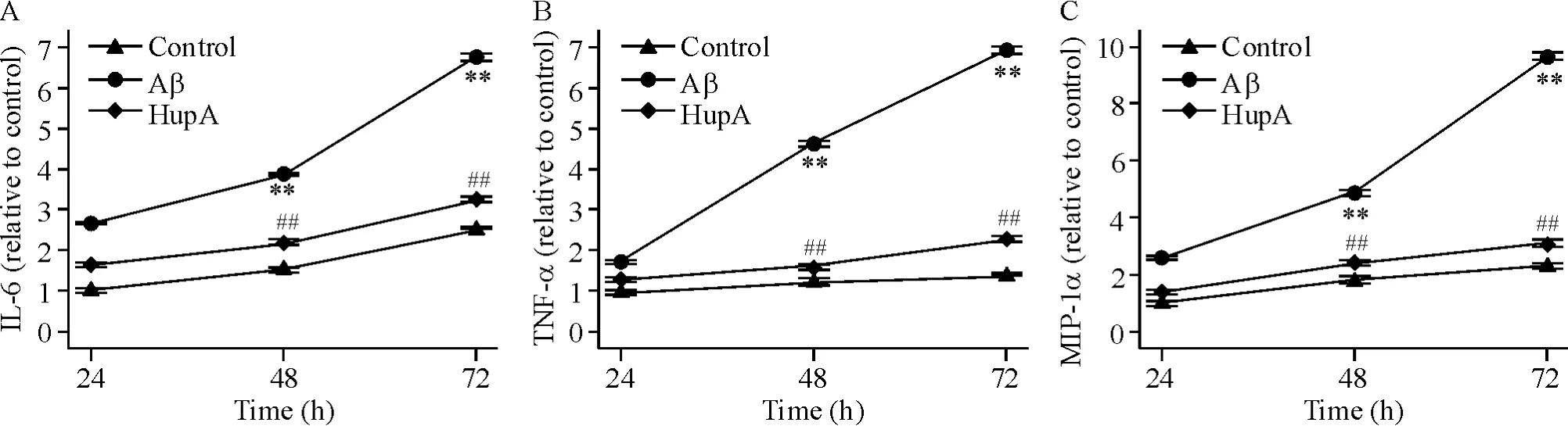
Figure 2.Huperzine A(HupA)reduced the secretion of IL-6(A),TNF-α (B)and MIP-1α (C).Mean±SD.n=6.**P <0.01 vs control;##P<0.01 vs Aβ.图2 石杉碱甲减少IL-6、TNF-α和MIP-1α分泌
3 HupA降低神经干细胞凋亡率
流式细胞术检测结果显示,细胞处理72 h后,空白对照组神经干细胞凋亡率为3.04%;当小胶质细胞层中加入 Aβ1-42后,神经干细胞凋亡率升高至25.46%,差异有统计学意义 (P<0.01);在Aβ1-42加入前用HupA预处理小胶质细胞,神经干细胞凋亡率降低至8.05%,与 Aβ组相比差异有统计学意义(P<0.01),见图3。
4 HupA升高神经干细胞的Bcl-2/Bax值
Western blotting检测结果显示,细胞处理72 h后,Aβ组Bcl-2和Bax蛋白相对于β-actin的表达量最高,而Bcl-2/Bax值最低(P<0.01);在Aβ1-42加入前预先用HupA处理小胶质细胞,Bcl-2/Bax值显著升高,与Aβ组相比差异有统计学意义(P<0.05),见图4。
讨 论

Figure 3.HupA reduced the apoptotic rate of NSCs.The apoptosis of NSCs was detected by flow cytometry.Mean±SD.n=6.**P <0.01 vs control;##P<0.01 vs Aβ.图3 石杉碱甲降低神经干细胞凋亡率

Figure 4.HupA elevated the Bcl-2/Bax ratio in NSCs.The expression of Bcl-2 and Bax was detected by Western blotting.Mean± SD.n=6.**P <0.01 vs control;#P <0.05 vs Aβ.图4 石杉碱甲对Bcl-2/Bax比值的影响
AD患者脑组织中聚积的Aβ持续作用于胶质细胞,形成的慢性炎症反应,诱发神经元凋亡和抑制神经细胞生成,造成中枢神经细胞大量丢失。这可能是AD形成和病情加重的主要原因。HupA作为一种胆碱酯酶抑制剂,已在临床应用治疗AD,且有一定疗效。有研究提示HupA可能作用于胆碱能受体而减弱炎性反应[8]。本课题组采用Transwell装置在体外成功建立了神经干细胞与小胶质细胞共培养体系,在小胶质细胞中加入Aβ1-42模拟AD患者脑内炎症微环境,以此探讨HupA的抗炎作用与神经干细胞保护作用。研究发现,在Aβ1-42的刺激下,小胶质细胞分泌 IL-6、TNF-α和 MIP-1α,炎症因子穿过 Tran swell半透膜,引起神经干细胞的凋亡。IL-6是一种具有多向性的细胞因子,在AD中大量表达,能通过诱导磷脂酶A2基因表达促进炎症反应。而TNF-α是在炎症反应中引发和调节细胞因子级联反应的重要促炎细胞因子,它能够刺激IL-1等多种细胞因子的表达,这些细胞因子反过来经各种机制持续放大炎性反应[9]。因此,抑制 TNF-α和 IL-6的产生对AD慢性炎症反应的控制和微环境的改善有重要作用。不同于TNF-α和IL-6,MIP-1α是趋化因子C-C超家族中的一种,其趋化作用在AD中引起小胶质细胞向Aβ斑块周围的聚集,小胶质细胞受Aβ的刺激释放包括MIP-1α在内的各种炎症因子,形成一个恶性循环[10]。在HupA的作用下,小胶质细胞分泌的IL-6、TNF-α和MIP-1α显著减少,产生明显的抗炎作用。以往研究显示这种作用是由于HupA抑制胆碱酯酶活性,增加乙酰胆碱水平,激活胆碱能受体后下调细胞因子和趋化因子的表达而产生的[8,11-12]。而我们的研究表明,HupA可直接作用于小胶质细胞,减少小胶质细胞炎症因子的分泌,从而抑制炎症反应。
HupA治疗AD效果显著。有研究显示其可通过减少Aβ的产生和作用于神经生长因子信号通路对神经元起保护作用[7],而本研究重点关注了HupA对神经干细胞的保护作用。流式细胞术检测结果提示,HupA可通过作用于小胶质细胞,降低神经干细胞凋亡率,从而保护神经干细胞。同时,Western blotting检测发现,HupA组神经干细胞Bcl-2/Bax值较Aβ组高。Bcl-2是重要的细胞凋亡抑制蛋白;Bax是Bcl-2蛋白家族中的一种,可拮抗Bcl-2的保护作用。Bcl-2蛋白家族中促凋亡和抑凋亡两类蛋白的比例决定细胞在受到凋亡信号刺激后是否发生凋亡。当Bcl-2/Bax值降低,Bax形成同源二聚体诱导细胞凋亡;而当Bcl-2/Bax值增高时,Bax与Bcl-2形成异源二聚体,实现Bcl-2抑制细胞凋亡的功能[13]。我们发现,神经干细胞在Aβ1-42介导的炎症反应刺激下,Bcl-2和 Bax表达量是各组中最高的,而Bcl-2/Bax值是各组中最低的。HupA预处理小胶质细胞后,液相芯片检测发现炎症因子分泌减少,同时,Bcl-2/Bax值显著高于Aβ组,产生抑制神经干细胞凋亡的作用。Western blotting和流式细胞术检测结果均提示HupA可抑制神经干细胞的凋亡。HupA减少炎症因子分泌,降低神经干细胞凋亡率,对神经细胞的生存具有积极意义。因此,HupA治疗AD的机制之一可能是通过直接作用于小胶质细胞,抑制小胶质细胞分泌细胞因子和趋化因子,减弱炎症反应,改善神经细胞生长的微环境并促进神经细胞的存活。然而HupA作用于小胶质细胞的具体信号通路及机制还有待进一步探索。
综上所述,HupA可以抑制小胶质细胞分泌细胞因子和趋化因子,改善炎症微环境,并减少神经干细胞的凋亡,产生神经保护作用,为AD的神经干细胞疗法提供了实验基础。
[1] Selkoe DJ.Developing preventive therapies for chronic diseases:lessons learned from Alzheimer's disease[J].Nutr Rev,2007,65(12 Pt 2):S239-S243.
[2] Wang R,Yan H,Tang XC.Progress in studies of huperzine A,a natural cholinesterase inhibitor from Chinese herbal medicine[J].Acta Pharmacol Sin,2006,27(1):1-26.
[3] Wang ZF,Wang J,Zhang HY,et al.Huperzine A exhibits anti-inflammatory and neuroprotective effects in a rat model of transient focal cerebral ischemia[J].J Neurochem,2008,106(4):1594-1603.
[4] Yang L,Ye CY,Huang XT,et al.Decreased accumulation of subcellular amyloid-beta with improved mitochondrial function mediates the neuroprotective effect of huperzine A[J].J Alzheimers Dis,2012,31(1):131-142.
[5] 兰艳纤,李金恒,王克万,等.神经干细胞原代培养方法的优化[J].中华神经医学杂志,2011,10(5):456-460.
[6] 韦美丹,林继宗,朱 宁,等.Aβ1-42作用的小胶质细胞对体外培养的神经干细胞生存的影响[J].中国病理生理杂志,2012,28(4):683-688.
[7] Zhang HY,Tang XC.Neuroprotective effects of huperzine A:new therapeutic targets for neurodegenerative disease[J].Trends Pharmacol Sci,2006,27(12):619-625.
[8] Wang J,Zhang HY,Tang XC.Huperzine a improves chronic inflammation and cognitive decline in rats with cerebral hypoperfusion[J].J Neurosci Res,2010,88(4):807-815.
[9] Perry RT,Collins JS,Wiener H,et al.The role of TNF and its receptors in Alzheimer's disease[J].Neurobiol Aging,2001,22(6):873-883.
[10] Langmann T.Microglia activation in retinal degeneration[J].J Leukoc Biol,2007,81(6):1345-1351.
[11]Wang ZF,Tang XC.Huperzine A protects C6 rat glioma cells against oxygen-glucose deprivation-induced injury[J].FEBS Lett,2007,581(4):596-602.
[12] Wang J,Chen F,Zheng P,et al.Huperzine A ameliorates experimental autoimmune encephalomyelitis via the suppression of T cell-mediated neuronal inflammation in mice[J].Exp Neurol,2012,236(1):79-87.
[13] Oltvai ZN,Milliman CL,Korsmeyer SJ.Bcl-2 heterodimerizes in vivo with a conserved homolog,Bax,that accelerates programmed cell death[J].Cell,1993,74(4):609-619.
