小鼠耐药蛋白的测定及耐药癫疒间所致脑损伤的研究
2013-10-16陈淑良刘向阳
张 策,陈淑良,刘向阳
癫疒间在经过正规服用抗癫疒间药物治疗后,虽然能够达到正常的血药浓度,但其中仍有约30%的患者不能达到有效控制[1],进而进展成为难治性对于这种难治性癫疒间的产生机制尚存在争议,现基本考虑为多种机制共同作用的结果,在对癫疒间患者脑部不同部位的切片进行分析的过程中发现,癫疒间患者脑内神经细胞缺失,星型胶质细胞高度表达,胶质纤维酸蛋白高度表达,神经细胞的神经核、胞体、树突等均有明显的病理改变[2]。其中,P-糖蛋白等多种耐药蛋白的高度表达是目前学术界比较公认的产生癫疒间耐药的一个机制[3-5],作为这种耐药性的深入研究,耐药癫疒间模型的制作具有基础性意义。本研究采用小鼠制作耐药癫疒间模型,同时考察耐药癫疒间小鼠脑内P-糖蛋白的表达情况及脑组织的损伤情况,为耐药模型逆转的进一步研究奠定理论基础。
1 实验材料与方法
1.1 实验动物 成年雄性昆明种小鼠(18~25 g),由大连医科大学SPF实验动物中心提供,实验期间小鼠生活在20~24℃环境下,环境湿度50% ~65%,自然昼夜节律。给予正常鼠粮和饮用水。
1.2 癫疒间模型的建立 取10只小鼠,每日给予低于痉挛剂量的致痫药物戊四氮,40 mg/kg,每日12点腹腔注射,连续注射7 d。每次注射后观察小鼠癫疒间情况0.5 h,记录小鼠癫疒间发作级别和持续时间,小鼠癫疒间发作级别按racine分级定义如下[6]:0级:无明显反应;1级:面部自主性运动(如舔吃,咀嚼);2级:点头、甩头、眨眼、面部痉挛;3级:2级+单侧或交替性双侧前肢痉挛;4级:2级+后退、双侧前肢痉挛;5级:4级+动物跌倒、尾巴上翘,耳朵缩卷。产生“5次连续的2级癫疒间或3次连续的4 级以上癫疒间”确认癫疒间点燃成功[7]。
1.3 耐药模型的建立[8]将癫疒间模型制作成功的小鼠给予低剂量苯妥英钠40 mg/kg,1次/d灌胃给药,连续给药14 d,给药后考察癫疒间小鼠的癫疒间发作情况,将给药后仍有癫疒间发作并符合“产生5次连续的2级癫疒间或3次连续的4级以上癫疒间”的小鼠确定为耐药癫疒间小鼠。另取20只小鼠按随机数字表随机分为2组,阴性对照组给予生理盐水,耐药癫疒间模型组制作耐药癫疒间模型,最后取制作耐药癫疒间模型成功的小鼠与阴性对照组一起进行P-糖蛋白的表达及组织化学研究。
1.4 小鼠脑内P-糖蛋白的测定 各组最后一次给药0.5 h后处死小鼠,快速取全脑。按脑组织重量(1 mg∶1 mL)加裂解液,匀浆。置冷冻离心机,13 000 r/min、4℃离心10 min。加1 mL上样缓冲液,10 μL 上样,聚丙烯酰胺凝胶膜,30 mA,1.5 h。9 V恒压转膜40 min,1×丽春红染液染25 min,4℃封闭过夜,将转移膜置于用PBS稀释200倍的一抗(鼠 C219 P-糖蛋白单克隆抗体Signet Labratories,USA),37 ℃水浴过夜,用 TTBS室温下脱色摇床洗10 min,共2次,再用TBS洗10 min。将转移膜与以PBS稀释12 000倍的二抗(C219第二抗体 Pakolytomatics,glostrup,Denmark)接触,37℃水浴1.5 h。用 TTBS室温洗10 min,共2次,再用TBS洗10 min,进行DAB显色反应,避光放置5~10 min,出现条带后终止反应,将膜片进行凝胶图像分析。
1.5 免疫组化法考察小鼠大脑损伤情况 各组小鼠脑组织标本采用10%甲醛固定,石蜡包埋后切片脱蜡至水,用0.01 M PBS洗5 min,共洗3次,置于3%H2O2室温下 15 min,再用 0.01 M PBS洗5 min,共洗3次,用动物羊血清室温孵育15 min,倾去,勿洗。加Caspase-3兔抗鼠一抗(工作浓度1∶50)4℃过夜18 h,室温下稳定30 min后用0.01 M PBS洗3次,每次洗5 min。加入生物素化羊抗兔二抗37℃孵育20 min,0.01 M PBS洗3次,每次5 min。DAB显色2 min,用流水冲洗10 min,苏木素复染 10 s,流水返蓝10 min,脱水、透明封片,镜下观察。
1.6 统计学方法 采用SPSS 13.0软件,计量资料采用±s表示,采用两独立样本的t检验考察两组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 耐药癫疒间模型的建立 戊四氮制作癫疒间模型7 d后,所有小鼠均由少癫疒间发作逐渐到5级发作,发作情况也趋于稳定。造模成功后,小鼠均表现了对声音敏感。在给予戊四氮第8天,给予低剂量苯妥英钠1次/d灌胃给药,连续应用14 d,将符合“产生5次连续的2级癫疒间或3次连续4级以上癫疒间”确定为耐药癫疒间模型,见图1。在本次试验中,10只小鼠中有2只小鼠没有耐药,耐药率为80%。

图1 戊四氮诱导苯妥英钠治疗的耐药癫疒间模型的建立(n=10)
2.2 P-糖蛋白在脑中的表达 小鼠造模成功后断头取脑,用Western blot方法考察脑内P-糖蛋白的表达情况,见图2。

图2 两组比较的Western blot蛋白条带
从小鼠P-糖蛋白的全脑表达来看,耐药癫疒间模型组较空白组小鼠脑内P-糖蛋白的表达显著增高(P<0.01),Gel-Pro analyzer灰度分析软件对条带进行分析,P-糖蛋白表达的光密度值的平均值及95%可信区间用柱形图表示。见图3。

图3 耐药癫疒间模型组小鼠脑内P-糖蛋白的表达情况
2.3 耐药癫疒间对小鼠脑组织的损伤 小鼠造模成功后处死取脑,HE染色结果显示无论是在海马区还是皮层区,耐药模型组与阴性对照组相比,小鼠脑内神经元排列凌乱,核膜不完整,核仁染固缩,变形(P<0.05),见图4。
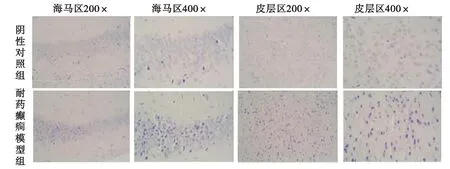
图4 小鼠脑海马和皮层HE染色结果
免疫组化Caspase-3实验显示无论是在皮层还是在海马区,与阴性对照组相比,耐药癫疒间模型组呈现Caspase-3的表达(P<0.05)。见图5。

图5 小鼠脑组织Caspase-3免疫组化结果
3 讨论
依据本文的方法能够建立比较稳定的耐药癫疒间模型,通过对筛选出的耐药癫疒间模型的相关研究发现,耐药癫疒间脑呈现P-糖蛋白的高度表达,支持P-糖蛋白高表达与癫疒间耐药伴随发生的观点,如果发现一种药物能够显著抑制这种P-糖蛋白的表达,将对临床具有实际意义。耐药癫疒间小鼠脑组织的免疫组化显示,耐药性癫疒间引起了小鼠大脑组织的损伤,造成大量的神经元坏死,这种坏死可能形成一个新的神经电传导通路[9],降低了癫疒间发作的阈值,使癫疒间患者的癫疒间更加不能控制。在免疫组化的研究中发现,采用Caspase-3的表达间接考察小鼠用药后脑细胞神经元的凋亡情况,得出耐药癫疒间的发生伴随着大量神经细胞的凋亡,可能参与了耐药性的产生。
[1]马爱梅,陈英辉,胡风云.MK-801对耐苯妥英钠和卡马西平癫疒间大鼠模型脑表达 P-糖蛋白的影响[J].中华神经科杂志,2010,43(6):444-446.
[2]Chengyun D,Guoming L,Elia M,et al.Expression of multidrug resistance type 1 gene(MDR1)P-glycoprotein in intractable epilepsy with different aetiologies:a double-labelling and electron microscopy study[J].Neurol Sci,2006,27:245-251.
[3]Volk HA,Burkhardt K,Potschka H,et al.Neuronal expression of the drug efflux transporter P-glycoprotein in the rat hippocampus after limbic seizures[J].Neuroscience,2004,123:751-759.
[4]Volk HA,Potschka H,Loscher W,et al.Increase expression of the multidrug transporter P-glycoprotein in limbic brain regions after amygdala-kindled seizures[J].Epilepsy research,2004,58:67-79.
[5]Volk HA,Potschka H,Loscher W,et al.Immunohistochemical localization of P-glycoprotein in rat brain and detection of its increased expression by seizure are sensitive to fixation and staining variables[J].Journal of Histochemistry and Cytochemistry,2005,34:517-531.
[6]吴俊芳.现代神经科学研究方法[M].北京:中国协和医科大学出版社,2006:726.
[7]Liu X,Yang Z,Yang J,et al.Increased P-glycoprotein expression and decreased phenobarbital distribution in the brain of pentyleneletrazole-kindled rats[J].Neuropharmacology,2007,53(5):657-663.
[8]Jing X,Liu X,Wen T,et al.Combined effects of epileptic seizure and phenobarbital induced overexpression of P-glycoprotein in brain of chemically kindled rats[J].British Journal of Pharmacology,2010,159:1511-1522.
[9]Pitkanen A.Drug-mediated neuroprotection and antiepileptogenesis:Animal data[J].Neurology,2002,59(5):S27-S33.
