杜仲籽油混合脂肪酸制备工艺优化及脂肪酸组成分析
2013-10-10吴丽雅杨万根陈功锡麻成金
吴丽雅,黄 群,余 佶,杨万根,陈功锡,麻成金,*
(1.吉首大学植物资源保护与利用湖南省高校重点实验室,湖南吉首416000;2.吉首大学食品科学研究所,湖南吉首416000)
α-亚麻酸(α-Linolenic acid,ALA)属于n-3不饱和脂肪酸,它是人体不能产生,只能从体外获得的必需的不饱和脂肪酸之一,α-亚麻酸在“必需脂肪酸与人类营养健康国际研讨会”上被定为“21世纪绿色营养保健食品”,α-亚麻酸的功效引起了国内外专家学者的广泛兴趣。杜仲翅果出籽率为28%,翅果的含油量为30%左右,杜仲籽油中含有丰富的不饱和脂肪酸,其中α-亚麻酸的含量高达60%,因此杜仲籽油是一种拥有高附加值的功能性油脂[1-3]。本实验以杜仲籽油为原料,在常压下,皂化水解制备杜仲籽油混合脂肪酸,并通过响应面法优化实验,得到了制备杜仲籽混合油脂肪酸的优化工艺条件,并对脂肪酸的种类和含量进行分析,为进一步分离提取和纯化杜仲籽油α-亚麻酸提供实验依据。
1 材料与方法
1.1 材料与仪器
杜仲籽油 于2011年采用超临界CO2萃取而得,并且避光储存,检测其皂化值为180mg KOH/g;氢氧化钾、95%乙醇、盐酸、无水硫酸钠、正己烷、浓硫酸等 均为国产分析纯;甲醇、正己烷 为色谱纯。
HH-S2型恒温水浴锅 金坛市成辉仪器厂;PHSJ4A型实验室pH计 上海精密科学仪器有限公司;101-2AB型电热鼓风干燥箱 天津市泰斯特仪器;FA2004型电子天平 上海舜宇恒平科学仪器有限公司;RE-52AA型旋转蒸发仪 金坛市成辉仪器厂;TG165型台式高速离心机 长沙平凡仪器表有限公司;7890A-5975C型气相色谱-质谱联用仪 美国Aglient公司。
1.2 实验方法
1.2.1 常压皂化水解制备杜仲籽油脂肪酸的工艺流程 10g杜仲籽油→KOH-乙醇溶液皂化回流→室温冷却→正己烷萃取→10%盐酸酸化皂化物→静置分层→有机相水洗至中性→脱水、回收正己烷→杜仲籽油混合脂肪酸。
1.2.2 杜仲籽油脂肪酸酸值测定 杜仲籽油脂肪酸酸值的测定参考GB/T 5530-2005/ISO 660:1996方法。
1.2.3 杜仲籽油脂肪酸组成分析 称量皂化水解后的杜仲籽油脂肪酸1g置于圆底烧瓶中,加入10mL(1∶10,V/V)溶液,放入恒温水浴锅中,75℃回流1h,室温冷却,用正己烷萃取2次,合并两次萃取液,蒸馏水洗涤多次,无水硫酸钠干燥,5000r/min离心10min,取上清液备用[4-5]。
色谱条件:Agilent 190191S-433型石英毛细管柱(325℃,30min×250min×0.25μm),载气为高纯度的氦气(99.999%),柱前压69.8kPa,柱内载气流速2mL/min;升温程序:80℃保持2min,以10℃/min升温到160℃,保持2min,再以5℃/min升温到250℃,保持5min,载气流速1mL/min,分流比80∶1,进样量1μL。质谱条件:EI离子源230℃,溶剂延迟4min,电子能量70eV,分辨率1000。
1.3 单因素实验设计
每次实验称取杜仲籽油10g,分别对超量碱(占理论碱量)(25%、30%、35%、40%、45%、50%、55%),KOH-乙醇溶液/油的比例(mL∶g)(1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7:1),皂化温度(60、65、70、75、80、85、90℃),皂化时间(40、50、60、70、80、90、100min),酸化pH(1.5、2.0、2.5、3.0、3.5)进行单因素实验,考察各个因素对杜仲籽油混合脂肪酸酸值的影响。
1.4 响应面优化实验设计
响应面法是通过回归方程拟合单因素实验得到的数据,评价指标和因素间的非线性关系,得到了最优的工艺参数[11-13]。应用SAS 9.1数据分析软件,根据Box-Behnken实验设计原理,综合单因素实验结果,以杜仲籽油脂肪酸酸值为响应值,选取超量碱、皂化温度、皂化时间和酸化pH为考察因素,优化制备杜仲籽油混合脂肪酸,实验因素水平表见表1。

表1 Box-Behnken实验因素水平表Table 1 Factors and levels of Box-Behnken design
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 超量碱对杜仲籽油脂肪酸酸值的影响 10g杜仲籽油,在恒定KOH理论用量1.8g,皂化温度75℃,皂化时间80min,酸化pH为2.5条件下,考察不同超量碱对酸值的影响,如图1所示。

杜仲籽油的皂化值为180mg KOH/g,因此根据皂化值确定每10g杜仲籽油需要理论碱量为1.8g KOH,但因为KOH是强碱,易吸收空气中的水分而发生潮解,而且在皂化反应中不仅是催化剂,并且可以中和反应生成脂肪酸得到脂肪酸钾盐使反应向正方向进行,因此,实际操作中需要KOH量要高。由图1可见,随着超量碱的增多,皂化逐渐完全,杜仲籽油的酸值逐渐增大[6]。当超量碱为50%时,酸值达到最大。KOH用量过多,后面酸解和水洗会对脂肪酸产生影响,使杜仲籽油脂肪酸酸值减小,因此,选择KOH用量高于理论用量50%。
2.1.2 KOH乙醇溶液/油的比例对杜仲籽油脂肪酸酸值的影响 10g杜仲籽油,在恒定KOH理论用量1.8g,加入超量碱50%,皂化温度75℃,皂化时间80min,酸化pH为2.5条件下,考察不同KOH乙醇溶液/油的比例对酸值的影响,如图2所示。
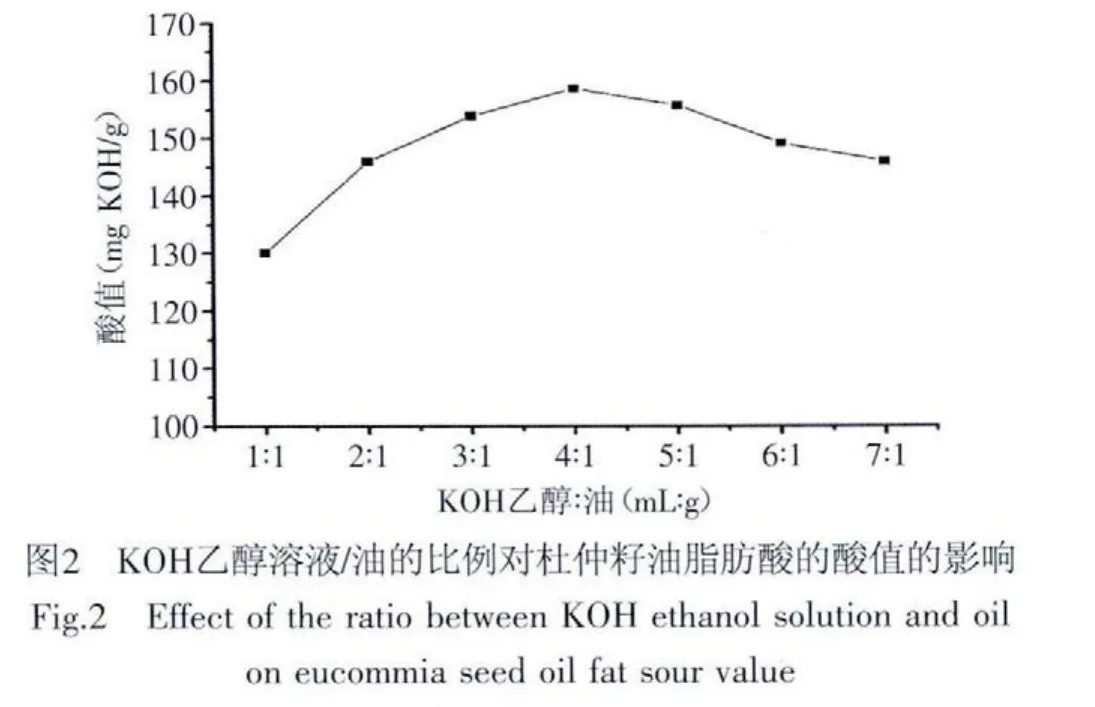
在皂化反应中,油脂含水量少,KOH不易溶解,而油脂、KOH和水会在乙醇的作用下形成了一个均相体系,为加快反应速度,KOH乙醇溶液/油比例对酸值有不同的影响。由图2可知,KOH乙醇溶液和油的比例小于4∶1时,皂化反应不完全,生成脂肪酸钾盐溶液,而当乙醇溶液过量时,不仅反应速度降低,生成粘性大的中间皂,使酸值减小,而且,增加乙醇用料,提高成本[7]。因此,KOH乙醇溶液/油的适宜比例是4∶1。
2.1.3 皂化温度对杜仲籽油脂肪酸酸值的影响 10g杜仲籽油,在恒定KOH理论用量1.8g,加入超量碱50%,皂化时间80min,酸化pH2.5条件下,考察不同皂化温度对酸值的影响如图3所示。

随着皂化温度的升高,反应物的活性增大,利于油和碱的混合,反应速率加快,皂化水解越完全,酸值也逐渐增大[8]。在75℃时,混合脂肪酸的酸值最大,当温度高于75℃时,部分不饱和脂肪酸稳定性会降低,酸值会减小,因此选择皂化温度为75℃为宜。
2.1.4 皂化时间对杜仲籽油脂肪酸酸值的影响 10g杜仲籽油,在恒定KOH理论用量1.8g,加入超量碱50%,皂化温度75℃,酸化pH2.5条件下,考察不同皂化时间对酸值的影响如图4所示。
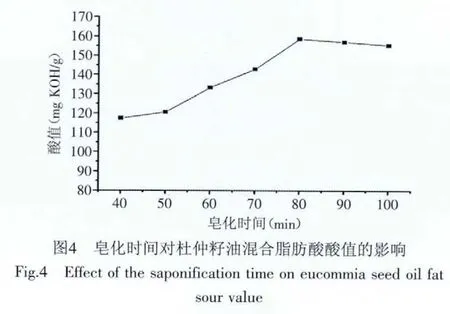
随着皂化时间的增加,混合脂肪酸的酸值在逐渐增大,当皂化时间为80min时,皂化完全,脂肪酸的酸值达到了最大,时间进一步延长,杜仲籽油已皂化完全,对酸值影响不大,但由于时间增加,热量逐渐增多,温度升高,所含的不饱和脂肪酸会部分氧化,酸值有所减小,并且造成了不必要的损失[9-10]。因此,皂化时间选择80min。
2.1.5 酸化pH对杜仲籽油脂肪酸酸值的影响 10g杜仲籽油,在恒定KOH理论用量1.8g,加入超量碱50%,皂化温度75℃,皂化时间内80min条件下,考察酸化时不同pH对酸值的影响如图5所示。

盐酸酸解脂肪酸钾盐得到脂肪酸,因为脂肪酸钾盐中的羧基具有得质子能力,而盐酸具有给予质子的能力。pH较小时,体系中H+较多,酸化易进行,而随着pH逐渐增大,即H+逐渐减少,酸化不易进行,杜仲籽油脂肪酸酸值减小,因此,酸化pH选择2.5。
2.2 响应面法优化实验结果与分析
2.2.1 Box-Behnken实验因素水平和实验方案 在前期单因素实验基础上,根据Box-Behnken实验设计原理,每组称取10g杜仲籽油,恒定KOH理论用量1.8g,KOH乙醇溶液/油的比例为4∶1,选取超量碱、皂化温度、皂化时间和酸化pH四个因素,采用四因素三水平实验设计优化实验,每组酸值测三次,取其平均值,实验方案及结果见表2。

表2 Box-Behnken实验方案设计及结果Table 2 Design and results of Box-Behnken experiment

表3 方差分析Table 3 Variance analysis
2.2.2 各因素与杜仲籽油脂肪酸酸值模型的建立与检验 应用SAS9.1软件对表2中实验结果进行回归拟合分析,回归模型方程如下:
Y=157.1333+7.7275X1+7.470833X2+3.865X3+4.893333X4-0.3875X1X2-0.77X1X3+3.475X1X4-0.39X2X3+3.865X2X4+0.384X3X4-14.555X12-13.7825X22-13.39625X32-11.07875X42
通过方差分析及相关系数检查该回归模型的可靠性,结果见表3。
由表3可知,模型p=0.0001<0.01,回归模型极显著,回归方程的复相关系数R2=0.9717,调整后复相关系数R2Adj=0.9387,说明该模型拟合度较好,而且失拟项p=0.069>0.05检验不显著,表明了杜仲籽油脂肪酸实际酸值和预测酸值拟合度较高,因此该模型可以确定制备杜仲籽油混合脂肪酸的最佳工艺条件。一次项X1、X2、X3、X4和二次项X12、X22、X32、X42均达到了极显著的水平;方差分析表中F值表明各个因素对酸值影响的顺序是:超量碱>皂化温度>酸化pH>皂化时间,而且X1X4和X2X4即超量碱和酸化pH、皂化温度和酸化pH的交互作用达到了显著水平,说明了各个因素对杜仲籽油混合脂肪酸的影响是非线性关系[11-14]。回归方程简化为:Y=157.1333+7.7275X1+7.470833X2+3.865X3+4.893333X4+3.475X1X4+3.865X2X4-14.555X12-13.7825X22-13.39625X32-11.07875X42。


表4 杜仲籽油混合脂肪酸组成及相对含量Table 4 Fatty acid and relative contents in Eucommia ulmoids oliv seed oil
2.2.3 响应面分析 响应曲面图是响应值和对应的个因素所构成的三维曲面图。常压皂化水解制备杜仲籽油脂肪酸的响应面分析和优化模型中交互作用显著的曲面图见图6和图7。曲面的陡峭可以反映该实验因素对响应值的影响大小,曲面越陡,影响越大,反之影响小。由图6可知,超量碱的曲面较陡,而酸化pH的曲面较平缓,说明超量碱对杜仲籽油混合脂肪酸酸值的影响大于pH。由图7看出。皂化温度曲面较酸化pH陡,说明了皂化温度对杜仲籽油混合脂肪酸的影响大于酸化pH的影响[11-14]。
2.2.4 最佳工艺条件确定和验证实验 为了确定最佳点,对回归方程求一阶偏导,并令其为0得出了最佳水平值:X1=0.29639,X2=0.31034,X3=0.13587,X4=0.32382,Y=160.49,通过编码公式Xi=(xi-xo)/△j将编码值转变成实际参数:超量碱为51.48195%,皂化温度76.5517℃,皂化时间81.3587min,酸解pH为2.66191。
考虑到实际操作的方便,按照实际操作值,超量碱为52%,皂化温度77℃,皂化时间82min,酸化pH为2.7条件下测得实际酸值为159.19mg KOH/g,相对标准偏差为0.81%,表明了与理论预测值相差不大,而且高于优化实验组中的数据,说明Box-Behnken优化实验得到的制备杜仲籽油混合脂肪酸的优化工艺条件是可靠的。
2.3 杜仲籽油混合脂肪酸GC-MS分析结果
皂化水解制得的杜仲籽油混合脂肪酸甲酯化后,分析脂肪酸组成,并用GC-MS随机带的NIST 08谱库进行定性分析,匹配度大于99%的脂肪酸见表4,采用峰面积归一法分析相对含量,杜仲籽油脂肪酸的离子流程图见图8。

图8 杜仲籽油脂肪酸总离子流程图Fig.8 Total ionization chromatogram of eucommia ulmoids oliv seed oil fatty acid
从表4看出,杜仲籽油混合脂肪酸中含有不饱和脂肪酸为棕榈油酸、亚油酸、油酸和α-亚麻酸,相对含量高达87.84%,其中α-亚麻酸的相对含量为60.14%,与未皂化水解杜仲籽油的组成和含量相近[15]。
3 结论
通过单因素实验和响应面法优化实验,综合上述分析,建立了回归方程,确定了杜仲籽油混合脂肪酸制备优化工艺条件为:超量碱52%,皂化温度77℃,皂化时间82min,酸化pH为2.7,在此优化条件下测得实际酸值为159.19mg KOH/g,与模型的理论预测值相近,相对标准偏差为0.81%,说明模型具有很好的实用性。
通过气相色谱-质谱联用仪对杜仲籽油混合脂肪酸进行分析可知,制得杜仲籽油混合脂肪酸中含有肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、亚油酸、油酸和α-亚麻酸等脂肪酸,不饱和脂肪酸相对含量达87.84%,其中α-亚麻酸的相对含量为60.14%,可以作为下一步分离提取杜仲籽油α-亚麻酸的原料。
[1]尤丽菊,刘国玲.α-亚麻酸的药理作用[J].中国社区医师,2011,13(29):10-11.
[2]Zhang Liang-xiao,Ji Xiao-yan,Tan Bin-bin,et al.Identification of the composition of fatty acids in Eucommia ulmoides seed oil by fraction chain length and mass spectrometry[J].Food Chemistry,2010,121(3):815-819.
[3]Graham C Burdge,Philip C Calder.Dietary a-linolenic acid and health-related outcomes:a metabolic perspective[J].Nutrition Research Reviews,2006,19(1):26-52.
[4]寇秀颖,于国萍.脂肪和脂肪酸甲酯化方法研究[J].食品研究与开发,2005,26(2):46-47.
[5]薛华丽.尿素包合法分离花椒籽油中α-亚麻酸工艺研究[J].中国酿造,2012,31(7):103-106.
[6]陈晨,李国荣,李建科,等.蚕蛹油不饱和脂肪酸提取及氧化稳定性研究[J].中国油脂,2012,37(4):20-24.
[7]谢静.花椒籽油及其α-亚麻酸的分离纯化技术研究[D].重庆:西南大学,2010:21-25.
[8]胡爱军,刘雪,郑捷,等.超声波和相转移催化剂在棕榈油皂化反应中的应用研究[J].中国油脂,2012,37(4):40-43.
[9]吕微,蒋剑春,徐俊明.植物油脂水解工艺及不饱和脂肪酸组成研究[J].食品工业科技,2011,32(9):76-79.
[10]刘世平,张弘,周梅村,等.微波皂化法制备紫胶桐酸[J].食品科学,2011,32(14):79-84.
[11]辛晓晨,裴志胜,袁腊梅,等.响应面法优化超声-微波协同萃取槟榔籽油及其脂肪酸组成分析[J].食品科学,2012,33(2):67-71.
[12]麻成金,黄伟,黄群,等.响应面法优化超声波辅助提取仿栗籽油工艺及其脂肪酸组成分析[J].食品科学,2012,33(16):24-29.
[13]李佩艳,王锋,尹飞,等.响应面法优化酶法提取红薯叶总黄酮的工艺[J].食品工业科技,2012,33(1):275-281.
[14]刘益红,周建军,徐顶巧.响应面分析法优化艾叶中绿原酸提取工艺[J].食品工业科技,2012,33(9):263-267.
[15]赵德义,徐爱遐,张博勇,等.杜仲籽油与紫苏籽油脂肪酸组成的比较研究[J].西北植物学报,2005,25(1):191-193.
