竹荪多糖提取方法的比较研究
2013-10-10张素斌李晓平
张素斌,李晓平
(肇庆学院化学化工学院,广东肇庆526061)
竹荪(Dictyophora duplicata),属于真菌门、担子菌亚门、腹菌纲、鬼笔目、鬼笔科、竹荪属真菌[1]。竹荪是世界上名贵的大型食用菌之一,营养丰富,脆嫩爽口,素有“真菌皇后”之美誉。竹荪含有蛋白质、多种氨基酸、维生素、多糖和多种微量元素等营养成分,其所含的多糖是具有高活性的大分子物质,在抗肿瘤[2]、抗凝血[3]、抗炎症[4]、刺激免疫以及降血压、血糖[1]方面都有一定的疗效。食用菌生物多糖是一种非特异性免疫增强剂和免疫激活剂,广泛用于医药和保健食品,被称为“生物应答调节剂”[5]。食用菌多糖的提取方法有热水浸提法、酸碱浸提法、超声波法、微波法、酶法、超声酶法等[5-6],但文献多局限于对其中的两或三种方法的比较。目前对竹荪多糖的提取方法研究不多,已报道的有热水提取法[7]、复合酶法[8]。近年来,有关食用菌多糖的研究很多,人们一直在努力寻找提取多糖的最佳方法以及不断获得新的功能性多糖资源。随着竹荪人工栽培规模的不断扩大,作为一种名贵的食用菌,对竹荪的研究也逐渐深入。本文以竹荪为原料,分别用热水提取法、超声波法、纤维素酶法、果胶酶法、木瓜蛋白酶法、复合酶法、超声复合酶法提取竹荪多糖,以竹荪多糖提取率为指标,采用单因素实验或正交实验优化竹荪多糖的提取工艺,并对7种提取方法进行比较。
1 材料与方法
1.1 材料与仪器
竹荪 产地为福建古田,购自肇庆大润发超市;苯酚、亚铁氰化钾、次甲基蓝、葡萄糖 均为分析纯,国药集团化学试剂有限公司;无水乙醇、硫酸、冰乙酸、乙酸钠、乙酸锌、硫酸铜、酒石酸钾钠、NaOH、HCl 均为分析纯,广州化学试剂厂;纤维素酶(2000IU/g)、木瓜蛋白酶(80.0万IU/g)、果胶酶(2.0万IU/g) 北京鸿润宝顺科技有限公司。
S22PC型可见分光光度计 上海棱光技术有限公司;SK8200H型台式超声清洗仪 上海科导超声仪器有限公司;HH-S2系列恒温水浴锅 江苏省金坛市环宇科学仪器厂;AUY120型电子分析天平Shimadzu Corporation Janpan;pHS-29A型酸度计 上海大普仪器有限公司。
1.2 实验方法
1.2.1 标准曲线的绘制 精密称取在105℃下烘干至恒重的葡萄糖0.1039g,置于小烧杯中,加水溶解定容至100mL,吸取10mL再定容至100mL。准确吸取所得0.1039mg/mL葡萄糖标准溶液0.2、0.4、0.6、0.8、1.0、1.2mL分别置于具塞刻度试管中,各加入蒸馏水使总体积为2.0mL,再分别加5%苯酚试液1.0mL,摇匀,迅速加浓硫酸5.0mL,摇匀后放置10min,置于沸水浴中加热15min,取出流水冷却至室温,另以蒸馏水2.0mL加5%苯酚和硫酸作空白对照,于487nm波长处测吸光度。结果得回归方程为Y=6.096X-0.003(X为葡萄糖浓度,mg/mL),r=0.9993。
1.2.2 竹荪多糖提取的工艺流程
1.2.2.1 样品处理 用粉碎机粉碎,过40目筛,在65~70℃烘干至恒重,密封备用。
1.2.2.2 热水提取、超声波提取与酶法提取 准确称取2g竹荪,置于烧杯中,加入蒸馏水,分别用恒温热水浴、超声提取一定时间,或加入HAc-NaAc缓冲溶液,加酶保温一定时间,加热灭酶。将不同方法的提取液冷却,转移至250mL容量瓶,定容,过滤,滤液备用。
1.2.2.3 超声复合酶法提取 准确称取2g竹荪,置于烧杯中,加入HAc-NaAc缓冲溶液,加复合酶保温一定时间,加热灭酶,冷却,超声提取一定时间,冷却,转移至250mL容量瓶,定容,过滤,滤液备用。
1.2.3 竹荪中还原糖与蔗糖等低聚糖总量的测定 准确称取2g竹荪,置于250mL容量瓶中,加入100mL水,在45℃水浴中提取30min,冷却,加入5mL醋酸锌与5mL亚铁氰化钾溶液,加水至刻度,混匀,静置30min,干滤纸过滤,弃去初滤液。取滤液50mL至100mL容量瓶,加入6mol/L的HCl 5mL,在68~70℃水浴加热15min,冷却,加2滴甲基红,加入20%NaOH中和,定容,备用[9]。根据GB/T 5009.7-2003食品中还原糖测定法中的直接滴定法测定还原糖含量[10]。竹荪中还原糖与蔗糖等低聚糖的总量见式(1):
还原糖与蔗糖等低聚糖的总量(%)

式中:F为10mL碱性酒石酸铜溶液相当于葡萄糖的质量(mg);V1为滴定时平均消耗样液的体积(mL);m为样品质量(g)。
1.2.4 多糖提取率计算 准确吸取1.0mL竹荪提取液,定容至50mL,再准确吸取2mL,按1.2.1从“加5%苯酚试液1.0mL”起操作,在487nm波长处测定吸光度A,根据标准曲线求出样品液中竹荪总糖的含量。总糖含量见式(2):
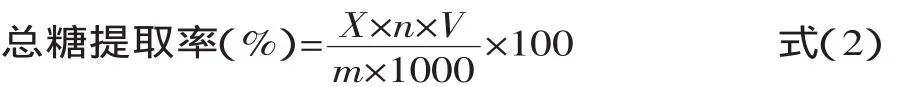
式中:X为测定样液总糖浓度(mg/mL);n为测定样液的稀释倍数;V为样液总体积(mL);m为样品质量(g)。
多糖提取率见式(3),若采用酶法及超声酶法用式(4):
多糖提取率(%)=总糖含量(%)-还原糖与蔗糖等低聚糖总量(%) 式(3)
多糖提取率(%)=总糖含量(%)-还原糖与蔗糖等低聚糖总量(%)-酶空白(%) 式(4)
2 结果与分析
2.1 热水提取、超声波提取与酶法提取结果与分析
2.1.1 热水提取法 按照1.2.2.2所述工艺流程用热水提取竹荪多糖,参考文献[11-13],考察影响热水提取效果的三个主要因素:料液比、温度、时间,每个因素取3个水平进行实验设计,正交实验设计及结果见表1。
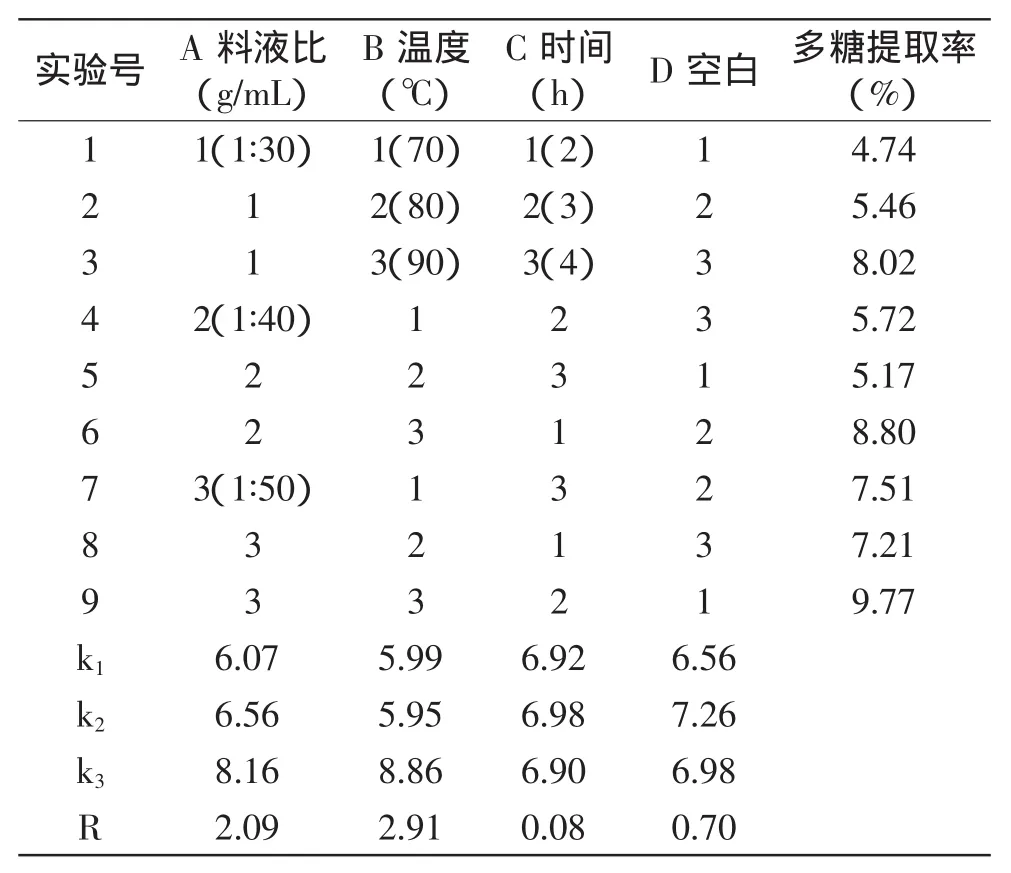
表1 热水提取法正交实验设计及结果Table 1 Orthogonal array design for optimizing hot water extraction and test results
由表1可知,最佳提取条件为A3B3C2,即料液比为1∶50,提取温度为90℃,提取时间为3h,竹荪多糖提取率为9.77%。在所选的因素及其水平范围内,对竹荪多糖提取率影响最大的是提取温度,其次是料液比,提取时间影响很小。由极差可知,时间减少为2h对结果影响不大,由于本文侧重比较各方法的提取率,因此仍选择3h为最佳。
2.1.2 超声波提取法 按照1.2.2.2所述工艺流程用超声波法提取竹荪多糖,因所用的超声仪不可调节温度与功率,超声功率固定为500W。用单因素实验确定料液比与超声时间。
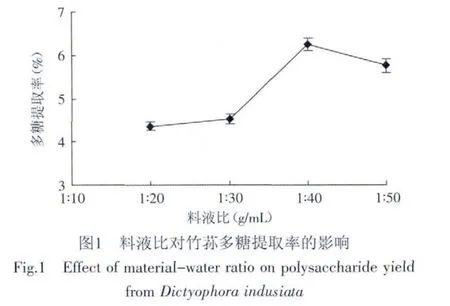
2.1.2.1 料液比的确定 选定超声时间为30min,仅改变料液比(g/mL)为1∶20、1∶30、1∶40、1∶50,测定结果见图1。由图1可知,当料液比在1∶20~1∶40时,多糖提取率呈上升趋势,料液比为1∶50时多糖提取率有所下降。在料液比达到1∶40之前,可能是由于样品为干品,本身也要吸收一部分水,加水太少,多糖溶出一定程度后溶液达到饱和,多糖就不能继续溶出。因此选定料液比为1∶40。
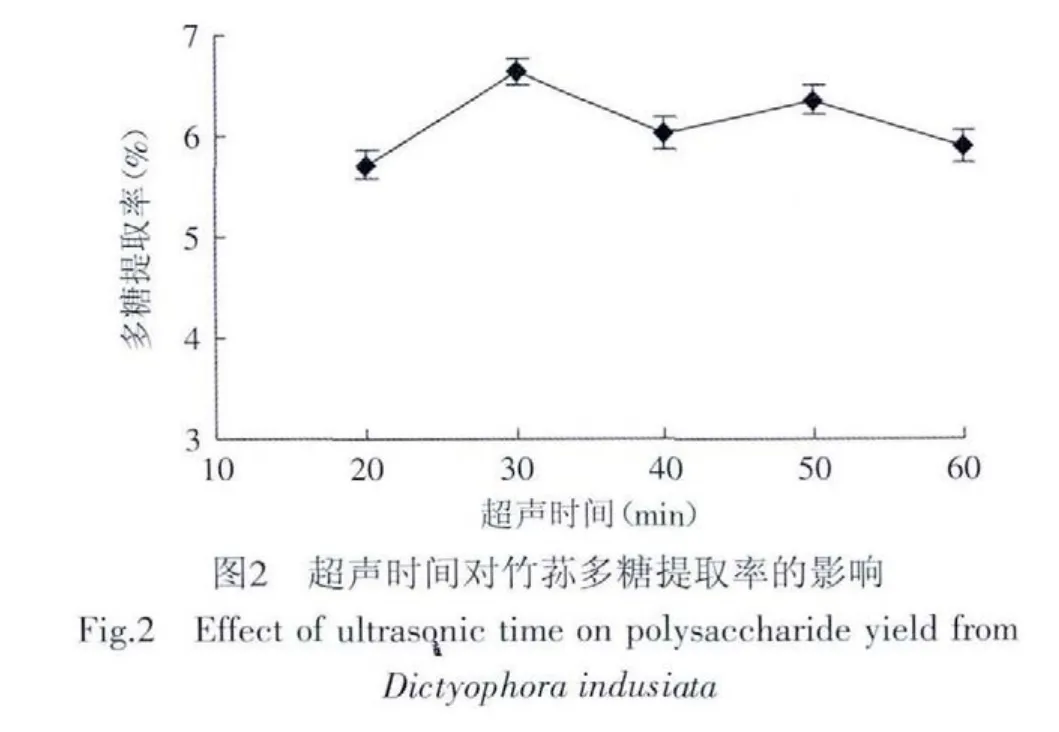
2.1.2.2 超声时间的确定 选定料液比为1∶40,超声时间分别选择为20、30、40、50、60min进行实验,结果见图2。由图2可知,最佳超声时间为30min,多糖提取率为6.64%。这可能由于超声时间过低时,多糖不能充分溶出,而时间过长又会使多糖结构被破坏,使多糖提取率下降。
2.1.3 纤维素酶法 按照1.2.2.2所述工艺流程用纤维素酶法提取竹荪多糖,参考文献[14-16],选择加酶量、酶解温度、酶解时间、酶解pH 4个因素为纤维素酶提取法的影响因素进行正交实验,实验设计及结果见表2。实验结果表明最佳提取条件为A2B3C2D3,即纤维素酶加酶量为0.5%,酶解温度为60℃,酶解时间60min,酶解pH为6。各因素对竹荪多糖提取率的影响顺序为:加酶量>酶解pH>酶解时间>酶解温度。按最佳提取条件进行验证实验,测得竹荪多糖提取率为8.84%,大于正交实验中的最高值8.03%。
2.1.4 果胶酶法 按照1.2.2.2所述工艺流程用果胶酶法提取竹荪多糖,参考文献[14,17],选择加酶量、酶解温度、酶解时间、酶解pH 4个因素为果胶酶提取法的影响因素进行正交实验,实验设计及结果见表3。实验结果表明最佳提取条件为A3B2C2D3,即果胶酶加酶量为1.0%,酶解温度为50℃,酶解时间60min,酶解pH为5.5。各因素对竹荪多糖提取率的影响顺序为:加酶量>pH>酶解时间>酶解温度。按最佳提取条件进行验证实验,测得竹荪多糖提取率为10.06%,大于正交实验中的最高值9.54%。
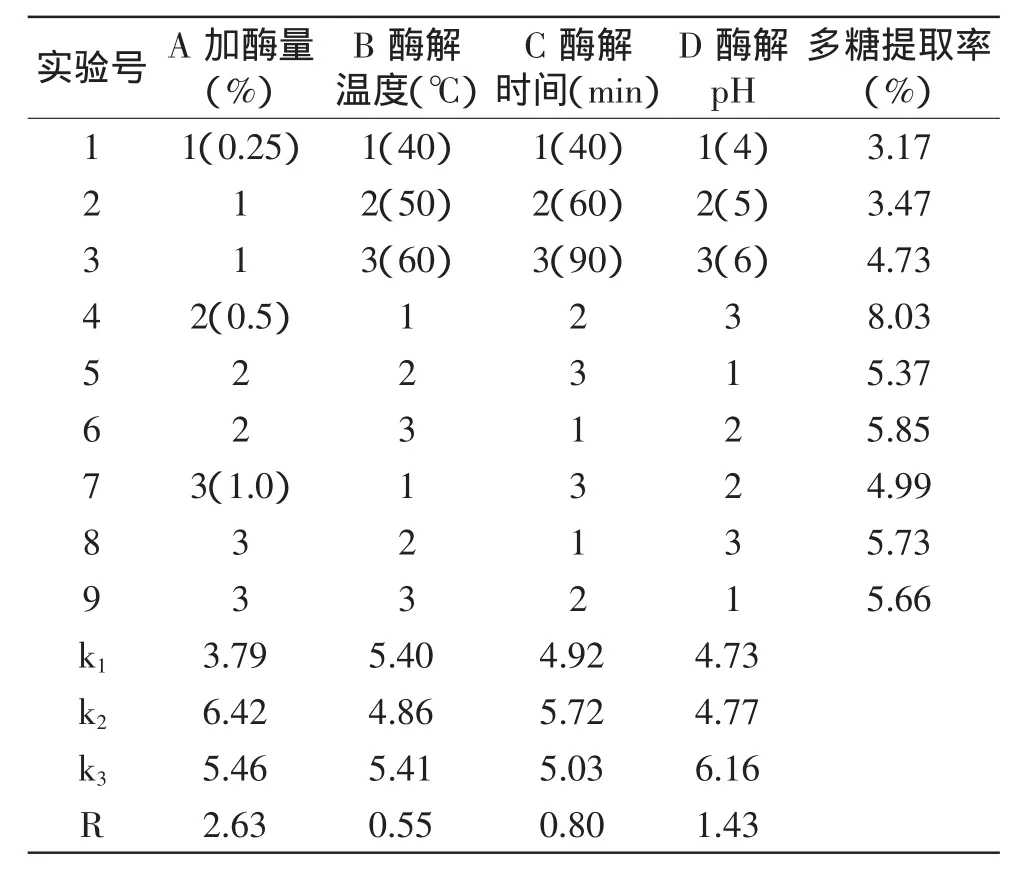
表2 纤维素酶法正交实验设计及结果Table 2 Orthogonal array design for optimizing cellulase extraction and test results
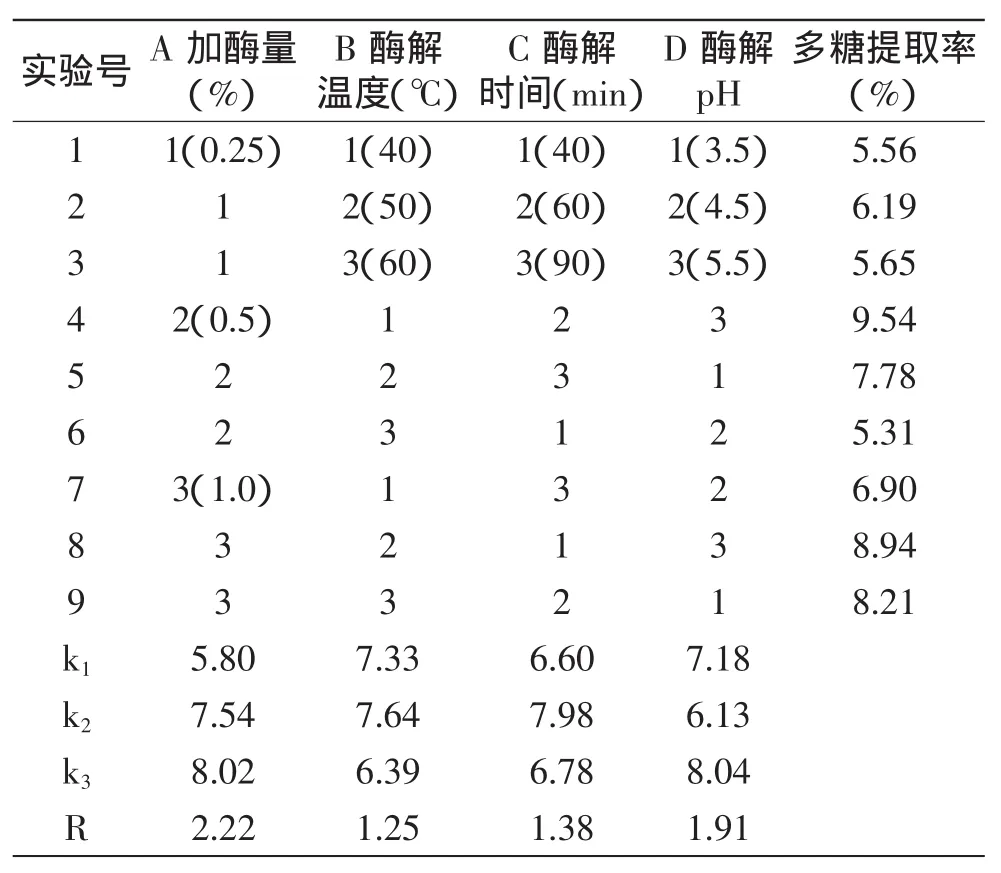
表3 果胶酶法正交实验设计及结果Table 3 Orthogonal array design for optimizing pectinase extraction and test results
2.1.5 木瓜蛋白酶法 按照1.2.2.2所述工艺流程用木瓜蛋白酶法提取竹荪多糖,参考文献[14-15,18],选择加酶量、酶解温度、酶解时间、酶解pH 4个因素为木瓜蛋白酶提取法的影响因素进行正交实验,正交实验设计及结果见表4。实验结果表明最佳提取条件为A3B1C2D3,即木瓜蛋白酶加酶量为1.0%,酶解温度为40℃,酶解时间60min,酶解pH为5.5。各因素对竹荪多糖提取率的影响顺序为:加酶量>pH>酶解时间>酶解温度。按最佳提取条件进行验证实验测得竹荪多糖提取率为10.35%,大于正交实验中的最高值10.06%。
2.1.6 复合酶法 根据纤维素酶、果胶酶、木瓜蛋白酶的实验结果(表2~表4)可知,各因素对竹荪多糖提取率的影响顺序均为:加酶量>pH>酶解时间>酶解温度,说明加酶量及酶解pH对实验结果的影响较大,酶解时间影响较小,酶解温度的影响最小,即在40~60℃温度范围内进行酶解对实验结果影响很小,因此固定酶解温度为50℃,而三种酶的酶解时间均为60min,因此固定复合酶解时间为60min。按照1.2.2.2所述工艺流程用复合酶法提取竹荪多糖,选择纤维素酶、果胶酶、木瓜蛋白酶的加酶量以及酶解pH4个因素为复合酶提取法的影响因素进行正交实验,实验设计及结果见表5。实验结果表明最佳工艺条件为A1B2C3D3,即纤维素酶量为0.25%,加果胶酶酶量为0.5%,加木瓜蛋白酶酶量为1.0%,酶解pH为6。各因素对竹荪多糖提取率的影响顺序为:果胶酶量>纤维素酶量>酶解pH>木瓜蛋白酶量。按最佳提取条件进行验证实验测得竹荪多糖提取率为11.27%,大于正交实验中的最高值10.69%。由于纤维素酶可以破坏植物细胞壁,果胶酶和木瓜蛋白酶可以将果胶质和蛋白质水解,使多糖溶出增加,三种酶的共同作用,对多糖成分的溶出有较大的促进作用。

表4 木瓜蛋白酶法正交实验设计及结果Table 4 Orthogonal array design for optimizing papain extraction and test results
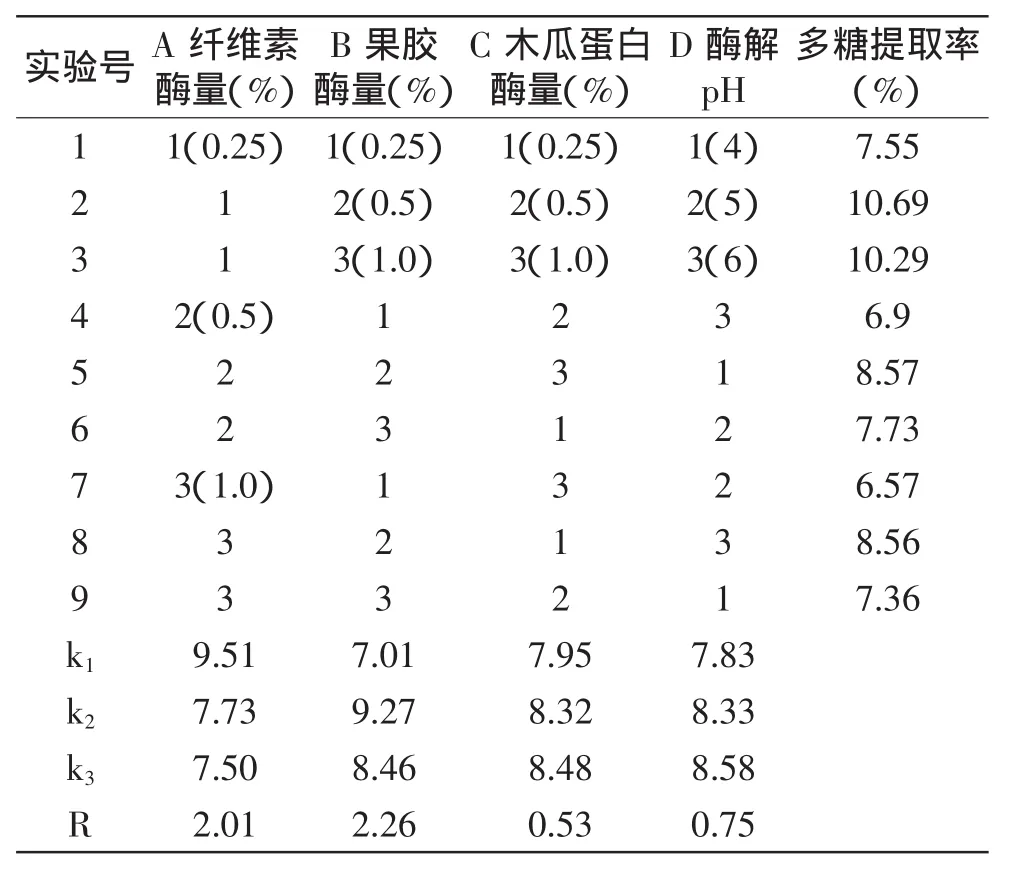
表5 复合酶法正交实验设计及结果Table 5 Orthogonal array design for optimizing multi-enzymatic extraction and test results
2.2 超声复合酶法提取结果与分析
根据超声波提取、纤维素酶提取、果胶酶提取、木瓜蛋白酶提取及复合酶提取的实验结果,固定加纤维素酶量为0.25%,加果胶酶酶量为0.5%,加木瓜蛋白酶酶量为1%,酶解温度为50℃,按照1.2.2.3所述超声复合酶法提取的工艺流程,选择料液比、酶解时间、酶解pH以及超声时间4个因素为超声复合酶提取法的影响因素进行正交实验,实验设计及结果见表6。由表6可知,最佳提取条件A3B2C3D3,即料液比为1∶50,酶解时间60min,酶解pH为6,超声时间为40min。各因素对竹荪多糖提取率的影响顺序为:料液比>超声时间>酶解时间>酶解pH。按最佳提取条件进行验证实验测得竹荪多糖提取率为16.35%,大于正交实验中的最高值16.11%。这可能是因为多种酶的水解作用与超声的热效应和空化作用相结合而使多糖提取率大大提高。
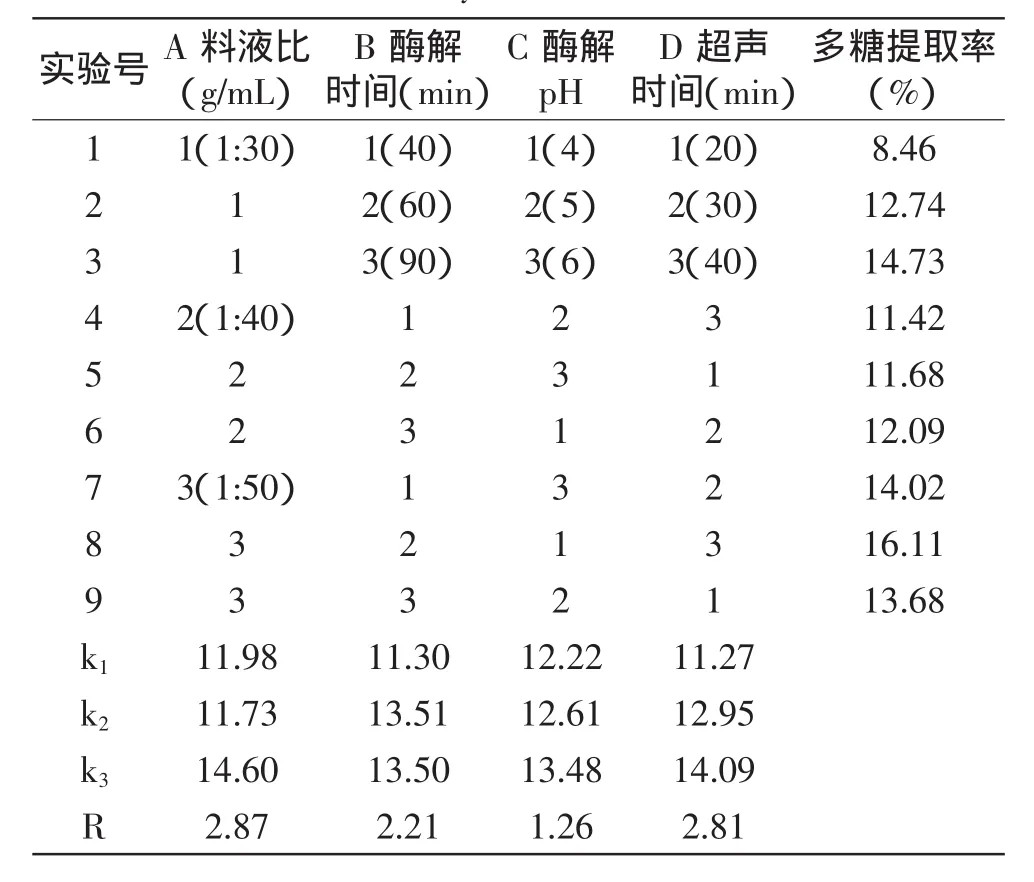
表6 超声酶法正交实验设计及结果Table 6 Orthogonal array design for optimizing ultrasonic combined with multi-enzymatic extraction and test results
2.3 七种多糖提取方法的比较
本文通过分别采用热水提取法、超声波法、纤维素酶法、果胶酶法、木瓜蛋白酶法、复合酶法、超声复合酶法提取竹荪多糖,得出各种方法的最佳提取条件以及在最佳条件下的竹荪多糖提取率。不同方法的多糖提取率及提取时间见表7。
从表7看出,果胶酶法与热水提取法、木瓜蛋白酶法的多糖提取率差异不显著,用纤维素酶法所得多糖提取率较低,但复合酶法则比热水提取法的多糖提取率高,而几种酶法提取所用时间均比热水提取法要短。并不是所有酶都能使竹荪的多糖提取率增加,用果胶酶与木瓜蛋白酶处理竹荪对多糖的溶出促进作用较大,三种酶的联合作用更佳。超声波法用时最短,但多糖提取率也最低,这与姜宁[19]、贲永光[20]的结论不同,可能与样品不同有关。将复合酶法与超声波法相结合提取多糖时,多糖提取率大幅提高,所用时间也比热水提取法大为减少,这与陶涛[21]、谢丽源[22]结论一致,即超声酶法对多糖提取有较大促进作用。

表7 七种提取方法的比较Table 7 Comparison of seven methods
多糖类化合物广泛存在于动物细胞膜和植物、微生物的细胞壁中,因此先用复合酶处理竹荪样品,纤维素酶与果胶酶可破坏竹荪细胞壁,使其结构变得松散,木瓜蛋白酶降低了多糖与蛋白质的结合,几种酶的联合作用有利于多糖的溶出,再结合超声波处理,可以使多糖提取率大为增加,因此超声酶法是一种省时、高效的多糖提取方法。
3 结论
超声复合酶法提取竹荪多糖的最佳条件是料液比1∶50,酶解时间60min,酶解pH6,超声时间40min,多糖提取率为16.35%,而热水提取法多糖提取率为9.77%,超声波法为6.64%,纤维素酶法为8.84%,果胶酶法为10.06%,木瓜蛋白酶法为10.35%,复合酶法为11.27%。与热水提取法、超声波法、酶法比较,超声复合酶法提取的竹荪多糖提取率最高,所需时间也比一般的热水提取法大为减少,为竹荪多糖提取的较好方法。
[1]张静雯.竹荪的营养价值及食用方法[J].甘肃农业,2011(1):87-88.
[2]赵凯,王飞娟,潘薛波,等.红托竹荪菌托多糖的提取及抗肿瘤活性的初步研究[J].菌物学报,2008,27(2):289-296.
[3]林玉满,苏爱华.短裙竹荪(Dityophoraduplicata)凝集素纯化与生化性质[J].中国生物化学与分子生物学报,2005,21(1):101-107.
[4]袁德培.竹荪的研究进展[J].湖北民族学院学报:医学版,2006,23(4):39-41.
[5]孙靖轩,王延锋,王金贺,等.食用菌多糖提取技术研究概况[J].中国食用菌,2012,31(3):6-9.
[6]王雪冰,赵天瑞.食用菌多糖提取技术研究概况[J].中国食用菌,2010,29(2):3-6.
[7]高擎,华洋林,赵谋明.响应面法优化提取竹荪多糖的工艺研究[J].现代食品科技,2010,26(8):826-829.
[8]叶敏.复合酶法提取红托竹荪多糖的工艺研究[J].吉林师范大学学报:自然科学版,2012(2):145-147.
[9]华南理工大学,大连轻工业学院,郑州轻工业学院,等.食品分析[M].北京:中国轻工业出版社,2006:177-178.
[10]中华人民共和国卫生部.GB/T5009.1~5009.100-2003,中华人民共和国国家标准,食品卫生检验方法理化部分(一)[S].北京:中国标准出版社,2004:42-45.
[11]高愿军,张家泉,司俊娜,等.响应面法优化桦褐孔菌多糖提取工艺[J].食品研究与开发,2009,30(6):7-10.
[12]岳金玫,蒲彪,陈安均,等.响应面法优化块菌多糖的提取工艺[J].食品工业科技,2012,33(19):271-274.
[13]陈丹红.均匀设计优化鸡腿菇多糖提取工艺的研究[J].食品科技,2011,36(2):154-157.
[14]程俊文,吴学谦,贺亮,等.香菇子实体多糖分步酶解法提取研究[J].食用菌学报,2009,16(2):67-71.
[15]朱彩平,惠乐乐,柳小林,等.酶法提取平菇多糖工艺研究[J].中成药,2011,33(8):1435-1438.
[16]张利,范明才,冯喜文,等.铁皮石斛中石斛多糖与石斛碱的纤维素酶法提取研究[J].化学研究与应用,2011,23(3):356-359.
[17]姜红,孙宏鑫,李晶,等.酶法提取黑木耳多糖[J].食品与发酵工业,2005,31(6):131-133.
[18]梁敏,邹东恢,刘军.酶法提取金针菇多糖的研究[J].食品研究与开发,2012,33(11):100-102.
[19]姜宁,刘晓鹏,吴红江,等.金针菇菌丝体多糖超声提取工艺的研究[J].食品科学,2008,29(8):289-292.
[20]贲永光,钟红茂,李康,等.超声辅助提取螺旋藻多糖的实验研究性研究[J].中成药,2011,33(6):1078-1080.
[21]陶涛,李立祥,张芳,等.超声波协同纤维素酶对黄精多糖和皂苷的提取研究[J].食品工业科技,2012,33(9):271-275.
[22]谢丽源,王富伟,李洪军,等.超声波复合酶法提取桑黄多糖研究[J].食品科学,2010,31(10):81-85.
