核酸碱基互变异构体的结构、稳定性及其物理化学性质
2013-09-21曹国进郑卫军
曹国进 郑卫军
(1清华大学化学系,有机光电子与分子工程教育部重点实验室,北京100084;
2中国科学院化学研究所,分子反应动力学国家重点实验室,北京分子科学国家实验室,北京100190)
1 引言
核酸碱基是DNA及RNA分子的重要组成部分,它们在基因遗传信息的传递方面起着主导作用.1核酸碱基在DNA及RNA分子中主要以标准异构体形式存在,但是当它们与金属离子结合或成为激发态时,核酸碱基的标准异构体的分子内会发生质子转移,从而导致核酸碱基的异构化.2这些异构化后的核酸碱基稀有异构体通常能够导致碱基对的错配对,进而形成不规则的DNA分子结构,最终很可能导致DNA或RNA分子双螺旋发生自发突变.3例如稀有亚胺型异构体在金属阳离子存在的条件下变得更加稳定,这些异构体会进一步诱导有机体的突变.4,5因此,对核酸碱基的互变异构体进行系统的研究,有助于人们深入认识DNA和RNA分子的结构和性质.国际上有很多研究小组已经通过实验和理论对核酸碱基互变异构体的结构、相对能量及其性质进行了研究.因为在DNA或RNA分子中,核酸碱基的互变异构体会受到各种环境的干扰,所以,现在很多研究小组采用独立于DNA或RNA的分子骨架来研究核酸碱基的互变异构体.在实验方面,人们利用X射线晶体衍射实验技术测定了核酸碱基标准异构体的结构,并且还通过光谱技术包括紫外光谱、红外和拉曼光谱以及微波光谱等与理论计算相结合的方法确定了部分稀有异构体的相对含量和稳定性顺序.6理论计算方面,半经验、微扰理论以及密度泛函理论等方法经常被采用.很早之前人们就采用半经验方法对核酸碱基互变异构体进行了研究,但其结果与实验值偏差较大,后来人们较少采用这种方法.到目前为止密度泛函方法是研究核酸碱基最普遍采用的计算方法.van Mourik等7的研究表明密度泛函方法在研究尿嘧啶不同异构体的结构和相对稳定性方面值得信赖.此外,基组的选取同样会对碱基互变异构体的稳定性顺序产生一定的影响.尽管前人进行了很多研究,但是,以前的实验和理论研究一般针对于某一特定碱基的一部分互变异构体,还有一些互变异构体没有考虑到,研究仍不全面,对于核酸碱基的互变异构体的结构、相对稳定性缺乏系统的归纳总结,不同研究小组之间的研究结果也存在互相矛盾的地方.因此,本文对文献中涉及核酸碱基互变异构体的实验和理论研究进行了综述.在对前人研究进行归纳总结的基础上,我们还利用密度泛函方法对核酸碱基的所有可能的互变异构体进行了系统的理论计算,并根据它们的相对能量对所有可能的互变异构体进行了排序.同时,我们将计算结果与文献中已有的实验值进行了比较,计算结果与实验结果比较一致,因此,我们计算所得到的核酸碱基的互变异构体的结构、相对能量及排序是可信的,可以为人们研究核酸碱基、DNA、RNA分子提供重要参考.此外,因为核酸碱基的电子亲和能、电离能、质子亲和能等物理化学性质可以为生物、化学、材料等方面的研究提供重要的基础性信息,因此我们还对它们的相关研究进行了综述.
2 核酸碱基的互变异构体
2.1 尿嘧啶
尿嘧啶是构成RNA分子的一种重要碱基,在DNA分子中与它对应的碱基是胸腺嘧啶.国际上有多个研究小组对尿嘧啶的互变异构体开展了实验研究.1982年,Beak和White8通过量热实验发现尿嘧啶的羰基-烯醇(U3)异构体比它的二羰基(U1)异构体的能量高(79.5±25.1)kJ·mol−1.1986年,Ferenczy等9通过电子衍射实验测定了尿嘧啶的标准异构体的精确结构.1986年和1988年,Fujii和合作者10,11发现尿嘧啶的U2异构体要比U1异构体能量高40.2 kJ·mol−1.他们采用激光诱导荧光技术研究了超声分子束喷射冷却条件下的尿嘧啶,11发现尿嘧啶的U1和U3异构体在气相中是共同存在的.同样在1988年,Brown等12研究了尿嘧啶的微波谱,发现在气相中U1异构体是最稳定的异构体,并没有发现其他互变异构体.此外,尿嘧啶的光电子能谱实验、13紫外光谱实验、14,15红外和拉曼光谱实验16−18也证实了U1异构体在气相和凝聚相中为最稳定的结构.
国际上有不少研究小组对尿嘧啶互变异构体的结构和相对能量进行了理论计算.191970年,Bodor等20利用半经验方法中的Hückel分子轨道近似在没有优化结构只计算单点能的情况下得出尿嘧啶异构体的稳定性顺序为U1>U2>U11>U3>U4.1979年,Czermiński等21利用半经验MINDO/3方法对尿嘧啶异构体结构进行了优化并计算了能量,得到稳定性顺序为 U1>U3>U11>U2>U4>U10.1984年,Scanlan等22利用Hartree-Fock方法和3-21G基组计算得到尿嘧啶异构体的稳定性顺序是U1>U2>U3>U4>U10>U11.1987年,Saunders等23利用半经验算法如AM1、MINDO/3、INDO等预测了U1异构体为最稳定的异构体.1991年,Katritzky等24利用AM1方法对尿嘧啶的互变异构体做了势能面计算,发现U1异构体为势能曲线能量最低点,第二个次稳定异构体是能量较标准异构体高39 kJ·mol−1的U2异构体.1992年,Leszczynski25利用较为近似的计算方法和较小的STO-3G基组以及高精度的MP4方法和较大的6-31G(d,p)基组对尿嘧啶互变异构体进行了计算,发现U1异构体均为最低能量异构体,而后面互变异构体的相对能量受方法和基组的影响比较大.1993年,Boughton和Pulay26运用MP4(SDQ)/6-31G**研究了尿嘧啶六个异构体的结构和相对能量,得到稳定性顺序是 U1>U2>U3>U4>U10>U11.1994年,Estrin等27运用了局域和梯度校正的密度泛函(LDA+ZPE,NL1+ZPE,NL2+ZPE)计算方法得到相同的结果.1999年,Tian等28应用密度泛函理论及不同交换相关函数(SL,BLYP,B3LYP以及BHandH)研究了气相中尿嘧啶的八个异构体,得到了它们的稳定性顺序为 U1>U2>U3>U4>U5>U9>U11>U12.虽然之前这些研究小组利用半经验方法或从头算对尿嘧啶的互变异构体进行了理论计算,但是他们的计算仅涉及了最多8个尿嘧啶异构体.22,25,29−31实际上,2个氢原子还能够结合到尿嘧啶的N1、N3、O8和O10位点,另外,O―H键的方向不同会产生不同的顺反异构体,这样得到尿嘧啶的异构体的总数为13个,包括了1个二羰基异构体、4个二羟基异构体、4个2-羟基-4-羰基异构体、4个2-羰基-4-羟基平面互变异构体.Kryachko等32,33用B3LYP/6-31+G(d,p)对全部13个尿嘧啶的异构体结构和势能曲线进行了计算,发现了之前没计算的5个互变异构体,这5个异构体的相对能量在前面Tian等27计算得到的8个异构体的相对能量之间,此外他们还计算得到了其中一些异构体之间的势能曲线.
我们利用B3LYP/6-31++G(d,p)方法对尿嘧啶所有13个异构体几何结构和相对能量进行了计算,在计算过程中考虑了零点能的校正,结果列于图1中.B3LYP杂化泛函方法是一种较为经济的方法,该方法得到的结果与Kryachko等32,33的计算结果非常接近,最优结构参数也与实验值较为一致.
2.2 胸腺嘧啶
胸腺嘧啶可看作尿嘧啶C5配位氢被甲基所取代的产物.有一些研究小组已经对胸腺嘧啶互变异构体进行了实验研究.Ozeki等34早在1969年就测定了胸腺嘧啶标准异构体(T1)的晶体结构.1989年,Brown等35研究了胸腺嘧啶的微波谱,发现在气相中胸腺嘧啶的二羰基标准异构体(T1)是最主要的异构体,这与Ozeki得到的晶体结构较为一致.1999年,Morsy等36研究了胸腺嘧啶在室温下的荧光光谱,发现在水溶液中胸腺嘧啶标准异构体和稀有异构体的相对稳定性强烈依赖于溶液pH值的大小.
国际上一些理论研究小组已经对胸腺嘧啶的异构体进行了计算,但是这些计算只考虑了部分异构体.Scanlan和Hillier22利用从头算中的3-21G基组计算了其中6个异构体的相对能量,发现2,4-二羰基标准异构体(T1)是最低能量异构体,其几何结构参数也与实验值较为一致.实际上,胸腺嘧啶的互变异构体总共有13个,包括1个二羰基异构体、4个二羟基异构体、4个2-羟基-4-羰基异构体、4个2-羰基-4-羟基异构体.37,38虽然一些稀有异构体具有较高的相对能量,在一般条件下难以稳定存在,但是在热平衡条件改变情况下也可能会以较低浓度存在.Ha和Gunthard38运用HF/6-31G(d,p)和MP2/HF/6-31G(d,p)对所有13个异构体进行了结构优化和相对能量计算,并用HF/6-31G(d,p)预测了从反式转变为顺式时的能量变化.例如2-羟基-反式-4-羰基-N1H异构体(T7)到 2-羟基-顺式-4-羰基-N1H(T13)异构体转变时的能量变化约为27.2(±3.3)kJ·mol−1.
我们利用B3LYP/6-31++G(d,p)方法对胸腺嘧啶所有13个异构体的几何结构和相对能量进行了计算,在计算过程中同样考虑了零点能的校正,结果列于图2中.此能量顺序与Ha等38的计算结果非常接近,最优几何结构与上述实验测量值也较为一致.
2.3 胞嘧啶
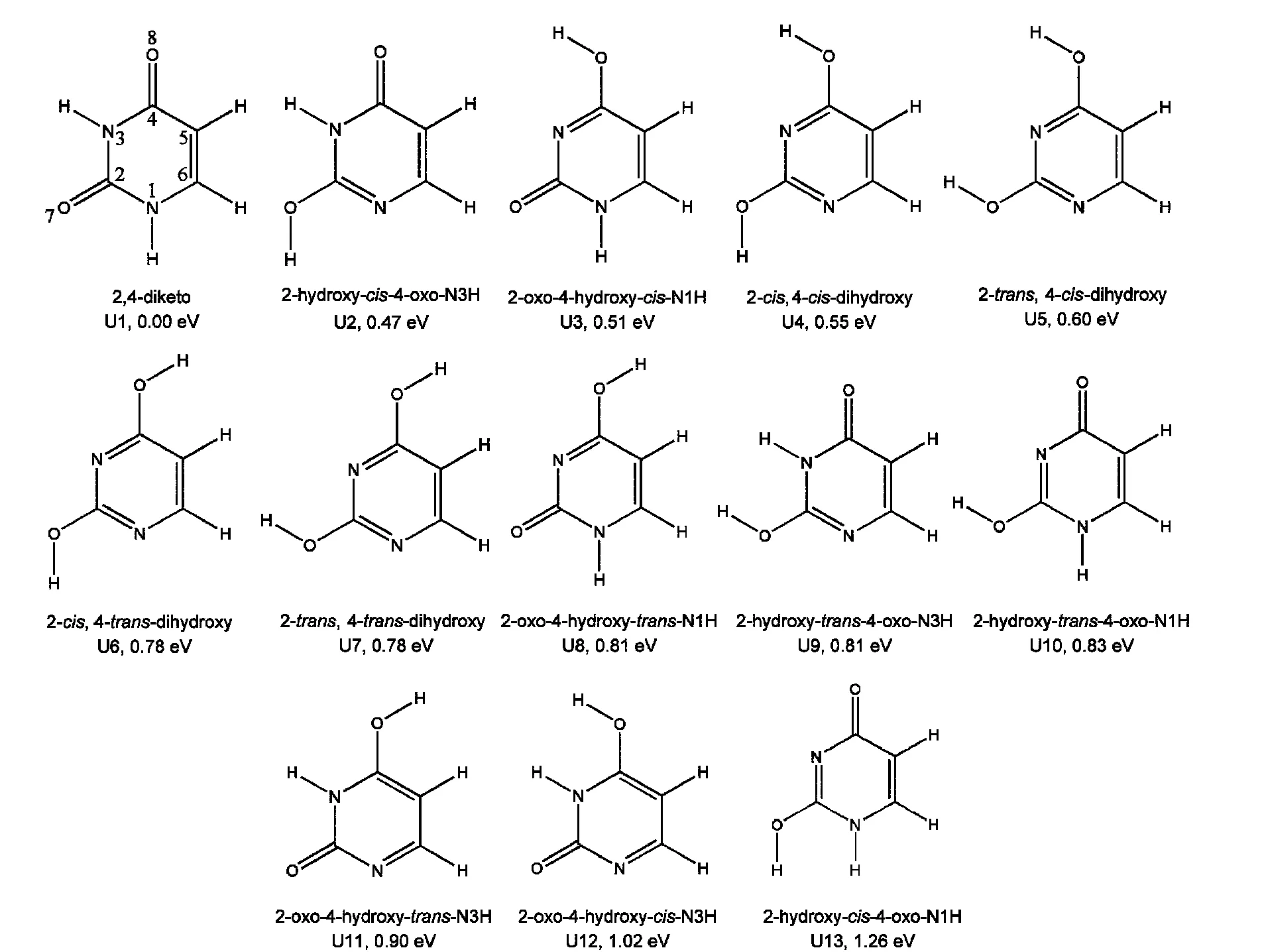
图1 尿嘧啶的互变异构体以及通过B3LYP/6-31++G(d,p)计算得到的相对能量Fig.1 All the tautomers of uracil and their relative energies calculated by B3LYP/6-31++G(d,p)
对于胞嘧啶的互变异构体,人们在实验方面做了大量的工作.早在20世纪六七十年代时,Ueda39和Dreyfus40等发现当胞嘧啶以固相存在时以及在水溶液中,氨基-羰基-N1H异构体(C1)都是其最主要的异构体.1978年,Yu等41通过胞嘧啶的光电子能谱实验证实在气相中C1异构体是最主要的异构体.1988年和1989年,Szczesniak42和Nowak43等通过胞嘧啶的基质隔离红外光谱实验证实,在220°C高温蒸发条件下,胞嘧啶氨基-羟基-顺式异构体(C2)和异构体C1同时存在,其中C2异构体以较高浓度存在,原因可能是在基质隔离样品中紫外光照射影响了互变异构体的相对浓度.同样在1989年,Brown等44利用特殊喷嘴对胞嘧啶进行喷射冷却后,研究了它的分子束微波光谱,结果发现胞嘧啶除了存在上述两个异构体外,还包括少量的亚氨-反式-羰基异构体(C4).胞嘧啶这三个异构体的相对稳定顺序是异构体C4<C2<C1.2002年,Nir等45报道了胞嘧啶的共振增强多光子电离(REMPI)光谱,发现胞嘧啶在激光脱附和喷射冷却条件下存在C1、C2或C3异构体.2005年,Tomic等46认为激光溅射条件下未能发现亚氨-羰基异构体的原因可能是因为样品由固体粉末压制得到,而固相中胞嘧啶仅以异构体C1存在.此外,激光溅射过程是一个高度非平衡过程.
理论方面,虽然目前有很多关于胞嘧啶的互变异构体的相对稳定性的计算,22,27,43,47−58但是之前的计算只考虑了部分的异构体.由于这些异构体能量差别非常小,采用不同的理论方法往往会得到不同的结果,22因此,这些异构体在气相中的稳定性顺序还存在争议.1988年,Kwiatkowski等58在MP2/3-21G优化基础上采用MP2/6-31G(d)计算了异构体C1、C2和C4的单点能.它们的稳定性顺序和Brown等44的实验结果一致.1996年,Colominas等48采用不同方法对前6个异构体在优化结构的基础上进行了单点能的计算,使用如下6种方法,A:HF/6-31G(d)//HF/6-31G(d);B:HF/6-311++G(d,p)//HF/6-31G(d);C:MP2/6-311++G(d,p)//HF/6-31G(d);D:MP4/6-311++G(d,p)//MP2/6-31G(d);E:B3LYP/6-31G(d)//MP2/6-31G(d);F:B3LYP/6-311++G(d,p)//MP2/6-31G(d),得到的结果不完全相同.前4个计算得到的最低能量异构体为C2,后两个得到的最优异构体为标准异构体C1.1997年,Fogarasi47利用MP2/DZP或MBPT(2)/DZP方法对胞嘧啶异构体的结构进行优化的基础上,采用HF、MP2和CCSD方法以及不同基组计算了胞嘧啶的5个最低异构体的单点能.其中在MBPT(2)/DZP方法优化结构的基础上应用CCSD/DZP方法计算这些异构体的单点能,得到它们的相对 稳定性顺 序为 C5<C1<C3<C4<C2.1998 年,Kobayashi53用CCSD/cc-pvtz(-f)计算了胞嘧啶的互变异构体的相对稳定性,发现稳定性顺序为C4<C5<C1<C3<C2.2000年,Sambrano等57利用MP2/6-31++G(d,p)方法计算了胞嘧啶的互变异构体的相对稳定性,发现C2异构体为最稳定结构,但是利用B3LYP/6-31++G(d,p)方法得到的结果显示C1异构体最为稳定.

图2 胸腺嘧啶的互变异构体以及通过B3LYP/6-31++G(d,p)计算得到的相对能量Fig.2 All the tautomers of thymine and their relative energies calculated by B3LYP/6-31++G(d,p)
我们同样利用B3LYP/6-31++G(d,p)方法对胞嘧啶所有14个异构体的几何结构和相对能量进行了计算,在计算过程中也考虑了零点能的校正,结果列于图3中.此结果与Sambrano等57的计算结果一致,最优结构也与实验得到的结果一致.
2.4 腺嘌呤
人们通过大量的实验认识到腺嘌呤的互变异构体随着实验条件不同而有所不同.1975年,Chenon等59在二甲基亚砜(DMSO)溶液中利用腺嘌呤13C核磁共振谱对其互变异构体进行了研究,结果显示腺嘌呤的氨基-N9H标准异构体(A1)是最为稳定的异构体,其含量约为85%.同年,Dreyfus等60利用温度跃变弛豫测量法(T-jump relaxation measurements)证实了在20°C水溶液中,A3异构体浓度为A1异构体的28%.1983年,Gonnella等61利用15N核磁共振谱发现A1和氨基-N7H(以下简称A3)异构体在水溶液中的含量分别约为80%和20%,而在DMSO溶液中A3异构体含量降到了13.5%.此外他们估算了这两个异构体能量差约为4.2 kJ·mol−1,这只有对腺嘌呤异构体进行高精度的量子化学计算才能区分.之后Nowak等62,63在腺嘌呤的N9或N7位上进行15N同位素取代,再测定其基质隔离红外光谱,发现A1标准异构体在低温基质中是含量最多的异构体.2001年,Laxer等64利用15N核磁共振谱发现腺嘌呤在DMSO溶液中除了以A1和A3异构体形式存在,还少量以氨基-N3H异构体(A2)形式存在.2002年,Plützer和Kleinermanns65利用共振双光子电离谱(R2PI)以及红外-紫外(IR-UV)光谱证实了通过加热蒸发方法得到的气相腺嘌呤中存在着A1和A3异构体.2003年,Cohen等66利用腺嘌呤水溶液中的超快瞬态吸收光谱研究发现在室温条件下腺嘌呤存在有A1和A3两种异构体,其中A3异构体的含量为22%±4%.同时在DMSO溶液中腺嘌呤13C-1H核磁共振自旋-自旋耦合常数的测定表明A3异构体在这两种异构体中所占比例为19%.直到2009年,Vogt等67才利用气相电子衍射实验测定了气相中A1标准异构体的精确结构.

图3 胞嘧啶的互变异构体以及通过B3LYP/6-31++G(d,p)计算得到的相对能量Fig.3 All the tautomers of cytosine and their relative energies calculated by B3LYP/6-31++G(d,p)
文献中有很多关于腺嘌呤异构体相对能量及其结构参数的计算,采用的理论计算方法包括HF/6-31G、68B3LYP/ccpVDZ、69BP86/QZ4P、70RI-MP2/TZVPP、71MP2/aug-ccpVDZ、72CASSCF(4/4)/6-31G、68CCSD/aug-cc-pVDZ72以及 MCSCF(12,10)/DZP73等.BP86/QZ4P、70MP2/6-311++G(d,p)、74RI-MP2/TZVPP71以及MCQDPT2/MCSCF1473等计算方法表明A1异构体为最低能量异构体,A3和A2异构体能量比A1异构体能量要高29.3−33.5 kJ·mol−1,两者之间存在一个高度为263.8 kJ·mol−1的能垒.1990年,Karplus和Wiorkiewicz-Kuczera75利用HF/4-21G对A1和A3异构体的结构进行了优化并模拟了它们的振动谱图,并通过与实际谱图对比,发现多晶腺嘌呤的红外光谱中仅有A1异构体的吸收峰,而在腺嘌呤的低温基质隔离红外光谱中存在A1和A3两种异构体的吸收峰.2004年,Hanus等71使用了RIMP2/TZVPP计算了不同腺嘌呤异构体的相对能量,并得到了A3异构体和A2异构体在DMSO溶液和水溶液中都可能存在的结论.2007年,Kim等76进一步研究了A1、A3和A2腺嘌呤异构体在水溶液中互变异构化的机理.2010年,Aidas等77利用DFT/MM方法模拟了腺嘌呤的15N和13C核磁共振谱,发现A1和A3异构体在溶液中的含量分别约为83%和17%.
我们利用B3LYP/6-31++G(d,p)方法对腺嘌呤所有14个异构体几何结构和相对能量进行了计算,在计算过程中也考虑了零点能的校正,结果列于图4中.此计算得到的最低能量结构为腺嘌呤A1异构体,其几何参数与腺嘌呤N9H异构体气相电子衍射实验测定的实验值67较为一致.
2.5 鸟嘌呤
与胞嘧啶等核酸碱基类似,鸟嘌呤互变异构体的相对稳定性受分子所处环境影响较大.到目前为止,国际上有很多关于鸟嘌呤互变异构体的实验研究.早在1980年,LeBreton和合作者78研究了气相中通过加热方法得到的鸟嘌呤及其甲烷取代物光电子能谱,发现在气相中羰基-N7H异构体(G1)是鸟嘌呤最稳定的异构体.Nir等79,80在1999年和2001年分别报道了通过分子束喷射冷却的鸟嘌呤的共振增强多光子电离(REMPI)光谱,紫外-紫外(UV-UV)和红外-紫外双共振谱(IR-UV double resonance spectroscopy),发现了羰基-N9H(G2)、羰基-N7H(G1)、烯醇-N9H(G3)3个异构体.2001年,Piuzzi等81通过鸟嘌呤异构体的紫外光谱实验,同样证实在激光脱附及分子束喷射冷却条件下存在着G1、G2和烯醇-N9H-反式(G4)三种鸟嘌呤异构体.在与Nir等人相似的研究中,Mons等82证实分子束喷射冷却条件下鸟嘌呤存在G1、G2、G3以及烯醇-N7H(G5)四种异构体.这两种研究的主要差别是在谱图中34755 cm−1峰开始仅被指认为G3异构体,但后来作者重新指认为G5和G3异构体.2006年,Choi和Miller83基于隔离在氦纳米液滴中的鸟嘌呤红外激光光谱实验,结合MP2方法以及6-311++G(d,p)和aug-cc-pVDZ基组,发现有G1、G2、G3和G4鸟嘌呤异构体存在.受Choi和Miller启发,Mons等84又对之前气相中得到的鸟嘌呤共振增强双光子电离(R2PI)光谱重新指认为 G1、G5、羰基-N7H-亚氨-顺式(G8)及其反式(G6)异构体.令人惊奇的是,尽管亚氨基异构体的能量远远高于标准异构体的能量,但还是被发现存在于激光脱附实验中,很可能是由于鸟嘌呤激发态中出现了互变异构体依赖的超快弛豫现象.2009年,Zhou等85通过真空紫外(VUV)光电离技术研究了鸟嘌呤的互变异构体.他们发现热蒸发和激光脱附两种技术制备得到的异构体有很大的不同,前一种制备方法得到了G1、G2、G3、G4和G5鸟嘌呤异构体,后一种制备方法得到了G6和G8鸟嘌呤异构体.在理论计算方面,有一些研究小组已经对鸟嘌呤互变异构体进行了研究.1990年,Sabio等86利用半经验AM1及Hartree-Fock方法和3-21G、STO-3G基组对鸟嘌呤的36个互变异构体进行了计算,结果显示G2是最主要的异构体.1994年,Hobza和Sponer50运用MP2/6-31G(d,p)等方法计算得到鸟嘌呤非平面型结构比平面型结构能量约低4.2 kJ·mol−1.1999年,Ha等54利用HF/6-31G(d,p)和MP2/6-31G(d,p)方法对鸟嘌呤的36个互变异构体进行了计算,结果显示G2和G3是两个最稳定的异构体.2005年,Gorb等87利用MP2和CCSD(T)方法及不同的基组对鸟嘌呤异构体进行计算,结果显示鸟嘌呤四个最低能量异构体G1、G2、G3和G4相对能量差在4.2 kJ·mol−1以内,第五个较低能量异构体比最低能量异构体能量高12.6 kJ·mol−1以上.2006年,Shukla和Leszczynski88利用HF、B3LYP、MP2方法和6-311G(d,p)、6-311++G(d,p)基组对鸟嘌呤的28个互变异构体进行了计算,结果显示G1是气相中最为稳定的异构体,G2比G1能量高约1.7 kJ·mol−1.同样在2006年,Liang等89利用密度泛函理论中的B3LYP/6-311+G(d,p)基组对鸟嘌呤的36个互变异构体的相对能量以及部分碱基异构体相互转化的116个过渡态进行了计算,结果与Shukla等88的较为接近,同样显示G1是气相中最为稳定的异构体,G2比G1能量高约1.7 kJ·mol−1.

图4 腺嘌呤的互变异构体以及通过B3LYP/6-31++G(d,p)计算得到的相对能量Fig.4 All the tautomers of adenine and their relative energies calculated by B3LYP/6-31++G(d,p)

图5 鸟嘌呤的互变异构体以及通过B3LYP/6-31++G(d,p)计算得到的相对能量Fig.5 All the tautomers of guanine and their relative energies calculated by B3LYP/6-31++G(d,p)
我们利用B3LYP/6-31++G(d,p)方法对鸟嘌呤所有36个异构体几何结构和相对能量进行了计算,在计算过程中也考虑了零点能的校正,结果列于图5中.结果表明G1异构体在气相中是最低能量结构,与上述实验结果一致.
3 电子亲和能
由于核酸碱基是极性分子,并且它们的偶极矩比较大,例如尿嘧啶(~1.5×10−29C·m),胸腺嘧啶(~1.5×10−29C·m),胞嘧啶(~2.3×10−29C·m),30因此电子结合到核酸碱基分子上形成的核酸碱基阴离子主要通过静电-偶极相互作用.它们脱附电子后对应的中性分子结构与阴离子相比几乎没有改变.因此实验测得的电子亲和能一般是偶极束缚(dipolebound)而非价电子束缚(valence-bound)的电子亲和能(EA).901996年,Desfrancois等91利用碱基与里德堡态的氙原子碰撞的实验方法测得尿嘧啶、胸腺嘧啶和腺嘌呤的EA值分别为(54±35)、(68±20)、(12±5)meV.同年,Bowen小组92测定了尿嘧啶和胸腺嘧啶的光电子能谱,得到它们的EA值分别为(93±7)、(69±7)meV.1998年,Schiedt等90测定了经过分子束喷射冷却的尿嘧啶、胸腺嘧啶以及胞嘧啶C1和C2异构体的光脱附-光电子能谱,结果显示它们的EA值分别为(86±8)、(62±8)、(230±8)、(85±8)meV.理论计算方面,Dolgounitcheva等93计算得到尿嘧啶负离子的绝热电子脱附能(ADE)和垂直脱附能(VDE)都为 57 meV.Wesolowski等94运用 B3LYP/TZ2P++方法对所有DNA及RNA碱基的电子亲和能进行了计算,得到U、T、C、A和G的绝热电子亲和能为分别0.19、0.16、−0.02、−0.17和0.07 eV.Li等95采用B3LYP密度泛函方法结合多种基组进行计算得到DNA及RNA碱基的电子亲和能顺序为U≈T>C>A>G.
上述理论和实验上的核酸碱基电子亲和能(EA)数据90−96总结于表1中.
4 电离能
核酸碱基的电离是DNA或RNA分子受到辐射损伤的初始过程,因此研究它们的电离能在生物方面有着重要的意义.97Hush和Cheung98很早就通过光电子能谱实验测得了核酸碱基的第一垂直电离能,之后Orlov等99通过气相中的光致电离质谱实验测得了核酸碱基的第一绝热电离能,他们的结果均显示腺嘌呤和鸟嘌呤是两个最容易被氧化的核酸碱基.Sevilla等100采用了MP2/6-31+G(d)//6-31G*方法得到的垂直电离能和绝热电离能与实验结果较为一致.Hutter和Clark101采用B3LYP/6-31G(d)方法对DNA碱基电离能进行了计算,它们计算的结果均比实验值低0.20−0.34 eV.Leão等102利用AM1半经验方法计算了胸腺嘧啶的6个异构体、胞嘧啶的6个异构体、腺嘌呤的8个异构体以及鸟嘌呤的15个异构体的电离能.他们的结果显示同一碱基互变异构体的电离能差别约在0.7 eV以内.

表1 DNA及RNA碱基的电子亲和能(EAs)Table 1 Electron affinities(EAs)of the DNAand RNA nucleobases
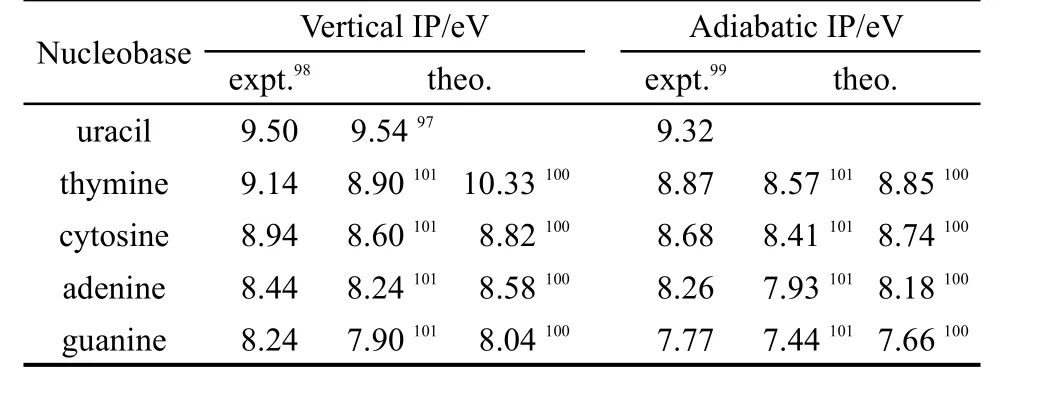
表2 DNA及RNA碱基的电离能(IPs)Table 2 Ionization potentials(IPs)of the DNAand RNA nucleobases
相关核酸碱基的电离能的实验值和理论值(文献97中采用P3//MBPT(2)/6-311G**方法,文献100中采用ROMP2/6-31+G(d)//ROHF/6-31G*方法,文献101中采用B3LYP/D95*//UHF/6-31G*方法)总结于表2中.
5 质子亲和能
核酸碱基的质子化反应在稳定DNA三螺旋结构、酶催化反应以及有机体诱导突变等过程中起着重要的作用,测定它们的质子亲和能可以为生物、化学等方面的研究提供重要的基础性信息.1979年,Meot-Ner103就在脉冲式高压质谱仪中利用气相中的质子转移动力学测定了胸腺嘧啶、胞嘧啶和腺嘌呤的质子亲和能.Lias104在1984年对DNA碱基的质子亲和能进行了较为全面的总结,该数据主要是通过测定气相条件下质子转移反应的平衡常数,然后再利用公式计算获得.Greco等105利用质量分离离子动能(MIKE)谱图重新测定了DNA碱基的质子亲和能,得到了鸟嘌呤质子亲和能的准确结果.理论计算方面,Colominas,48Podolyan,106Russo107以及Chandra108等分别采用MP4/6-311++G(d,p)//MP2/6-31G(d)、MP2/6-311++G(d,p)//MP2/6-31+G(d,p)、VWN/TZVP以及B3LYP/6-31+G(d,p)等方法计算得到了DNA碱基的质子亲和能,他们的结果均与实验值较为接近.相关的核酸碱基质子亲和能的实验值和理论值总结于表3中.
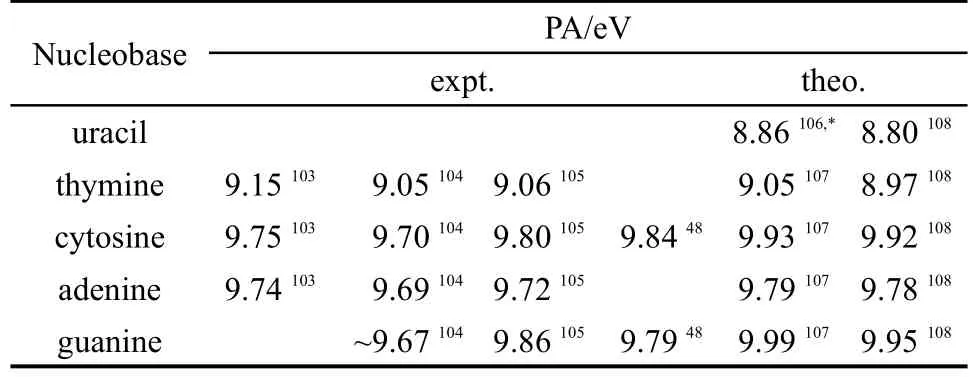
表3 DNA及RNA碱基的质子亲和能(PAs)Table 3 Proton affinities(PAs)of the DNAand RNA nucleobases
6 总结和展望
我们对有关核酸碱基互变异构体的实验和理论研究的进展进行了综述.理论研究表明尿嘧啶、胸腺嘧啶均有13个互变异构体,包括1个二羰基异构体,4个二羟基异构体、4个2-羟基-4-羰基异构体、4个2-羰基-4-羟基互变异构体,而实验研究中仅证实了2,4-二羰基、2-羟基-顺式-4-羰基-N3H以及2-羰基-4-羟基、顺式-N1H三种异构体形式存在.文献中只对胞嘧啶部分互变异构体进行了计算和总结,而实际上胞嘧啶共有14个互变异构体.实验研究已证实胞嘧啶存在着氨基-羰基-N1H(C1)、氨基-羟基-顺式(C2)和亚氨-反式-羰基(C4)三种异构体.腺嘌呤共有14个互变异构体,现有实验已证实存在着腺嘌呤N9H(A1)、氨基-N3H(A2)和氨基-N7H(A3)三种异构体.理论研究显示鸟嘌呤共有36个互变异构体,而实验上先后已证实鸟嘌呤存在着羰基-N7H(G1)、羰基-N9H(G2)、烯醇-N9H(G3)、烯醇-N9H-反式 (G4)、羰基-N7H-亚氨-顺式(G8)及其反式(G6)异构体.所有核酸碱基互变异构体的稳定性顺序在理论计算中会强烈依赖于所用的方法和基组,在实验中会随着所处环境的变化而不同.总的说来,无论是理论还是实验中,除了鸟嘌呤,其他核酸碱基最稳定的异构体均为其标准异构体.而对于鸟嘌呤,标准异构体(G2)和羰基-N7H异构体(G1)在能量上差别非常小,几乎是简并的.在对前人研究进行归纳总结的基础上,我们还利用密度泛函方法对核酸碱基所有可能的互变异构体进行了系统的理论计算,并根据它们的相对能量对所有可能的互变异构体进行了排序.同时,我们将计算结果与文献中已有的实验值进行了比较,计算结果与实验值比较一致,因此,我们计算所得到的核酸碱基的互变异构体的结构、相对能量的排序是可信的,可以为人们研究核酸碱基、DNA、RNA分子提供重要参考.我们还对文献中有关核酸碱基的电子亲和能、电离能、质子亲和能的研究进行了综述.
近年来有关核酸碱基互变异构体的研究主要集中于核酸碱基互变异构体与金属、109多聚氢化物110的相互作用以及它们的异构化、111,112质子化和去质子化、113激发态动力学114等方面.到目前为止引起核酸碱基异构化的原因以及利用不规则的DNA分子结构对纳米材料进行自组装的机理等方面还不是特别清楚.随着实验技术和理论计算方法的提高,有关核酸碱基的互变异构体及其所构成的DNA及RNA分子在生物医学、材料、化学等领域的应用可能会成为人们关注的热点.
(1) Blackburn,G.M.Nucleic Acids in Chemistry and Biology;Royal Society of Chemistry:Cambridge,2006;p 13.
(2) Wojnarowska,Z.;Paluch,M.;Wlodarczyk,P.;Dulski,M.;Wrzalik,R.;Roland,C.M.J.Phys.Chem.Lett.2012,3,2288.doi:10.1021/jz300541t
(3) Lee,H.;Popodi,E.;Tang,H.X.;Foster,P.L.Proc.Natl.Acad.Sci.U.S.A.2012,109,E2774.
(4) Lippert,B.;Gupta,D.Dalton Transactions 2009,4619.
(5) Ai,H.Q.;Chen,J.P.;Zhang,C.J.Phys.Chem.B 2012,116,13624.doi:10.1021/jp308937k
(6) Neidle,S.Principles of Nucleic Acid Structure;Elsevier:London,2008;p 1.
(7) van Mourik,T.;Danilov,V.I.;Dailidonis,V.V.;Kurita,N.;Wakabayashi,H.;Tsukamoto,T.Theor.Chem.Acc.2010,125,233.doi:10.1007/s00214-009-0630-0
(8) Beak,P.;White,J.M.J.Am.Chem.Soc.1982,104,7073.doi:10.1021/ja00389a032
(9) Ferenczy,G.;Harsányi,L.;Rozsondai,B.;Hargittai,I.J.Mol.Struct.1986,140,71.doi:10.1016/0022-2860(86)80148-X
(10) Fujii,M.;Tamura,T.;Mikami,N.;Ito,M.Chem.Phys.Lett.1986,126,583.doi:10.1016/S0009-2614(86)80178-6
(11) Tsuchiya,Y.;Tamura,T.;Fujii,M.;Ito,M.J.Phys.Chem.1988,92,1760.doi:10.1021/j100318a013
(12) Brown,R.D.;Godfrey,P.D.;McNaughton,D.;Pierlot,A.P.J.Am.Chem.Soc.1988,110,2329.doi:10.1021/ja00215a069
(13) Dougherty,D.;Wittel,K.;Meeks,J.;McGlynn,S.P.J.Am.Chem.Soc.1976,98,3815.doi:10.1021/ja00429a013
(14) Brady,B.B.;Peteanu,L.A.;Levy,D.H.Chem.Phys.Lett.1988,147,538.doi:10.1016/0009-2614(88)80264-1
(15) Kubota,M.;Kobayashi,T.J.Electron.Spectrosc.Relat.Phenom.1996,82,61.doi:10.1016/S0368-2048(96)03047-2
(16) Colarusso,P.;Zhang,K.;Guo,B.;Bernath,P.F.Chem.Phys.Lett.1997,269,39.doi:10.1016/S0009-2614(97)00245-5
(17) Szczesniak,M.;Nowak,M.J.;Rostkowska,H.;Szczepaniak,K.;Person,W.B.;Shugar,D.J.Am.Chem.Soc.1983,105,5969.doi:10.1021/ja00357a002
(18) Chin,S.;Scott,I.;Szczepani,K.;Person,W.B.J.Am.Chem.Soc.1984,106,3415.doi:10.1021/ja00324a006
(19) Basch,H.;Garmer,D.R.;Jasien,P.G.;Krauss,M.;Stevens,W.J.Chem.Phys.Lett.1989,163,514.doi:10.1016/0009-2614(89)85179-6
(20) Bodor,N.;Dewar,M.J.S.;Harget,A.J.J.Am.Chem.Soc.1970,92,2929.doi:10.1021/ja00713a001
(21) Czermiński,R.;Lesyng,B.;Pohorille,A.Int.J.Quantum Chem.1979,16,605.
(22) Scanlan,M.J.;Hillier,I.H.J.Am.Chem.Soc.1984,106,3737.doi:10.1021/ja00325a005
(23) Saunders,M.;Webb,G.;Tute,M.J.Mol.Struct.1987,158,69.doi:10.1016/0022-2860(87)80005-4
(24) Katritzky,A.R.;Karelson,M.J.Am.Chem.Soc.1991,113,1561.doi:10.1021/ja00005a017
(25) Leszczynski,J.J.Phys.Chem.1992,96,1649.doi:10.1021/j100183a029
(26) Boughton,J.W.;Pulay,P.Int.J.Quantum Chem.1993,47,49.
(27) Estrin,D.A.;Paglieri,L.;Corongiu,G.J.Phys.Chem.1994,98,5653.doi:10.1021/j100073a014
(28) Tian,S.X.;Zhang,C.F.;Zhang,Z.J.;Chen,X.J.;Xu,K.Z.Chem.Phys.1999,242,217.doi:10.1016/S0301-0104(99)00009-9
(29) Hobza,P.;Sponer,J.Chem.Rev.1999,99,3247.doi:10.1021/cr9800255
(30) Jasien,P.G.;Fitzgerald,G.J.Chem.Phys.1990,93,2554.doi:10.1063/1.458894
(31) Les,A.;Adamowicz,L.J.Phys.Chem.1990,94,7021.doi:10.1021/j100381a020
(32) Kryachko,E.S.;Nguyen,M.T.;Zeegers-Huyskens,T.J.Phys.Chem.A 2001,105,1288.doi:10.1021/jp001031j
(33) Kryachko,E.S.;Nguyen,M.T.;Zeegers-Huyskens,T.J.Phys.Chem.A 2001,105,1934.doi:10.1021/jp0019411
(34) Ozeki,K.;Sakabe,N.;Tanaka,J.Acta Crystallogr.,Sect.B:Struct.Sci.1969,25,1038.doi:10.1107/S0567740869003505
(35) Brown,R.D.;Godfrey,P.D.;McNaughton,D.;Pierlot,A.P.J.Chem.Soc.,Chem.Commun.1989,37.
(36) Morsy,M.;Al-Somali,A.;Suwaiyan,A.J.Phys.Chem.B 1999,103,11205.doi:10.1021/jp990858e
(37) Rejnek,J.;Hanus,M.;Kabelac,M.;Ryjacek,F.;Hobza,P.Phys.Chem.Chem.Phys.2005,7,2006.doi:10.1039/b501499a
(38) Ha,T.K.;Gunthard,H.H.J.Am.Chem.Soc.1993,115,11939.doi:10.1021/ja00078a036
(39) Ueda,T.;Fox,J.J.J.Am.Chem.Soc.1963,85,4024.doi:10.1021/ja00907a026
(40) Dreyfus,M.;Bensaude,O.;Dodin,G.;Dubois,J.E.J.Am.Chem.Soc.1976,98,6338.doi:10.1021/ja00436a045
(41) Yu,C.;Peng,S.;Akiyama,I.;Lin,J.;LeBreton,P.R.J.Am.Chem.Soc.1978,100,2303.doi:10.1021/ja00476a006
(42) Szczesniak,M.;Szczepaniak,K.;Kwiatkowski,J.;KuBulat,K.;Person,W.J.Am.Chem.Soc.1988,110,8319.doi:10.1021/ja00233a006
(43) Nowak,M.J.;Lapinski,L.;Fulara,J.Spectrochim.Acta,Part A:Mol.Spectrosc.1989,45,229.doi:10.1016/0584-8539(89)80129-1
(44) Brown,R.D.;Godfrey,P.D.;McNaughton,D.;Pierlot,A.P.J.Am.Chem.Soc.1989,111,2308.doi:10.1021/ja00188a058
(45) Nir,E.;Müller,M.;Grace,L.I.;de Vries,M.S.Chem.Phys.Lett.2002,355,59.doi:10.1016/S0009-2614(02)00180-X
(46) Tomic,K.;Tatchen,J.;Marian,C.M.J.Phys.Chem.A 2005,109,8410.doi:10.1021/jp051510o
(47) Fogarasi,G.J.Mol.Struct.1997,413,271.
(48) Colominas,C.;Luque,F.J.;Orozco,M.J.Am.Chem.Soc.1996,118,6811.doi:10.1021/ja954293l
(49) Kwiatkowski,J.S.;Leszczyński,J.J.Phys.Chem.1996,100,941.doi:10.1021/jp9514640
(50) Sponer,J.;Hobza,P.J.Phys.Chem.1994,98,3161.doi:10.1021/j100063a019
(51) Gould,I.R.;Burton,N.A.;Hall,R.J.;Hillier,I.H.J.Mol.Struct:Theochem 1995,331,147.doi:10.1016/0166-1280(94)03887-Q
(52) Les,A.;Adamowicz,L.;Bartlett,R.J.J.Phys.Chem.1989,93,4001.doi:10.1021/j100347a028
(53) Kobayashi,R.J.Phys.Chem.A 1998,102,10813.doi:10.1021/jp9829546
(54) Ha,T.K.;Keller,H.J.;Gunde,R.;Gunthard,H.H.J.Phys.Chem.A 1999,103,6612.doi:10.1021/jp984564p
(55) Fogarasi,G.J.Phys.Chem.A 2002,106,1381.doi:10.1021/jp013067x
(56) van Mourik,T.;Benoit,D.M.;Price,S.L.;Clary,D.C.Phys.Chem.Chem.Phys.2000,2,1281.doi:10.1039/a909183a
(57) Sambrano,J.R.;de Souza,A.R.;Queralt,J.J.;Andrés,J.Chem.Phys.Lett.2000,317,437.doi:10.1016/S0009-2614(99)01394-9
(58) Kwiatkowski,J.S.;Bartlett,R.J.;Person,W.B.J.Am.Chem.Soc.1988,110,2353.doi:10.1021/ja00216a001
(59) Chenon,M.T.;Pugmire,R.J.;Grant,D.M.;Panzica,R.P.;Townsend,L.B.J.Am.Chem.Soc.1975,97,4636.doi:10.1021/ja00849a028
(60) Dreyfus,M.;Dodin,G.;Bensaude,O.;Dubois,J.E.J.Am.Chem.Soc.1975,97,2369.doi:10.1021/ja00842a011
(61) Gonnella,N.C.;Nakanishi,H.;Holtwick,J.B.;Horowitz,D.S.;Kanamori,K.;Leonard,N.J.;Roberts,J.D.J.Am.Chem.Soc.1983,105,2050.doi:10.1021/ja00345a063
(62) Nowak,M.J.;Lapinski,L.;Kwiatkowski,J.S.;Leszczynski,J.J.Phys.Chem.1996,100,3527.doi:10.1021/jp9530008
(63) Nowak,M.J.;Rostkowska,H.;Lapinski,L.;Kwiatkowski,J.S.;Leszczynski,J.J.Phys.Chem.1994,98,2813.doi:10.1021/j100062a015
(64) Laxer,A.;Major,D.T.;Gottlieb,H.E.;Fischer,B.J.Org.Chem.2001,66,5463.doi:10.1021/jo010344n
(65) Plützer,C.;Kleinermanns,K.Phys.Chem.Chem.Phys.2002,4,4877.doi:10.1039/b204595h
(66) Cohen,B.;Hare,P.M.;Kohler,B.J.Am.Chem.Soc.2003,125,13594.doi:10.1021/ja035628z
(67) Vogt,N.;Dorofeeva,O.V.;Sipachev,V.A.;Rykov,A.N.J.Phys.Chem.A 2009,113,13816.doi:10.1021/jp905755u
(68) Broo,A.J.Phys.Chem.A 1998,102,526.doi:10.1021/jp9713625
(69) Mennucci,B.;Toniolo,A.;Tomasi,J.J.Phys.Chem.A 2001,105,4749.doi:10.1021/jp0045843
(70) Guerra,C.F.;Bickelhaupt,F.M.;Saha,S.;Wang,F.J.Phys.Chem.A 2006,110,4012.doi:10.1021/jp057275r
(71) Hanus,M.;Kabelac,M.;Rejnek,J.;Ryjacek,F.;Hobza,P.J.Phys.Chem.B 2004,108,2087.
(72) Roca-Sanjuán,D.;Merchán,M.;Serrano-Andrés,L.;Rubio,M.J.Chem.Phys.2008,129,095104.doi:10.1063/1.2958286
(73) Salter,L.M.;Chaban,G.M.J.Phys.Chem.A 2002,106,4251.doi:10.1021/jp014620d
(74) Choi,M.Y.;Dong,F.;Han,S.W.;Miller,R.E.J.Phys.Chem.A 2008,112,7185.doi:10.1021/jp8012688
(75)Wiorkiewicz-Kuczera,J.;Karplus,M.J.Am.Chem.Soc.1990,112,5324.doi:10.1021/ja00169a045
(76) Kim,H.S.;Ahn,D.S.;Chung,S.Y.;Kim,S.K.;Lee,S.J.Phys.Chem.A 2007,111,8007.doi:10.1021/jp074229d
(77)Aidas,K.;Mikkelsen,K.V.;Kongsted,J.Phys.Chem.Chem.Phys.2010,12,761.doi:10.1039/b915604f
(78) Lin,J.;Yu,C.;Peng,S.;Akiyama,I.;Li,K.;Lee,L.K.;LeBreton,P.R.J.Phys.Chem.1980,84,1006.doi:10.1021/j100446a015
(79) Nir,E.;Grace,L.;Brauer,B.;de Vries,M.S.J.Am.Chem.Soc.1999,121,4896.doi:10.1021/ja984088g
(80) Nir,E.;Janzen,C.;Imhof,P.;Kleinermanns,K.;de Vries,M.S.J.Chem.Phys.2001,115,4604.doi:10.1063/1.1391443
(81) Piuzzi,F.;Mons,M.;Dimicoli,I.;Tardivel,B.;Zhao,Q.Chem.Phys.2001,270,205.doi:10.1016/S0301-0104(01)00393-7
(82) Mons,M.;Dimicoli,I.;Piuzzi,F.;Tardivel,B.;Elhanine,M.J.Phys.Chem.A 2002,106,5088.doi:10.1021/jp0139742
(83) Choi,M.Y.;Miller,R.E.J.Am.Chem.Soc.2006,128,7320.doi:10.1021/ja060741l
(84) Mons,M.;Piuzzi,F.;Dimicoli,I.;Gorb,L.;Leszczynski,J.J.Phys.Chem.A 2006,110,10921.doi:10.1021/jp063738x
(85) Zhou,J.;Kostko,O.;Nicolas,C.;Tang,X.;Belau,L.;de Vries,M.S.;Ahmed,M.J.Phys.Chem.A 2009,113,4829.doi:10.1021/jp811107x
(86)Sabio,M.;Topiol,S.;Lumma,W.C.J.Phys.Chem.1990,94,1366.doi:10.1021/j100367a032
(87) Gorb,L.;Kaczmarek,A.;Gorb,A.;Sadlej,A.J.;Leszczynski,J.J.Phys.Chem.B 2005,109,13770.doi:10.1021/jp050394m
(88) Shukla,M.K.;Leszczynski,J.Chem.Phys.Lett.2006,429,261.doi:10.1016/j.cplett.2006.08.037
(89) Liang,W.;Li,H.R.;Hu,X.B.;Han,S.J.Chem.Phys.2006,328,93.doi:10.1016/j.chemphys.2006.06.025
(90) Schiedt,J.;Weinkauf,R.;Neumark,D.M.;Schlag,E.W.Chem.Phys.1998,239,511.doi:10.1016/S0301-0104(98)00361-9
(91) Desfrancois,C.;Abdoul Carime,H.;Schermann,J.J.Chem.Phys.1996,104,7792.doi:10.1063/1.471484
(92) Hendricks,J.;Lyapustina,S.;De Clercq,H.;Snodgrass,J.;Bowen,K.J.Chem.Phys.1996,104,7788.doi:10.1063/1.471482
(93) Dolgounitcheva,O.;Zakrzewski,V.G.;Ortiz,J.V.Chem.Phys.Lett.1999,307,220.doi:10.1016/S0009-2614(99)00492-3
(94) Wesolowski,S.S.;Leininger,M.L.;Pentchev,P.N.;Schaefer,H.F.J.Am.Chem.Soc.2001,123,4023.doi:10.1021/ja003814o
(95) Li,X.;Cai,Z.;Sevilla,M.D.J.Phys.Chem.A 2002,106,1596.doi:10.1021/jp013337b
(96) Desfrancois,C.;Periquet,V.;Bouteiller,Y.;Schermann,J.P.J.Phys.Chem.A 1998,102,1274.doi:10.1021/jp9728417
(97) Dolgounitcheva,O.;Zakrzewski,V.G.;Ortiz,J.V.J.Phys.Chem.A 2002,106,8411.doi:10.1021/jp020080o
(98) Hush,N.S.;Cheung,A.S.Chem.Phys.Lett.1975,34,11.doi:10.1016/0009-2614(75)80190-4
(99) Orlov,V.;Smirnov,A.;Varshavsky,Y.M.Tetrahedron Lett.1976,17,4377.doi:10.1016/0040-4039(76)80120-7
(100) Sevilla,M.D.;Besler,B.;Colson,A.O.J.Phys.Chem.1995,99,1060.doi:10.1021/j100003a032
(101) Hutter,M.;Clark,T.J.Am.Chem.Soc.1996,118,7574.doi:10.1021/ja953370+
(102) Leão,M.B.C.;Longo,R.L.;Pavão,A.C.J.Mol.Struct.-Theochem 1999,490,145.doi:10.1016/S0166-1280(99)00095-0
(103) Meot-Ner,M.J.Am.Chem.Soc.1979,101,2396.doi:10.1021/ja00503a027
(104) Lias,S.J.Phys.Chem.Ref.Data 1984,13,695.doi:10.1063/1.555719
(105) Greco,F.;Liguori,A.;Sindona,G.;Uccella,N.J.Am.Chem.Soc.1990,112,9092.doi:10.1021/ja00181a009
(106) Podolyan,Y.;Gorb,L.;Leszczynski,J.J.Phys.Chem.A 2000,104,7346.doi:10.1021/jp000740u
(107) Russo,N.;Toscano,M.;Grand,A.;Jolibois,F.J.Comput.Chem.1998,19,989.
(108) Chandra,A.K.;Nguyen,M.T.;Uchimaru,T.;Zeegers-Huyskens,T.J.Phys.Chem.A 1999,103,8853.doi:10.1021/jp990647+
(109) Cao,G.J.;Xu,H.G.;Li,R.Z.;Zheng,W.J.Chem.Phys.2012,136,014305.doi:10.1063/1.3671945
(110) Esteruelas,M.A.;Garcia-Raboso,J.;Olivan,M.Inorg.Chem.2012,51,9522.doi:10.1021/ic3013238
(111) Javan,M.J.;Tehrani,Z.A.;Fattahi,A.;Jamshidi,Z.Struct.Chem.2012,23,1843.doi:10.1007/s11224-012-9993-2
(112)Lin,Y.X.;Wang,H.Y.;Gao,S.M.;Wu,Y.X.;Li,R.H.Acta Phys.-Chim.Sin.2013,29,1233.[林月霞,王红艳,高思敏,吴颖曦,李汝虎.物理化学学报,2013,29,1233.]doi:10.3866/PKU.WHXB201304022
(113) Palamarchuk,G.V.;Shishkin,O.V.;Gorb,L.;Leszczynski,J.J.Phys.Chem.B 2013,117,2841.doi:10.1021/jp311363c
(114) Villabona-Monsalve,J.P.;Noria,R.;Matsika,S.;Peon,J.J.Am.Chem.Soc.2012,134,7820.doi:10.1021/ja300546x
