谷氨酸功能胶束温和催化水解甲基-β-D-纤维二糖苷
2013-07-25孟祥光于卫峰李小红
刘 莹 孟祥光 于卫峰 李小红 彭 肖
(四川大学化学学院,绿色化学与技术教育部重点实验室,成都 610064)
1 引言
纤维素是目前地球上最丰富的可再生资源,将其转化为化学品或生物燃料对解决目前人类所面临的能源枯竭、资源匮乏及环境污染等问题具有非常重要的意义.葡萄糖是一种能够生产生物燃料、化学品以及高分子的重要平台化合物,1,2例如葡萄糖的发酵可以产生乙醇、乳酸、3-羟基丙酸等重要的化合物.故而纤维素水解为糖类化合物被认为是生物质开发的一个关键瓶颈之一,3是当前纤维素开发利用的难题,发展有效的方法来水解纤维素得到葡萄糖是绿色化学领域最有吸引力和挑战性的工作之一.3-6目前对纤维素的水解研究主要集中在无机酸7和生物酶8,9的催化水解上.无机酸水解纤维素的效率高、温度低、副产物少,然而它也存在着难以克服的缺点:酸回收困难、设备腐蚀大、成本高、产物难分离和环境问题等.近年来一些研究小组对此加以改进,通过制备固体酸作催化剂,在水或离子液体中水解纤维素得到低聚糖和葡萄糖,10-13这样的催化体系能够克服无机酸催化的大多数缺点,然而也存在效率低、温度较高(>150°C)、副产物多以及酸基团流失等问题.6纤维素水解酶可以在温和条件下将纤维素选择性地水解为低聚糖,进而水解为葡萄糖.纤维素水解酶主要分为三类:外切酶(cellobiohydrolases)、内切酶(endoglucanases)和β-葡萄糖苷酶(β-glucosidases).14β-葡萄糖苷酶通过剪切低聚糖或纤维二糖的β-1,4-糖苷键来产生葡萄糖.它的催化机理被认为是“双羧酸”催化,酶的活性区域的两个谷氨酸残基是β-葡萄糖苷酶主要的催化基团.催化过程主要涉及糖酯化和酯水解两个步骤:15,16酶的谷氨酸残基上的一个羧酸作为质子供体,与底物糖苷键上的氧原子形成氢键,同时另一个谷氨酸残基上的羧酸阴离子作为亲核试剂来进攻糖苷键中的端基碳,形成一个酶-糖中间体,这个过程是糖苷键的剪切过程,被认为是酶催化水解反应的限速步骤;随后为中间体的水解过程,释放出葡萄糖和谷氨酸残基,从而完成一个催化循环.纤维二糖作为纤维素的结构单元,已成为研究糖苷键催化水解的常用底物,然而由于它的化学性质很稳定,对其催化水解的研究目前主要集中在β-葡萄糖苷酶的催化水解方面.17-20而β-葡萄糖苷酶的提取纯化困难、价格昂贵、容易失活.因此,设计和制备出具有酶的温和使用条件、选择性高、环境友好,又具有化学稳定性和高催化活性的β-葡萄糖苷模拟酶,研究其催化水解糖苷键的作用,对纤维素的降解以及天然酶的作用机理研究都具有重要的理论和实际意义.
功能性胶束作为一种新的自组装超分子体系既能模拟酶的活性中心又能模拟酶的疏水微环境而引起了化学家和生物学家的广泛关注.21-23胶束作为一个很好的超分子体系也被广泛应用于反应的催化24,25和新材料的合成26,27上.在以前的研究中,我们曾用胶束来模拟核酸水解酶,28,29发现胶束的功能基团和胶束的特殊微环境对催化水解起重要影响.据目前的报道,普遍认为Cel7A是一种常见的纤维素酶,在它的催化活性区域有两个重要的谷氨酸残基,它们在催化水解纤维素糖苷键的过程中对纤维素水解酶的“双酸作用”催化机理起了关键的作用.30-32基于此,本文设计合成了一种含有谷氨酸残基的长链烷基表面活性剂,首次研究了胶束体系对纤维素模型物甲基-β-D-纤维二糖苷的催化水解作用.考察不同氨基酸残基对甲基-β-D-纤维二糖苷催化水解的影响.通过研究一系列胶束体系对糖苷键的催化水解情况,借以考察温和条件(T<130°C,近中性)下催化体系的活性中心和胶束的微环境对糖苷键断裂的影响.
2 实验部分
2.1 试剂和仪器
纤维二糖(98%)从J&K Corp.购买;氯化钠(99.5%),硫酸(98%),3,5-二硝基水杨酸(98%),氢氧化钠(96%),酒石酸钾钠(99%),苯酚(98%),亚硫酸钠(99%),L-谷氨酸(98%),L-组氨酸(98.5%),葡萄糖(99%),果糖(99%),十二醛(99%),硼氢化钠(97%),硫酸铜(99%),无水硫酸钠(99%),氘代二甲基亚砜(99.8%),甲醇(99%),乙醇(99.7%),盐酸(37%),丙酮(99.5%)和乙酸乙酯(99.5%)均为市售分析纯试剂.
1H NMR通过Bruker 200型或400型核磁共振仪记录(瑞士Bruker公司);13C NMR通过Bruker 100型核磁共振仪记录(瑞士Bruker公司);MOD 1106元素分析仪(意大利Carlo Erba公司);UV-5300型紫外可见分光光度计(上海元析仪器有限公司);pHs-3C数字酸度计(上海虹益仪器厂);DDS-307电导仪(上海精密仪器有限公司);高效液相色谱(HPLC)(美国Waters公司,Waters 1525).
2.2 甲基-β-D-纤维二糖苷(MCB)的合成
甲基-β-D-纤维二糖苷(MCB)的合成参考文献33的方法.改进的合成步骤如下.
0.5 g纤维二糖加入到30 mL的甲醇溶液中,通入HCl气体直至饱和为止.将反应温度升高到110°C,回流1 h.当溶液中的固体刚好完全溶解时,取几滴反应液加入斐林试剂中,在沸水中加热1 min溶液不变红则说明纤维二糖已转化为甲基-β-D-纤维二糖苷.用30%的NaOH调节反应液的pH值至8-9,此时溶液变浑浊,有大量的白色固体析出,过滤,用甲醇洗涤固体三次,保留滤液.浓缩滤液,过硅胶柱分离产物.加入无水Na2SO4干燥溶液,过滤,真空旋干溶剂,得到白色固体,产率60%.1H NMR(400 MHz,DMSO(二甲基亚砜)-d6):δ5.16(d,1H),5.10(d,1H),4.94(d,1H),4.92(d,1H),4.63(br,1H),4.54(m,2H),4.26(d,1H),4.10(d,1H),3.76-3.67(2H),3.60(m,1H),3.41(m,1H),3.39(s,3H),3.31-3.21(3H),3.21-3.11(2H),3.05(m,1H),3.04-2.97(2H);13C NMR(100 MHz,DMSO-d6):δ103.5,103.1,80.3,76.7,76.3,74.9,74.6,73.2,73.0,70.1,61.0,60.5,56.0.
2.3 Nα-十二烷基-L-谷氨酸的制备
将谷氨酸(1.4713 g,10 mmol)加入到不断搅拌的甲醇(30 mL)溶液中,滴入数滴饱和的甲醇氯化氢溶液,使谷氨酸完全溶解.用NaOH固体(0.42 g)调节溶液的pH至8-9.然后滴加十二醛(3.11 mL,14 mmol)的乙醇溶液,滴加完毕后反应液在40°C下反应10 h后溶液冷却至0°C,分批加入NaBH4固体颗粒(0.49 g,13.0 mmol),在0°C下反应12 h,直到溶液淡红色褪去.将反应溶液过滤,减压蒸去溶剂,所剩固体用乙酸乙酯溶解,用饱和的NaCl溶液洗涤2-3次,减压蒸去乙酸乙酯.将所得固体用丙酮溶解,用37%的浓盐酸调节溶液的pH至谷氨酸的等电点.此时产物析出.用丙酮洗涤产物3-4次,收集产物,置于干燥器中干燥.产率为43%.1H NMR(200 MHz,D2O-NaOH,δ):0.69(t,J=7.2 Hz,3H,CH3),0.96-1.37(m,22H,11CH2),1.40-1.77(m,2H,*CHCH2),1.82-2.10(m,2H,COCH2),2.13-2.41(m,2H,NCH2),2.81(dd,J1=8.1 Hz,J2=5.6 Hz,1H,*CH).C17H33NO4元素分析计算值(%):C,64.73;H,10.54;N,4.44;实测值(%):C,64.72;H,10.56;N,4.42.
2.4 MCB的水解
室温下,将含有一定量催化剂的溶液调到所需的pH值,氮气保护下将温度升高到90°C,此时溶液的pH会有较小的变化,用硫酸/氢氧化钠调节溶液的pH到所需要的值.加入底物MCB开始反应.10 h后,将反应液从反应器中取出,冷却至室温.用4 mol·L-1的NaOH溶液将反应液的pH调至13,常温放置10 h后测定葡萄糖的含量.在反应过程中,反应液的pH用硫酸/氢氧化钠来调节,保持反应液的pH值基本不变.
胶束与氨基酸复配体系的配制:在胶束溶液中加入一定量的氨基酸稳定一定时间,得到胶束的复配体系.
2.5 分析方法
3,5-二硝基水杨酸比色法(DNS法)是定量分析还原糖含量的常用方法.34,35本文中,我们把纤维二糖制成没有还原性的MCB,从而可以方便地用DNS法来测定产物葡萄糖.
反应溶液中生成的葡萄糖含量用DNS法或高效液相色谱(HPLC)法测定.所有的实验数据均扣除MCB在相同条件下自发水解所产生的葡萄糖含量.每次实验均重复三次,实验数据为平行三次实验数据的平均值,其标准偏差均小于5%.
3 结果与讨论
3.1 Nα-十二烷基-L-谷氨酸(L)的临界胶束浓度的测定
表面活性剂Nα-十二烷基-L-谷氨酸(L)的临界胶束浓度用电导法测定.图1所示为溶液电导率(κ)与表面活性剂浓度(cL)的关系图.从图中可看出κ-cL直线有两个转折点,对应的浓度分别为2.07×10-5和1.71×10-4mol·L-1,即Nα-十二烷基-L-谷氨酸的两个临界胶束浓度(cmc)分别为2.07×10-5和1.71×10-4mol·L-1,这可能是由于Nα-十二烷基-L-谷氨酸在水溶液中随着浓度的不同而存在两种不同的胶束形态所致.
3.2 MCB水解的紫外-可见(UV-Vis)分光光度分析方法
纤维二糖是构成纤维素的基本结构单元,研究糖苷键的水解断裂对纤维素的选择性水解研究意义重大.然而由于纤维二糖及其水解产物葡萄糖都有还原性,并且两者对还原糖的常用检测方法——DNS法表现出不同的性质,36致使用DNS法检测反应进程时会产生很大误差,因此通常需要用带有示差折光检测器的HPLC法来定量检测反应的进行情况.而HPLC操作麻烦,检测不便利,且灵敏度不高.如果能找到一种用紫外分光光度法即可测量反应进度的分析方法,则操作将十分便利,简单易行.基于以上考虑,本文首次提出了一种新的检测纤维二糖水解的方便的分析方法:将纤维二糖的醛基部位用甲氧基来替代,即把纤维二糖制成甲基-β-D-纤维二糖苷,这种物质由于没有还原性,可以方便使用常规DNS法来测定反应生成还原糖的量.同时,甲基-β-D-纤维二糖苷作为纤维素很好的模型物也常被用作研究纤维素催化水解的底物.33,37

图1 35 °C及pH 5.0时Nα-十二烷基-L-谷氨酸(L)水溶液的电导率-浓度关系图Fig.1 Plot of electrical conductivity vs concentration for Nα-dodecyl-L-glutamic acid(L)at 35 °C and pH 5.0
纤维素酶的活性部位大都含有谷氨酸、精氨酸、赖氨酸和组氨酸等残基,38这些氨基酸残基在催化纤维素降解的过程中对纤维素起到了重要的结合、传递质子、诱导变形等多种作用和效应.39,40为了考察氨基酸对糖苷键水解断裂的影响,本文选取了谷氨酸和组氨酸两种氨基酸,通过它们与合成的功能表面活性剂L的复配构成新的催化体系,并研究这些胶束体系的催化活性.同时为了检验本文建立的DNS法的可靠性,我们将多个催化体系的实验数据也同时用HPLC法进行了对比检测,典型的HPLC图谱如图2所示,其还原糖的分析结果列于表1中.从图2可以看到,反应的主要产物为葡萄糖,以及少量的果糖,还有一种保留时间在17.53 min的未知产物.从表1中的数据我们可以看到两种方法在误差允许范围内较为一致,本文建立的分析方法是可信的.

图2 胶束催化MCB水解10 h后的高效液相谱图Fig.2 High performance liquid chromatography(HPLC)spectrum of solution of micelle-catalyzed MCB hydrolysis after 10 h

表1 DNS法所得还原糖产率和高效液相法所得葡萄糖产率及果糖产率的比较aTable 1 Comparison between the yield of reducing sugar detected by DNS method and the yield of glucose,the yield of fructose obtained by HPLC methoda
从表1中可以看出,谷氨酸或组氨酸对MCB水解的催化活性较小,胶束L对MCB的催化水解活性比两种氨基酸大了近一倍.这主要是因为胶束体系不仅含有羧基、氨基等功能基团可以参与反应,同时它对有机底物具有增溶作用,更重要的是胶束还提供了特殊的类似于天然酶的微环境,这种微环境的极性、粘度、介电常数等性质与水溶液有很大不同,可以促进反应的进行.41,42胶束和氨基酸的复配体系(L+Glu和L+His)对MCB水解的催化活性要比单独的胶束体系好,这主要是因为Glu或His的加入增加了体系内质子给予体和亲核试剂的数量,有利于水解反应的进行.L+Glu体系要比L+His体系的催化活性好,说明谷氨酸中的羧酸基团比组氨酸中的咪唑基团在反应中更有利于质子与糖苷键上的氧结合,从而催化活性更大.
3.3 胶束催化MCB水解的动力学
图3显示了表面活性剂L在5×10-5-2×10-3mol·L-1浓度范围内MCB水解反应的表观一级速率常数(kobsd)的变化情况.在实验条件下,初始反应时间段内,反应对反应物MCB浓度是表观一级的.从图中可以看出在pH 5.0的条件下,表观一级速率常数随着表面活性剂浓度的增大而增大.
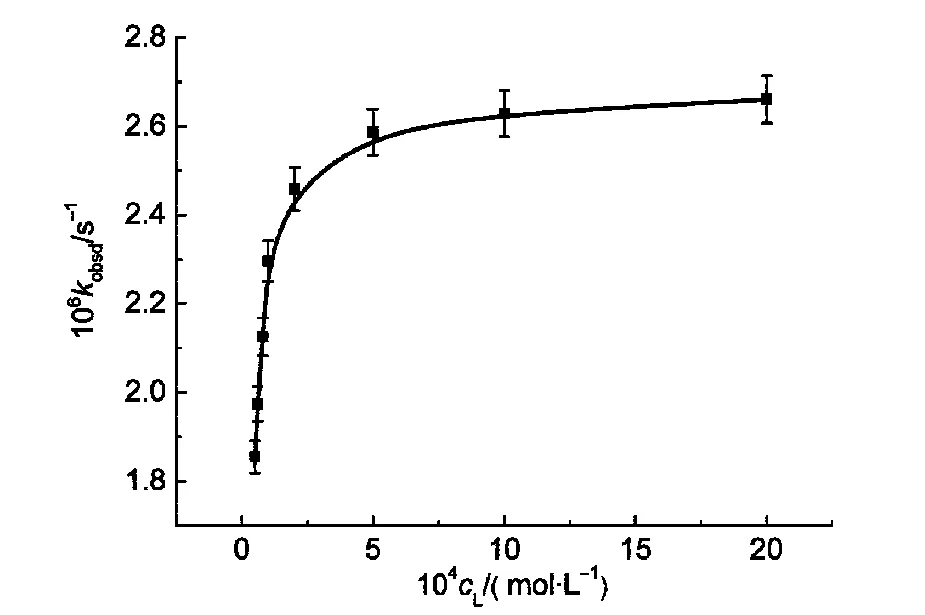
图3 表面活性剂浓度对MCB水解表观一级速率常数(kobsd)的影响Fig.3 Effects of the concentration of surfactant on the apparent first-order rate constants(kobsd)of MCB hydrolysis
根据胶束催化的相分离模型可知,43水解反应能同时在胶束假相和水溶液本体相中进行,如示意图1所示,胶束(M)与底物(S)首先结合而形成复合物MS,然后复合物再反应生成产物P.同时底物S在本体相中也自发水解生成产物P.方程(1)为胶束催化的动力学方程式.44,45

其中,kw和km分别表示底物在水溶液和胶束相中的一级反应速率常数,Ks为底物与胶束的结合常数,N为胶束聚集数,cD为表面活性剂总浓度,cmc为临界胶束浓度.
由方程(1)可知,以 1/(kobsd-kw)对1/(cD-cmc)作图应该得到一直线,km和N/Ks的值可由直线的截距和斜率得到.其中,cmc为表面活性剂L的第一个临界胶束浓度(2.07×10-5mol·L-1).如图4所示,直线的线性关系很好(相关系数0.99),km和N/Ks的值分别为2.65×10-6s-1和1.31×10-5mol·L-1.一般情况下,胶束的聚集数N在30-100之间,则Ks估算为2.29×106-7.62×106L·mol-1.与纯水溶液条件相比,km较大(km/kw=1.77×104),说明此胶束体系确实能明显促进MCB水解的进行.结合常数Ks值较大则说明了MCB可以较好地增溶到胶束中并能与之很好地结合,从而加速了自身的水解反应.

示意图1 胶束催化的动力学模型Scheme 1 Kinetic model of micellar catalysis

图 4 1/(kobsd-kw)对1/(cD-cmc)作图Fig.4 plots of 1/(kobsd-kw)vs 1/(cD-cmc)
3.4 pH对胶束催化MCB水解的影响
溶液pH值对水解反应有很大影响,通过考察pH对反应的影响可以分析研究水解过程中催化活性物种的变化及其催化反应的机理.由此我们研究了pH=2.0-11.0范围内功能胶束L催化MCB水解的反应,得到了pH对产物葡萄糖生成的影响情况,如图5所示.从图5中可以看到葡萄糖产率随着pH的增大呈现先增大后减小的趋势,在pH=5.0时,葡萄糖的产率最大,为9.02%.这样的实验现象与大多数纤维素酶的最佳催化活性在pH 4.0-6.5的pH效应十分类似.实验测得胶束中谷氨酸残基上两个羧酸的电离情况与谷氨酸小分子在水溶液中的电离略有不同,其两个羧酸的电离常数pKa1和pKa2分别为2.46和5.35.当pH=5.0时,胶束中谷氨酸残基上的两个羧酸一个处于解离的状态,另一个处于未解离的状态,这与天然酶的“双酸作用”催化机理类似,可以认为处于未解离状态的羧酸上的氢原子容易与糖苷键上的氧原子形成氢键,同时已电离出氢质子的羧酸根进攻糖苷键附近的碳原子,从而催化了糖苷键的断裂.

图5 pH对胶束L催化MCB生成的葡萄糖产率的影响Fig.5 Effects of pH on yield of glucose for MCB hydrolysis catalyzed by micelle L
3.5 氨基酸对胶束催化MCB水解的影响
为了研究小分子氨基酸的加入对胶束L催化MCB水解的影响,我们考察了不同浓度的组氨酸和谷氨酸对葡萄糖产率的影响,如图6所示.从图6可以看出组氨酸和谷氨酸的浓度均在2×10-3mol·L-1时,即cL:cHis(或cGlu)=1:1时还原糖产率最大,分别为11.8%和13.9%.这说明小分子氨基酸与胶束的协同作用对MCB水解反应有明显的影响,只有在特定的官能团比例下,体系中各基团才能达到良好的协同效果.从图6可以发现,在胶束中加入谷氨酸比组氨酸对反应更有利,这与单独的谷氨酸和组氨酸对反应的影响刚好相反(表1),这显示了胶束微环境的特殊效果,也说明羧酸基团对糖苷键的水解断裂所起的作用强于咪唑基团,与许多文献46-49报到的纤维素酶的作用主要是“双羧酸催化机理”相符合.
3.6 反应动力学和活化能的计算
由于纤维素水解的活化能很大,因此温度对纤维素中糖苷键的断裂有很大的影响.在以前的文献报道中,除了酸催化外,纤维素的水解通常很慢,必须在较高的温度下(一般大于150°C)水解反应才较为明显,但高温水解往往也会同时生成大量复杂的副产物.50,51在本文的工作中,我们力求水解反应在较低温(≤130°C)下进行,这样水解产物相对单一,基本上为葡萄糖.需要说明的是,与天然纤维素水解酶作用机理类似,本文的MCB催化水解反应也被发现是一个连续反应的过程:首先MCB糖苷键断裂并被水解为氨基酸葡萄糖酯和甲基葡萄糖苷,随后氨基酸葡萄糖酯再水解为葡萄糖和氨基酸(图S1和S2,见补充材料).然而所不同的是,我们的催化体系在弱酸性条件(pH 5.0)下对第一步糖苷键的断裂效果较好,而对第二步酯水解过程效果不明显,需要在碱性条件下来进行氨基酸葡萄糖酯的水解.另外,正如前文指出的,我们也发现产物除了有葡萄糖外,还有少量的未知产物(HPLC上保留时间在17.53 min位置),根据对照,它不是脱水葡萄糖,5-羟甲基糠醛,乙酰丙酮,乙酰丙酸,甲酸,乙酸,糠醛,甲基葡萄糖苷等物质,其产物还需要进一步分析.

图6 氨基酸浓度对葡萄糖产率的影响Fig.6 Effects of the concentration of amino acids on yield of glucose
图7(a)显示了L+Glu体系在90-130°C温度下催化MCB水解在0-50 h内的葡萄糖产率的变化情况.从图7(a)中可以看出,随着反应时间的增加,葡萄糖的产率呈现先增加后减小的趋势,葡萄糖产率的极大值出现在20 h附近.在不同的温度(90、100、110、120和130°C)下,葡萄糖产率的极大值分别为15.0%、19.5%、26.1%、35.1%和44.3%.在不同的温度下,葡萄糖产率随时间的变化也不相同,当温度高于100°C时,反应温度越高,葡萄糖产率先高后低的趋势越明显,这主要是因为在较高温度下,葡萄糖又会较缓慢地降解为甲酸、乙酸、乙酰丙酸等物质.

图7 L+Glu在不同温度下催化MCB水解的葡萄糖产率随时间的变化图(a)和不同温度下-ln(1-ct/c0)对反应时间t作图(b)Fig.7 Plots of yield of glucose vs reaction time for MCB hydrolysis catalyzed by L+Glu at the different temperatures(a)and plots of-ln(1-ct/c0)vs reaction time at the different temperatures(b)
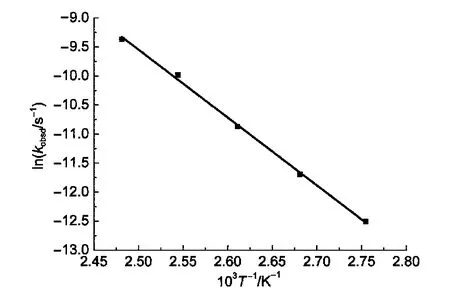
图8 L+Glu催化MCB水解的表观一级速率常数(kobsd)的对数与温度(T)的关系图Fig.8 Plot of the logarithm of apparent first rate constant(kobsd)vs temperature(T)for the hydrolysis of MCB catalyzed by L+Glu
为了避免这种现象的干扰,我们采用初始反应阶段的数据来测算葡萄糖的反应速率常数.图7(b)所示为初始时间段内,-ln(1-ct/c0)vs t的关系图,其中c0是反应物MCB的初始浓度,ct是葡萄糖在t时刻的浓度.可以看到,-ln(1-ct/c0)vs t作图均呈现出良好的直线关系,其相关系数都大于0.99,说明在实验条件下,初始反应时间段内,反应对反应物MCB浓度是表观一级的.由图7(b)的直线斜率可计算得到在90、100、110、120和130 °C温度下L+Glu催化MCB水解的表观一级速率常数kobsd分别为3.70×10-6、8.33×10-6、1.90×10-5、4.64×10-5和8.51×10-5s-1.
根据反应动力学理论中的Arrhenius公式,以lnkobsd对1/T作图应得到一条直线,利用直线的斜率和截距则可求出反应活化能Ea和指前因子A的值.如图8所示,直线的相关系数大于0.98,说明此催化反应在此温度范围内较好地符合Arrhenius公式,这样计算出葡萄糖生成的活化能为97.18 kJ·mol-1,指前因子为3.51×108.文献52,53报道纤维素水解生成葡萄糖的活化能一般在110-180 kJ·mol-1之间,由此看出胶束催化体系能够大幅度地降低MCB水解的活化能,在较低温下能较容易地催化MCB水解生成葡萄糖.
4 结论
本文提出了一种新的检测纤维二糖水解的方便的分析方法.制备了一种长链谷氨酸表面活性剂,并研究了它所形成的胶束体系对MCB水解的催化作用.研究结果表明,胶束L能够有效地催化MCB的水解,其“钟形”pH效应说明此功能胶束体系有着类似天然纤维素水解酶“双酸作用”的催化机理.小分子氨基酸Glu和His的添加能够更好地促进胶束对MCB的催化水解.温度对此水解反应的速率和副产物生成有重要影响.计算了葡萄糖生成的初始反应速率常数,并计算得到反应活化能为97.18 kJ·mol-1,表明该催化体系在较低温下能较容易地催化MCB水解生成葡萄糖.本文的研究对理解纤维素降解酶的作用机理以及对木质纤维素生物质的开发利用提供了基础研究信息.
(1)Dhepe,P.L.;Fukuoka,A.ChemSusChem2008,1(12),969.doi:10.1002/cssc.v1:12
(2) Bozell,J.J.;Petersen,G.R.Green Chem.2010,12(4),539.doi:10.1039/b922014c
(3) Igarashi,K.;Uchihashi,T.;Koivula,A.;Wada,M.;Kimura,S.;Okamoto,T.;Penttilä,M.;Ando,T.;Samejima,M.Science2011,333(6047),1279.doi:10.1126/science.1208386
(4) Lynd,L.R.;Laser,M.S.;Bransby,D.;Dale,B.E.;Davison,B.;Hamilton,R.;Himmel,M.;Keller,M.;McMillan,J.D.;Sheehan,J.;Wyman,C.E.Nat.Biotechnol.2008,26(2),169.doi:10.1038/nbt0208-169
(5) Wolfenden,R.;Yuan,Y.J.Am.Chem.Soc.2008,130(24),7548.doi:10.1021/ja802206s
(6) Komanoya,T.;Kobayashi,H.;Hara,K.;Chun,W.J.;Fukuoka,A.Appl.Catal.A-Gen.2011,407(1-2),188.
(7)Harmer,M.A.;Fan,A.;Liauw,A.;Kumar,R.K.Chem.Commun.2009,No.43,6610.
(8) Nie,H.R.;Liu,M.Z.;Chen,Z.B.Acta Phys.-Chim.Sin.2004,20(4),386.[聂华荣,柳明珠,陈振斌.物理化学学报,2004,20(4),386.]doi:10.3866/PKU.WHXB20040411
(9) Wilson,D.B.Curr.Opin.Biotech.2009,20(3),295.doi:10.1016/j.copbio.2009.05.007
(10) Rinaldi,R.;Palkovits,R.;Schuth,F.Angew.Chem.Int.Edit.2008,47(42),8047.doi:10.1002/anie.v47:42
(11) Kitano,M.;Yamaguchi,D.;Suganuma,S.;Nakajima,K.;Kato,H.;Hayashi,S.;Hara,M.Langmuir2009,25(9),5068.doi:10.1021/la8040506
(12)Wang,H.Y.;Zhang,C.B.;He,H.;Wang,L.Acta Phys.-Chim.Sin.2010,26(7),1873.[王华瑜,张长斌,贺 泓,王 莲.物理化学学报,2010,26(7),1873.]doi:10.3866/PKU.WHXB20100721
(13) Long,J.X.;Guo,B.;Li,X.H.;Wang,F.R.;Wang,L.F.Acta Phys.-Chim.Sin.2011,27(5),995.[龙金星,郭 斌,李雪辉,王芙蓉,王乐夫.物理化学学报,2011,27(5),995.]doi:10.3866/PKU.WHXB20110506
(14) Singhania,R.R.;Patel,A.K.;Sukumaran,R.K.;Larroche,C.;Pandey,A.Bioresource Technol.2013,127,500.doi:10.1016/j.biortech.2012.09.012
(15) Koshland,D.E.J.;Stein,S.S.J.Biol.Chem.1954,208(1),139.(16) Wang,J.H.;Hou,Q.Q.;Dong,L.H.;Liu,Y.J.;Liu,C.B.J.Mol.Graph.Model.2011,30,148.doi:10.1016/j.jmgm.2011.06.012
(17) Verma,M.L.;Chaudhary,R.;Tsuzuki,T.;Barrow,C.J.;Puri,M.Bioresource Technol.2013,135,2.doi:10.1016/j.biortech.2013.01.047
(18) Figueira,J.A.;Sato,H.H.;Fernandes,P.J.Agric.Food Chem.2013,61(3),626.doi:10.1021/jf304594s
(19) Muñoz-Gutiérrez,I.;Oropeza,R.;Gosset,G.;Martinez,A.J.Ind.Microbiol.Biot.2012,39(8),1141.
(20) Liu,L.F.;Zeng,Z.T.;Zeng,G.M.;Chen,M.;Zhang,Y.;Zhang,J.C.;Fang,X.;Jiang,M.;Lu,L.H.Bioorg.Med.Chem.Lett.2012,22(2),837.doi:10.1016/j.bmcl.2011.12.053
(21) Jiang,F.B.;Jiang,B.Y.;Cao,Y.S.;Meng,X.G.;Yu,X.Q.;Zeng,X.C.Colloids Surf.A2005,254(1-3),91.
(22) Bhattacharya,S.;Kumari,N.Coord.Chem.Rev.2009,253(17-18),2133.doi:10.1016/j.ccr.2009.01.016
(23) Desbouis,D.;Troitsky,I.P.;Belousoff,M.J.;Spiccia,L.;Graham,B.Coord.Chem.Rev.2012,256(11-12),897.
(24) Boudou,M.;Ogawa,C.;Kobayashi,S.Adv.Synth.Catal.2006,348(18),2585.
(25) Ye,Y.;Ding,Q.P.;Wu,J.Tetrahedron2008,64(7),1378.doi:10.1016/j.tet.2007.11.055
(26) Mo,Z.L.;Sun,Y.X.;Chen,H.;Wang,K.J.;Liu,Y.Z.;Li,H.J.Acta Chim.Sin.2005,63(14),1365. [莫尊理,孙银霞,陈 红,王坤杰,刘艳芝,李贺军.化学学报,2005,63(14),1365.]
(27) Sasidharan,M.;Gunawardhana,N.;Luitel,H.N.;Yokoi,T.;Inoue,M.;Yusa,S.;Watari,T.;Yoshio,M.;Tatsumi,T.;Nakashima,K.J.Colloid Interface Sci.2012,370(1),51.doi:10.1016/j.jcis.2011.12.050
(28) Jiang,F.B.;Huang,L.Y.;Meng,X.G.;Du,J.;Yu,X.Q.;Zhao,Y.F.;Zeng,X.C.J.Colloid Interface Sci.2006,303(1),236.doi:10.1016/j.jcis.2006.07.050
(29) Kou,D.;Meng,X.G.;Liu,Y.;Du,J.;Kou,X.M.;Zeng,X.C.Colloids Surf.A2008,324(1-3),189.
(30) Li,J.H.;Du,L.K.;Wang,L.S.J.Phys.Chem.B2010,114(46),15261.doi:10.1021/jp1064177
(31) Barr,B.K.;Wolfgang,D.E.;Piens,K.;Claeyssens,M.;Wilson,D.B.Biochemistry1998,37(26),9220.doi:10.1021/bi980063i
(32) Zechel,D.L.;Withers,S.G.Accounts Chem.Res.2000,33(1),11.doi:10.1021/ar970172
(33) Meiland,M.;Heinze,T.;Guenther,W.;Liebert,T.Carbohyd.Res.2010,345(2),257.doi:10.1016/j.carres.2009.11.007
(34) Cheng,M.X.;Shi,T.;Guan,H.Y.;Wang,S.T.;Wang,X.H.;Jiang,Z.J.Appl.Catal.B:Environ.2011,107(1-2),104.
(35) Zhang,Y.;Xu,J.L.;Qi,W.;Yuan,Z.H.;Zhuang,X.S.;Liu,Y.;He,M.C.Appl.Biochem.Biotechnol.2012,168(1),144.doi:10.1007/s12010-011-9362-4
(36) Saqib,A.A.N.;Whitney,P.J.Biomass Bioenerg.2011,35(11),4748.doi:10.1016/j.biombioe.2011.09.013
(37) Ruiz,M.D.C.R.;Querner,J.;Adorjan,I.;Kosma,P.;Rosenau,T.Macromol.Symp.2005,232(1),68.
(38) Petersen,S.H.;Vanzyl,W.H.;Pretorius,I.S.Biotechnol.Tech.1998,12(8),615.doi:10.1023/A:1008829129516
(39) Violot,S.;Aghajari,N.;Czjzek,M.;Feller,G.;Sonan,G.K.;Gouet,P.;Gerday,C.;Haser,R.;Receveur-Bréchot,V.J.Mol.Biol.2005,348(5),1211.doi:10.1016/j.jmb.2005.03.026
(40) Liu,J.L.;Wang,X.M.;Xu.D.G.J.Phys.Chem.B2010,114(3),1462.doi:10.1021/jp909177e
(41) Meng,X.G.;Guo,Y.;Hu,C.W.;Zeng,X.C.J.Inorg.Biochem.2004,98(12),2107.doi:10.1016/j.jinorgbio.2004.09.019
(42) Dwars,T.;Paetzold,E.;Oehme,G.Angew.Chem.Int.Edit.2005,44(44),7174.
(43) Menger,F.M.;Portnoy,C.E.J.Am.Chem.Soc.1967,89(18),4698.doi:10.1021/ja00994a023
(44)Zeng,X.C.;Meng,X.G.;Wang,Q.;Zhang,Y.Q.;Qin,Z.M.J.Disper.Sci.Technol.1997,18(4),369.doi:10.1080/01932699708943741
(45) Zeng,X.C.;Wang,Q.;Meng,X.G.;Zhang,Y.Q.;Qin,Z.M.J.Disper.Sci.Technol.1998,19(5),591.doi:10.1080/01932699808913201
(46) Knowles,J.K.C.;Lentovaara,P.;Murray,M.;Sinnott,M.L.J.Chem.Soc.,Chem.Commun.1988,No.21,1401.doi:10.1039/C39880001401
(47) Claeyssens,M.;Tomme,P.;Brewer,C.F.;Hehre,E.J.FEBS Lett.1990,263(1),89.
(48) Barr,B.K.;Wolfgang,D.E.;Piens,K.;Claeyssens,M.;Wilson,D.B.Biochemistry1998,37(26),9220.doi:10.1021/bi980063i(49) Zechel,D.L.;Withers,S.G.Accounts Chem.Res.2000,33(1),11.doi:10.1021/ar970172+
(50) Matson,T.D.;Barta,K.;Iretskii,A.V.;Ford,P.C.J.Am.Chem.Soc.2011,133(35),14090.doi:10.1021/ja205436c
(51) Potvin,J.;Sorlien,E.;Hegner,J.;DeBoef,B.;Lucht,B.L.Tetrahedron Lett.2011,52(44),5891.
(52) Liang,X.;Montoya,A.;Haynes,B.S.J.Phys.Chem.B2011,115(36),10682.doi:10.1021/jp204199h
(53) Sasaki,M.;Adschiri,T.;Arai,K.AIChE J.2004,50(1),192.
