GMPase基因对烟草开花的调控研究
2013-09-12彭彩娥
沈 毅,赵 根,李 莉,彭彩娥
(1.浙江大学农业与生物技术学院,浙江杭州 310058;2.湖州市农业科学研究院,浙江湖州 313000;3.浙江大学湖州市南太湖现代农业科技推广中心,浙江湖州 313000)
烟草 (Nicotiana tabacum)是茄科烟草属一年生草本自花授粉植物,天然杂交率仅1%~3%,一般在花冠裂开前已完成授粉。利用基因调控和转基因研究基因调控烟草开花的问题,不仅可缩短烟草开花时间,对烟草行业的发展也具有重要意义。
GMPase是调控烟草中抗坏血酸 (AsA)的重要基因,其过量表达和抑制表达对烟草叶片中氧化型和还原型AsA具有较大影响,从而影响到烟草的花期。AsA又称Vc,是含有内脂结构的多元醇类,其特点是具有可解离出H+的烯醇式羟基,因而其水溶液有较强的酸性。AsA在动植物体中具有重要的抗氧化功能和代谢功能,人体无法自身合成,新鲜蔬菜水果是人体摄入的重要来源[1]。
AsA普遍存在于植物体组织中,是一种高丰度小分子抗氧化物质,可直接与超氧自由基(·)、过氧化氢(H2O2)和羟自由基(·OH)等发生活性氧反应,从而达到植物体抗氧化,在抗氧化胁迫中具有重要作用[2-5]。AsA除了参与植物抗氧化外,还具有其他许多特殊的功能:参与植物细胞壁的合成、伸长和交联;调节基因的转录翻译;调节细胞氧化还原平衡,是一种重要的氧化还原缓冲剂;作为一些酶的辅酶,调节酶的活性;调节细胞的分裂和伸长。AsA的这些重要生理功能是与其氧化还原状态以及生物合成、代谢、再生和转运的相关酶类活性的变化密切相关的[2,6-7]。
AsA通过参与植物细胞内的相关氧化还原反应,从而达到植物细胞的抗氧化作用。AsA在细胞内主要由抗坏血酸氧化酶 (ascorbate oxidase,AAO)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)催化。APX以AsA为电子供体,将H2O2还原为H2O,同时将AsA氧化为单脱氢抗坏血酸MDHA;MDHA以细胞色素b为电子供体,在MDHA还原酶 (MDHAR)的作用下还原为AsA,也可进一步生成脱氢抗坏血酸 DHA。而DHA在DHA还原酶的催化下,利用胱光甘肽为电子供体,通过抗坏血酸-谷胱甘肽循环还原成AsA,并最终使 H2O2得以清除[3-4,8],氧化型谷胱甘肽在谷胱甘肽还原酶的催化下,用NADPH为电子供体得以还原。细胞壁内的AsA通过质膜运载体,以易化扩散方式与DHA交换而来,并在AO的作用下被氧化为MDHA,这样产生的MDHA可能被质膜Cyt b系统还原;而细胞质内的AsA氧化所产生的MDHA有两种途径:进入胞质内的抗坏血酸-谷胱甘肽循环,或者以NADH为电子供体被定位于质膜内侧的MDHAR催化还原为AsA[9]。
本试验是建立在陈坤明等[5]对植物AsA的合成等研究的基础上,先将野生烟草经转基因得到试验用转基因烟草,再将野生烟草和转基因烟草同时播种生长,在相同环境下,测量其生长指标,并在特定阶段,测定其叶片中过氧化物酶 (POD)和丙二醛 (MDA)含量,来研究GMPase基因对烟草开花的影响。
1 材料与方法
以野生烟草为对照,以转基因T1-05和T1-15烟草为试验烟草。播种培养后,测其株高、茎粗、叶面积、叶表面情况等生长指标。将野生型烟草和T1-05,T1-15转基因型烟草经4℃低温和40℃高温处理后,测定其POD含量的变化,及4℃低温对MDA含量的影响。
2 结果与分析
2.1 生长
3种试材播种后,置于人工气候试验室内培养,每种烟草取16棵,每隔1周测量其生长指标1次,共5周,再取平均数 (表1)。数据显示,野生烟草在株高上比转基因T1-05,T1-15烟草矮得多,而野生烟草几乎没有茎,叶片直接从底部生长,无法测量其茎粗,而在叶面积上明显比转基因T1-05,T1-15烟草大很多,叶表面野生无毛和褶皱。而T1-05和T1-15转基因烟草在株高、茎粗和叶面积上差异不大,叶表面随之开始有毛和褶皱。T1-05和T1-15转基因烟草的节间显著长于CK烟草,且叶片较薄而小,并出现早衰的现象。
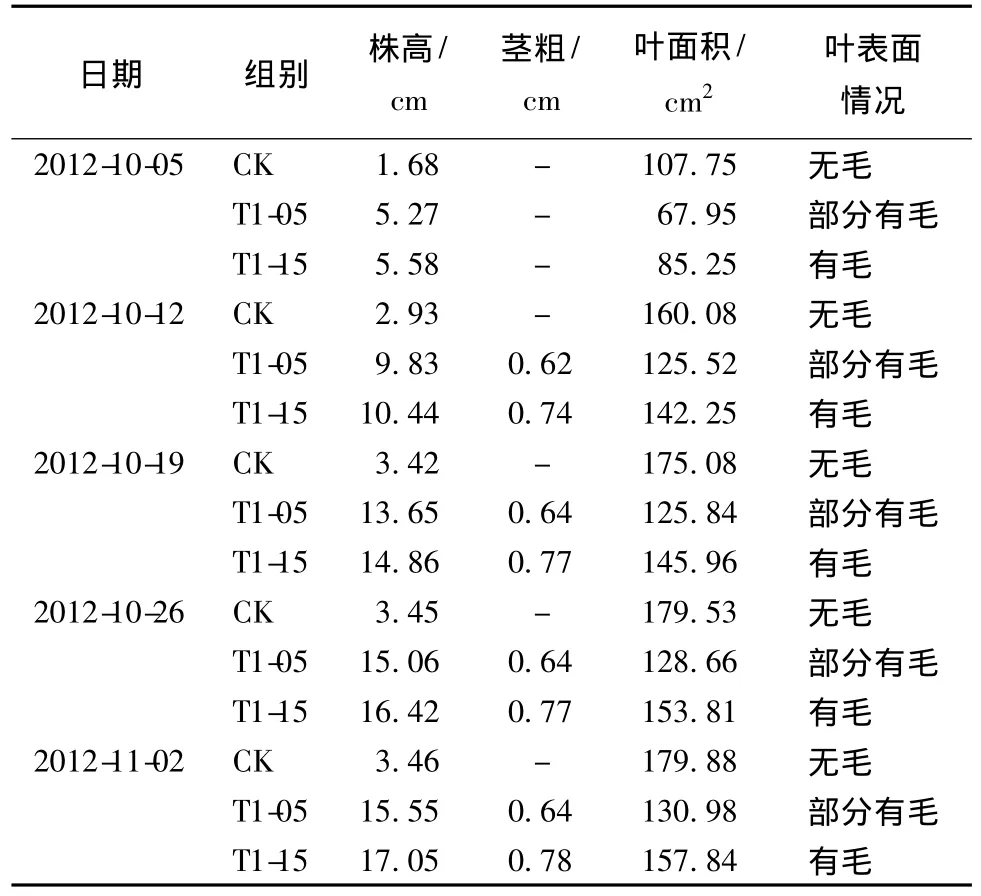
表1 野生烟草和转基因烟草的表型差异
2.2 POD含量
以POD为代表的抗氧化酶系统和以AsA为代表的抗氧化剂组成的抗氧化系统对植物体内活性氧(ROS)水平起着精密的调控作用,从而将活性氧控制在细胞可忍耐的水平。
野生型和T1-05,T1-15转基因型烟草材料经低温和高温处理后其POD含量发生明显变化 (图1-2)。
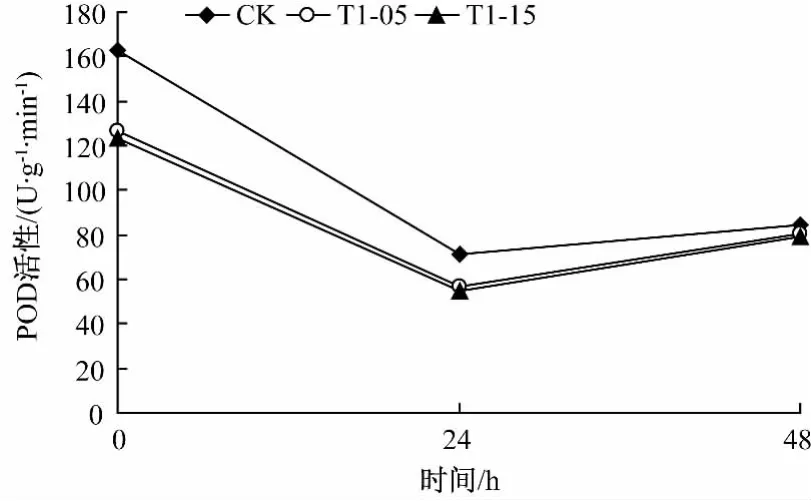
图1 低温处理对烟草POD含量的影响
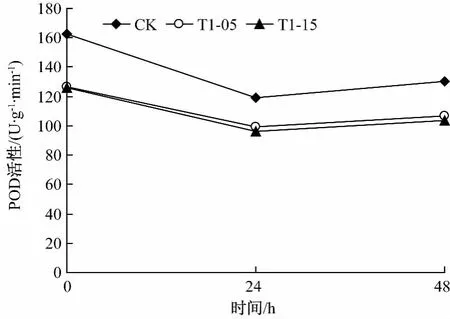
图2 高温处理对烟草POD含量的影响
由图1可知,随着低温处理,野生型烟草的POD含量迅速下降,24 h后基本平稳;而T1-05和T1-15烟草的POD含量开始表现为下降,24 h后呈上升趋势。说明野生型烟草在0,24 h低温处理的抗逆性优于T1-05和T1-15转基因型烟草,但T1-05和T1-15在24 h后抗逆性开始反弹。
由图2可知,高温处理破坏了酶活性,处理时间越长,破坏程度越高,POD含量越低。但总体而言,野生型烟草的POD含量比T1-05和T1-15转基因的高,说明总体上野生型烟草抗高温优于T1-05和T1-15转基因型烟草。
2.3 MDA含量
植物体在不利的生长环境下受到伤害或者衰老,都与活性氧积累诱发的膜脂过氧化作用密切相关。产物中的MDA是膜脂过氧化最重要的产物之一,可通过对其含量的测定来显示植物膜脂过氧化的程度,间接测定膜系统受损情况及抗逆性。
野生型和T1-05,T1-15转基因型烟草经4℃低温处理后,其MDA含量发生明显变化 (图3)。

图3 低温处理对烟草MDA含量的影响
由图3可知,处理24 h后,3种烟草抗逆性相当;12和48 h时,T1-05和T1-15转基因烟草抗逆性优于野生型烟草;36 h时,野生烟草抗逆性高于T1-05和T1-15。结果表明,随着低温处理时间的延长,膜系统受损一定程度后,就不再受破坏;野生型烟草的恢复能力和抗逆性优于T1-05和T1-15转基因烟草。
3 小结与讨论
GMPase基因是植物合成AsA的首个关键酶基因,催化产物GDP-甘露糖可用于合成植物细胞壁的碳水化合物,在肽链合成的同时或合成后,还可用于糖链被接到肽链上特定的糖基化位点 (蛋白糖基化)。GMPase基因能提高体内AsA含量,可增强植物体的抗胁迫能力[10]。
与野生型烟草相比,转基因烟草叶片AsA含量降低了30%~40%,表现出与野生烟草不同的表型。转基因烟草植株在组培过程中就开始开花,在7~8片叶时全部开花,而野生烟草生长至25~28片叶时才开始开花,转基因烟草开花时间比野生烟草提前近1个月。在7~8片叶时,转基因烟草的节间显著长于野生烟草,叶片薄且小,并出现早衰现象。
GMPase基因的抑制表达明显降低了转基因烟草的自身抗氧化能力,在4℃低温和40℃高温胁迫下,T1-05和 T1-15转基因烟草叶片的 SOD、APX活性显著低于野生烟草,而其叶片的MDA和H2O2含量大大超过野生烟草。上述结果证明了GMPase基因在植物体合成AsA过程中起关键作用,虽然GMPase不是清除活性氧的抗氧化酶,但GMPase基因的表达却与植物的抗氧化能力密切相关[10]。
通过对烟草的植株生理性状、POD含量、MDA含量的测定表明,野生烟草在抗逆性方面优于转基因烟草,GMPase基因能有效地控制AsA的合成,从而实现对烟草花期的有效调控。
[1]Radzio J A,Lorence A,Chevone B I,et al.L-gulono-1,4-lactone oxidase expression rescues vitamin C-deficientArabidopsis(vtc)mutants [J].Plant Mol Biol,2003,53(6):837-844.
[2]Smirnoff N.The function andmetabolism of ascorbic acid in plants[J].Ann Bot,1996,78:661-669.
[3]Noctor G,Foyer C H.Ascorbate and glutathione:Keeping active oxygen under control[J].Annu Rev Plant Physiol Plant Mol Biol,1998,49:249 -279.
[4]Davey M W,Montagu M V,Inze D,et al.Plant L-ascorbic acid:chemistry,function,metabolism,bioavailability and effects of processing[J].J Sci Food Agric,2000,80:825-860.
[5]陈坤明,宫海军,王锁民.植物抗坏血酸的生物合成、转运及其生物学功能[J].西北植物学报,2004,24(2):329-336.
[6]Rautenkranz A A F,Li L,Machler F,et al.Transport of ascorbic and dehydroascorbic acids across protoplast and vacuole membranes isolated from Barley(Hordeum vulgareL.cv Gerbel)leaves[J].Plant Physiol,1994,106:187 -193.
[7]Vanacker H,Carver T L W,Foyer C H.Pathogen-induced changes in the antioxidant status of the apoplast in barley leaves[J].Plant Physiol,1998,117:1103 -1114.
[8]Conklin P L,Saracco S A,Norris S R,et al.Identification of ascorbic acid-deficientArabidopsis thalianamutants [J].Genetics,2000,154:847-856.
[9]Horemans N,Asard H,Caubergs R J.Carrier mediated uptake of dehydroascorbate into higher plant plasma membrane vesicles shows trans-stimulation [J].FEBES Lett,1998,421:41-44.
[10]王华森.番茄叶片GDP-甘露糖焦磷酸化酶基因 (GMPase)的cDNA克隆及功能分析 [D].泰安:山东农业大学,2007.
