鲜食玉米遗传多样性及核心种质构建
2013-09-12王美兴姚坚强张莲英朱金庆
王美兴,姚坚强,张莲英,朱金庆
(浙江省农业科学院作物与核技术利用研究所,浙江杭州 310021)
人类对植物遗传资源的认识及考察、收集、利用、创造等有关研究经过了漫长的历史过程。数量巨大的资源给保存、评价、鉴定及利用带来了困难。核心种质的提出为上述问题提供了有效解决方案。
1984年澳大利亚的 Frankel[1]提出核心种质(core collection)的概念,它是用一定的方法选择整个种质资源的一部分,以最小的资源数量和遗传重复最大程度地代表整个遗传资源的多样性。
玉米被引种到中国只有近500年的历史[2],一方面遗传基础相对狭窄依然是制约我国玉米育种的瓶颈;另一方面我国育种家通过收集地方种,二环系,诱导突变,杂交回交,引进国外优良种质资源等多种方式收集创造了数量巨大的遗传材料。因此构建玉米核心种质,更高效、深入地利用玉米种质资源尤为重要,以粮用饲用为主的中国玉米地方种核心种质已经构建起来[3]。鲜食玉米的核心种质构建报道较少。作者以浙江省农业科学院鲜食玉米资源的初级核心种质为对象,对鲜食玉米遗传多样性,遗传结构及核心种质的构建进行了研究。
1 材料与方法
1.1 材料
研究材料为348份玉米初级核心种质,该核心种质是通过对3 560份玉米种质资源利用6个农艺性状聚类取样获得的,初级核心种质对总资源的代表性达到95%。初级核心种质从类型上可分为糯玉米 (96份),甜玉米 (156份),甜糯玉米 (63份)和普通玉米 (36份)4种类型,其中普通玉米及糯玉米中的14份材料为地方种,其他材料均为二环系自交系。
1.2 SSR等位变异检测
DNA提取采用CTAB法[4],从小量冷冻叶片提取DNA。SSR引物序列来自 http://www.maizegdb.org/ssr.php,所用30个SSR引物平均分布于10条染色体上。PCR反应体系为:Taq酶0.9 U,10 ×缓冲液1.5 μL。MgCl222.5 mmol·L-1。SSR 引物46 ng,dNTP 1.8 mmol·L-1,总体积为15 μL。PCR反应步骤为:95℃预变性5 min;95℃变性30 s,退火 (视引物而定)1 min,72℃延伸90 s,30个循环;72℃延伸10 min。扩增产物在8%聚丙烯酰胺凝胶上电泳分离,染色方法为银染法[5]。
1.3 数据分析
用等位变异数、基因多样性指数和多态性信息指数来描述鲜食玉米遗传多样性,上述参数的计算是用POWERMARKER 3.25[6]和遗传结构分析用软件 STRUCTURE[7]完成。
2 结果与分析
2.1 玉米初级核心种质遗传多样性
在初级核心种质348份材料中,利用30个SSR标记位点,共检测到183个等位变异,等位变异数变化范围为3~9个,平均每个位点有6.1个等位变异;基因多样性指数最高达到0.84。平均基因多样性指数为0.65,SSR位点的平均多态性指数为0.61(表1)。

表1 玉米初级核心种质在各SSR位点的遗传多样性
不同类型的玉米之间遗传多样性有一定的差异(表2,图1)。等位变异数量最多的是甜玉米,最少的是普通玉米;基因多样性最高的是糯玉米,最低的是普通玉米。SSR位点的多态性与基因多样性的高低在各类玉米资源中的大小分布是一致的。普通玉米全部为地方种,其等位变异数和基因多样性指数都最低。
从4种玉米类型之间的遗传关系来看,糯玉米、普通玉米与另外3种类型遗传差异较大。虽甜玉米与甜糯玉米有较近的遗传关系,但两者之间的
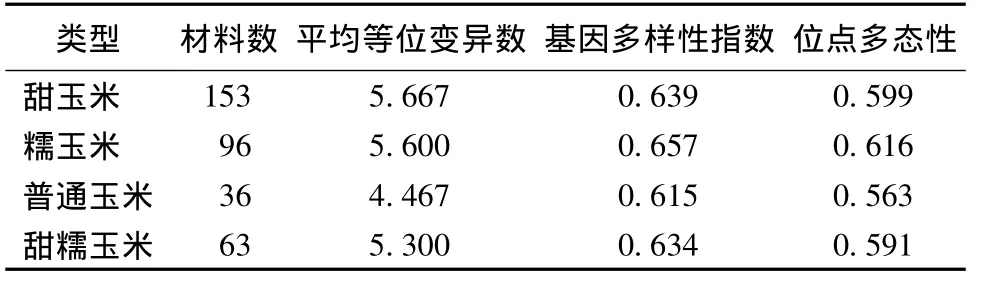
表2 不同类型玉米群体的遗传多样性

图1 4种玉米类型群体之间的遗传关系
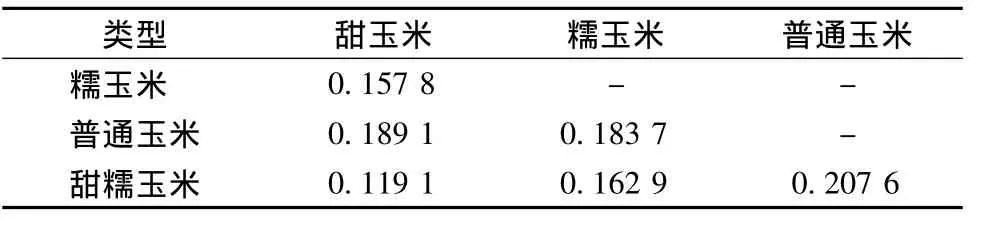
表3 3种玉米类型群体之间的遗传距离
2.2 玉米初级核心种质遗传结构
为了考察玉米的传统分类和利用分子标记所获得的遗传结构是否一致,本研究以348份玉米初级核心种质材料个体为单位进行了聚类分析,结果(图2)显示,甜玉米、糯玉米、普通玉米和甜糯玉米都没有单独聚为一类。4种类型的材料在以分子标记数据聚类所形成的群体中几乎是随机分布的,表明传统的玉米分类方式不能确切、真实地代表其遗传结构。因此在构建核心种质时,以传统分类为依据进行分群不能保证核心种质的代表性。图2显示初级核心种质材料在不同的遗传距离尺度下可以分成若干群体,但是以哪种遗传距离尺度进行遗传结构的划分较为合理尚不能确定,为了解决这个问题,本研究利用遗传结构分析软件STRUCTURE对玉米初级核心种质进行了遗传结构的预测。
图3显示的是当给定不同的分群数量,即K值时,由STRUCTURE获得的△K值与K值之间的变化关系,当K=4时,△K具有稳定值,并且随着K值的继续增大,逐渐变得不稳定。因此玉米初级核心种质最佳分成4个遗传群体。
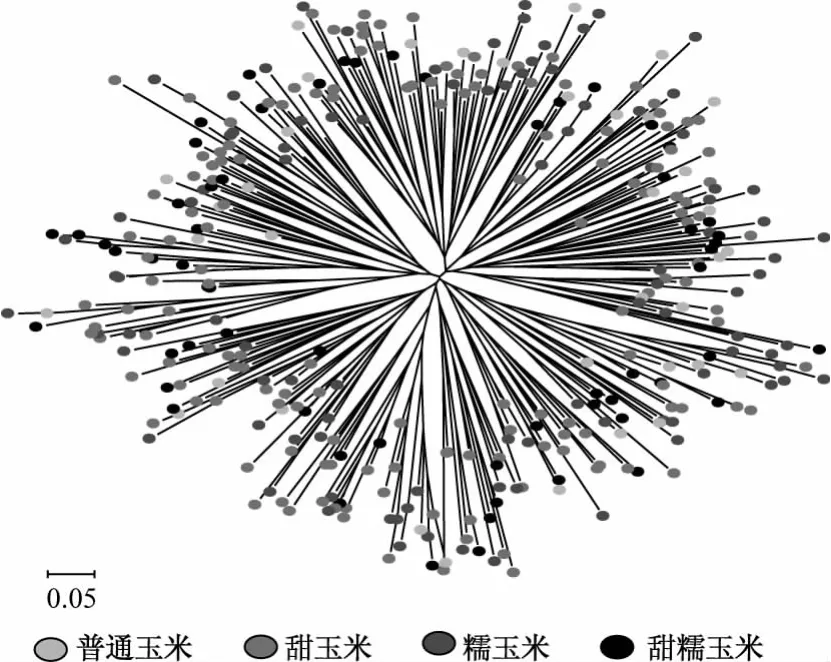
图2 玉米初级核心种质个体材料聚类图

图3 玉米初级核心种质遗传结构最佳分群数量
根据分子标记所获得的4个遗传群体 (表4)与玉米的传统分类方式的确有较大的差异,甜玉米,糯玉米,普通玉米及甜糯玉米的个体材料在结构群体中是随机分布的。4个遗传结构群体材料数量差异不大,其中遗传多样性最高的是群体4,最低的是群体3。

表4 玉米初级核心种质遗传结构群体的遗传多样性
2.3 核心种质取样方法的确定
为了确定核心种质最佳取样方法,本研究对比研究了随机取样与聚类取样过程中等位变异、基因多样性的捕获效率、保留比例的变化规律,以及等位变异保留比例,基因多样性和核心种质取样规模的关系。
在随机取样时,随着取样比例的增加,取样群体捕获到的等位变异数量持续增加,而基因多样性指数则是先迅速增大,达到最大值以后,随着材料数的增加,基因多样性表现为无序振荡 (表5)。图4和5更直观地给出了等位变异数和基因多样性随着取样群体规模变化的规律。当取样比例达到50%时,取样群体的基因多样性达到最高,而且此时等位变异保留比例随着群体增大而增大的幅度不明显。从玉米初级核心种质到核心种质,若采用随机取样的方法取样,50%的取样比例最佳。

表5 随机取样时不同取样比例下各群体的遗传多样性及代表性
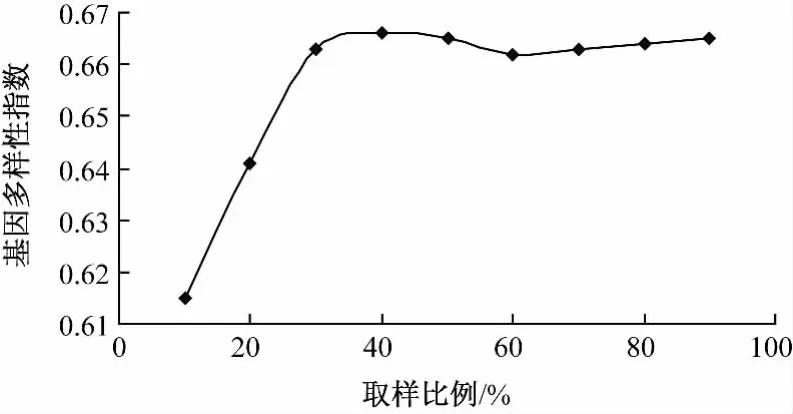
图4 随机取样时基因多样性指数与取样比例的关系

图5 随机取样时基因等位变异数与取样比例的关系
在聚类取样时,随着取样比例的增加,取样群体捕获到的等位变异数量持续增加,而基因多样性指数则是先迅速增大,然后逐渐减小 (表6)。这是因为当取样群体过大时,虽然仍然有新的等位变异被捕获,但是增加大量的遗传冗余而导致基因多样性的降低。图6和7是等位变异数和基因多样性随着取样群体规模的变化规律。当取样比例为40%时,基因多样性达到最大,而且此时等位变异的保留比例达到了95%,随着群体的继续增大,等位变异增加的幅度不明显。因此鲜食玉米从初级核心种质到核心种质,利用聚类方法取样,最佳取样比例是40%,取样材料数量约为136份。通过比较随机取样与聚类取样2种取样方法的等位变异捕获速度和基因多样性指数的变化规律,可以发现,聚类取样的效率要远高于随机取样,利用聚类方法构建核心种质所需要的群体要小于利用随机方法。因此聚类取样方法更适合从初级核心种质到核心种质的取样工作。
2.4 核心种质的生成
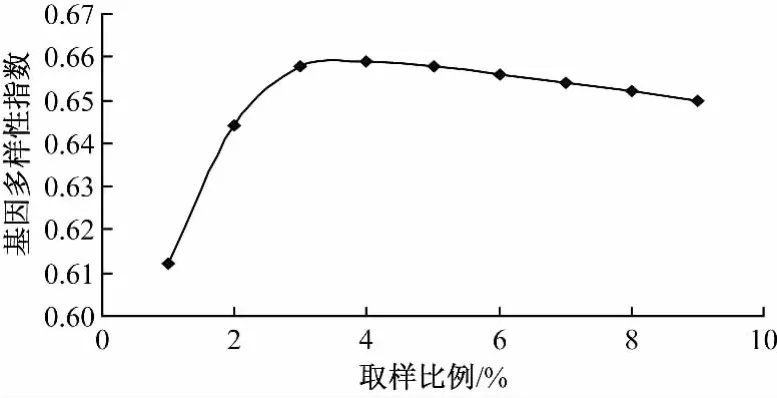
图6 聚类取样时基因多样性指数与取样比例的关系
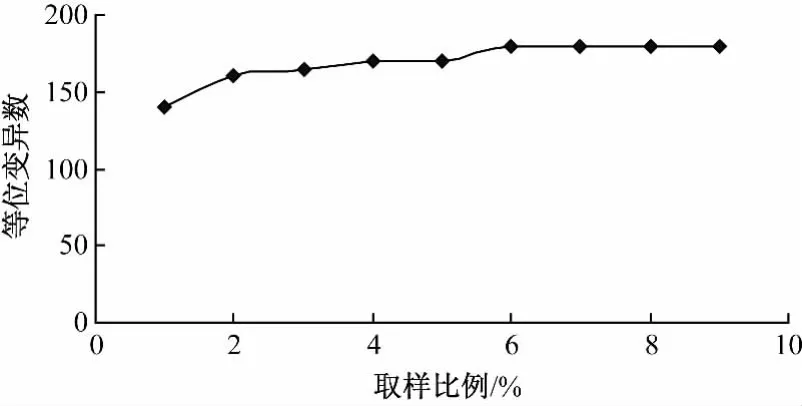
图7 聚类取样时等位变异数与取样比例的关系
核心种质取样分组方式包括按资源类型分组、按遗传结构分组等分组方式。本研究通过遗传结构与传统鲜食玉米分类方式比较发现,传统的分类方式不能够代表鲜食玉米的遗传结构,因此采取利用鲜食玉米初级核心种质的遗传结构分群方式进行分组,即初级核心种质共分为4组 (表4)。取样数量在群体间的分配方式包括等比例分配,同比例分配,根据遗传多样性进行分配等方式。本研究中4个遗传结构群体的材料数量比较接近,等比分配和同比分配的差异较小,而其遗传多样性指数差异也不明显 (表4),因此本研究直接采取组间同比分配的策略。同比分配即每组取样都按40%进行聚类取样,最终得到核心种质的群体大小为139份材料,捕获的等位变异数位176个,等位变异代表性为96.2%。其遗传多样性指数为0.66,核心种质的基因多样性高于初级核心种质的基因多样性。

表6 聚类取样时不同取样比例下各群体的遗传多样性相对于初级核心种质的代表性
3 讨论
3.1 中国玉米资源遗传多样性现状及应对策略
前人对不同类型、不同地区的玉米资源曾经做过遗传多样性的考察。姚启伦等[8]在中国西南玉米地方种质资源中发现每个SSR位点上的等位变异数为2~15个,平均6.4个;平均基因多样性指数为0.76。王明泉等[9]利用52份北方玉米自交系的遗传多样性,每个SSR位点获得了2~8个等位变异,平均4.35个,SSR位点的平均多态性指数为0.593。肖木辑等[10]在我国黄淮海地区玉米自交系中,每对SSR引物检测到等位基因2~7个,平均3.96个,每个位点的多态性信息量0.177~0.827,平均0.581。与上述研究结果相比,鲜食玉米遗传资源的遗传多样性要高于部分地区的地方种及生产中的骨干自交系,本研究中的遗传资源绝大部分是通过国内国外优良鲜食玉米品种经过多带自交获得的自交系,因此材料来源更为广泛,遗传基础相对较为丰富。
与世界其他国家尤其是玉米起源或种植历史较早的玉米遗传资源相比,中国玉米资源的遗传多样性较低。Hoxha等[11]利用20个SSR位点研究了阿尔巴尼亚玉米资源的遗传多样性,发现每个SSR位点的平均等位变异数为9.1。Liu Kejun等[12]考察了来自美国、欧洲、加拿大、南非和泰国260份玉米资源,发现每个SSR位点的平均等位变异数为21.7。Vigouroux等[13]的研究结果表明美洲玉米遗传资源平均每个SSR位点上的等位变异达到39个。解决中国玉米遗传资源极为匮乏这个瓶颈,要做好2个方面的工作:首先是加强国外资源的引进;另外是要通过构建核心种质,充分、高效的利用现有资源。
3.2 鲜食玉米的遗传结构与传统分类的关系
通过对玉米遗传资源以传统分类群体为单位进行聚类分析,发现普通玉米和鲜食玉米之间有最远的遗传距离,糯玉米和其他类型玉米之间的遗传距离次之,甜玉米和甜糯玉米之间的遗传关系最近,表明普通玉米和鲜食玉米之间有分化现象。因为鲜食玉米的糯性和甜度作为隐性单基因控制的性状,在育种和自交系构建时需要与普通玉米进行生殖隔离,这种隔离可能是造成鲜食玉米和普通玉米之间遗传分化的动力。尽管玉米在中国的种植历史只有500年左右[2],遗传资源的数量有限,而且遗传基础相对狭窄,但是中国云南是公认的糯玉米起源地之一[14]。本研究结果表明糯玉米群体和甜玉米及普通玉米有较远的遗传距离。这可能是长期的地理空间隔离及生殖隔离共同作用造成了糯玉米与其他玉米群体之间的分化。云贵地区糯玉米资源研究过程中也发现,云贵地区的糯玉米与其他地区的玉米遗传资源有较大遗传差异,不是仅仅表现在wax基因的差异上[15]。因此玉米资源遗传结构的形成不仅是单基因突变导致的,而是由生态隔离或空间隔离促成的。甜玉米在中国种植的历史较短,大部分甜玉米资源为近期从国外引种而来,国外甜玉米资源与国内玉米资源也同时存在空间隔离,这是造成甜玉米和其他类型玉米之间有较远遗传关系的原因之一。以单份材料为单位进行了聚类分析,发现4种玉米类型的材料并都没有被单独地聚成一类,而是随机地出现在若干结构群体中。表明,虽然糯玉米、甜玉米、普通玉米及甜糯玉米之间有了分化,但是分化水平不高。糯玉米和甜玉米是由普通玉米通过单基因突变形成的玉米类型,从起源上来看和普通玉米没有本质的差别,另外部分甜、糯玉米资源的改良是通过与普通玉米人工控制杂交、回交实现的,因此部分甜玉米、糯玉米、普通玉米及甜糯玉米在整个基因组上表现为较近的遗传关系,甚至被划分到同一个遗传群体中也是合理的。
3.3 核心种质构建是最大代表性和最少材料数这一对矛盾的相对平衡
构建核心种质的目的在于以最小的样本规模达到最大限度地代表整个遗传资源群体的遗传多样性。但是核心种质遗传代表性和资源数量之间存在非线性关系[7]。核心种质所包含的遗传变异数量随着材料数量的增加而增加,但是增加的幅度逐渐减小,因此随着核心种质材料数量的增加,捕获遗传变异的效率是逐渐降低的,引入核心种质的遗传冗余度也逐渐增大。核心种质的代表性和实用性(最大代表性和最少材料数)是一对矛盾,而且不同的遗传资源等位变异的捕获效率和相等取样规模时群体的基因多样性是不同的,因此在构建核心种质时不同的遗传资源的取样比例没有可比性。目前还未有用最小的资源样本规模实现最大程度地代表整个遗传资源取样方法的报道。
研究等位变异的保留比例即等位变异的代表性和取样数量之间的关系结果表明,利用聚类方法当取样比例达到40%的时候,其等位变异的代表性已经达到96.2%,基本代表了全部初级核心种质的遗传多样性。此时的材料数为139份,占整个遗传资源的4%。根据遗传结构进行分组,利用聚类方法进行取样,通过考察等位变异保留比例和取样比例之间的关系确定最佳取样规模进行核心种质构建的方法是可行的。
[1]Frankel O H.Genetic perspectives of germplasm conservation[G]//Arber W,Illmensee K,Peacock W J,et al.Genetic manipulation:Impact on man and society.London:Cambridge University Press,1984:161 -170.
[2]崔俊明.新编玉米育种学[M].北京:中国农业科学技术出版社,2007:1-2.
[3]Rogers O S,Bendich A J.Extraction of DNA from plant tissues[G]//Gelvin S B,Schilperoort R A,Verma D P S.Plant molecularbiology manual.Dordrecht:KluwerAcademic Publishers,1988:1 -10.
[4]刘志斋,郭荣华,石云素,等.中国玉米地方品种核心种质花期相关性状的表型多样性研究[J].中国农业科学,2008,41(6):1591-1602.
[5]Bassam B J,Caetano-Anolles G,Gresshoff P M.Fast and sensitive silver staining of DNA in polyacrylamine gels[J].Analytical Biochemistry,1991,196:80-83.
[6]Liu K,Muse S.PowerMarker:New Genetic Data Analysis Software,2004,Version 2.7 [DB/OL].http://www.powermarker.net.
[7]Falush D,Stephens M,Pritchard J K.Inference of population structure using multilocus genotype data:linked loci and correlated allele frequencies[J].Genetics,2003,164:1567-1587.
[8]姚启伦,方平,杨克诚,等.基于SSR标记构建西南玉米地方品种核心种质的方法 [J].湖南农业大学学报,2009:35(3):225-228.
[9]王明泉,苏俊,李春霞,等.我国北方部分玉米自交系的遗传多样性分析[J].玉米科学,2010,18(3):11-15.
[10]肖木辑,李明顺,李新海,等.黄淮海地区主要玉米自交系的SSR遗传多样性分析 [J].玉米科学,2008,16(2):1-7.
[11]Hoxha S,Shariflou M R,Sharp P.Evaluation of genetic diversity in Albanian maize using SSR markers [J].Maydica,2004,49:97-103.
[12]Liu K,Goodman M,Muse S,et al.Genetic structure and diversity among maize inbred lines as lnferred from DNA microsatellites[J].Genetics,2003,165:2117-2128.
[13]Vigouroux Y,Glaubitz J C,Matsuoka Y,et al.Population structure and genetic diversity of new world maize races assessed by DNA microsatellites [J].American Journal of Botany,2008,95(10):1240-1253.
[14]Weatherwax P.The ancestry of maize-a reply to criticism [J].Bulletin of the Torrey Botanical Club,1919,46:275-278.
[15]田孟良,黄玉碧,刘永建,等.SSR标记揭示的云南省、贵州省糯玉米与普通玉米种质资源的遗传差异[J].四川农业大学学报,2003,21(3):213-216.
