无菌部位金黄色葡萄球菌耐药性及分子流行病学特征
2013-09-11邬靖敏豆清娅邹明祥
袁 鲲,邬靖敏,,豆清娅,李 军,邹明祥
(1.长沙市第一医院,长沙 410005;2.中南大学湘雅医院,长沙 410008;)
金黄色葡萄球菌(以下简称金葡菌)是医院和社区获得性感染的重要病原菌。随着抗菌药物的广泛应用,其耐药现象日趋严重。其中,耐甲氧西林金黄色葡萄球菌(MRSA)由于对几乎所有β 内酰胺类药物(包括头孢菌素、含酶抑制剂复合抗生素以及碳青霉烯类药物)耐药,给临床抗感染治疗带来极大挑战,成为国内外学者研究的热点。然而,关于金葡菌的现有研究主要集中于开放性部位来源标本,如痰液、分泌物等,而探讨无菌部位来源菌株研究较少。本研究对分离自无菌部位的金葡菌采用琼脂稀释法定量检测其敏感性,PCR 技术对耐甲氧西林金葡菌进行SCCmec 基因同源性分析及杀白细胞毒素(PVL)基因的检测,以了解无菌部位分离金葡菌的耐药性和分子流行病学特征,为临床预防和控制其感染以及合理应用抗菌药物提供实验依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源
临床菌株来源于2011年8月至2012年6月本院无菌部位(血液、骨髓、胸水、腹水、关节液、穿刺液、脑脊液)分离的50 株非重复金黄色葡萄球菌。质控菌株金黄色葡萄球菌ATCC29213和ATCC25923 购自卫生部临床检验中心,ATCC43300(MRSA)由法国梅里埃公司惠赠。
1.1.2 仪器与试剂
VITEK-2 微生物分析系统及配套的鉴定卡和药敏卡(法国梅里埃生物公司);BACTEC-9240 血培养仪(美国BD 公司);低温高速离心机(Eppendorf公司);头孢西丁(30 μg/片)、苯唑西林(1 μg/片)药敏纸片为英国OXOID 公司产品。
1.2 方法
1.2.1 菌株的分离培养及鉴定
按《全国临床检验操作规程》第3 版标准进行。将培养于血琼脂培养基上18~24h的细菌进行革兰染色、触酶试验、试管法血浆凝固酶试验等初步鉴定,以Vitek-2 全自动微生物鉴定系统进行系统鉴定。
1.2.2 耐甲氧西林金葡菌(MRSA)鉴定
将新鲜培养的金黄色葡萄球菌用无菌生理盐水配制成0.5 麦氏浊度的悬液,无菌棉签蘸取菌液均匀涂布于厚度为4mm的M-H 琼脂平皿上,待水份被吸收后,分别将苯唑西林和头孢西丁纸片贴于琼脂表面。头孢西丁含量为30μg/片,置35 ℃孵育18h。结果判定标准:头孢西丁抑菌圈直径≤21 mm为耐药,≥22 mm 为敏感。苯唑西林含量为1μg/片,在35 ℃孵育24h。结果判定标准:苯唑西林抑菌圈直径≤10mm 为耐药,≥13 mm 为敏感。2 种药物中有任一结果为耐药,则菌株对苯挫西林耐药,即为MRSA,同 时 以 标 准 菌 株 ATCC25923和ATCC43300 分别作阴性和阳性对照。
1.2.3 药物敏感性试验
采用琼脂稀释法检测检测金葡菌对抗菌药物的最小抑菌浓度(MIC),结果以2010年CLSI 标准进行判断[1]。
1.2.4 细菌基因组DNA 提取
从35℃过夜培养的血琼脂培养基上挑取3~5个金葡菌菌落于0.5ml的无菌生理盐水中,配制成约2 麦氏浊度的菌液,10000g 离心3min,尽量吸尽上清。向沉淀中加入180μL 溶菌酶(终浓度为20mg/mL)充分混匀,37℃水浴50min 后加入20μL蛋白酶K 溶液,混匀。其余步骤按细菌基因组DNA提取试剂盒说明书进行。将提取的基因组DNA 置-80℃保存。
1.2.5 SCCmec 分型及PVL 基因检测PCR 检测PVL 基因及多重PCR 检测SCCmec 相关基因。此部分试验在华中科技大学同济医学院附属同济医院检验科完成,所用试验方法将另文发表。
1.2.6 数据分析
将病人资料及MIC 值输入Whonet 5.6 进行处理,结果按美国临床和实验室标准协会2010 版文件有关金黄色葡萄球菌的折点判定为敏感、中介或耐药。计数资料采用χ2 检验,检验水准为P<0.05,统计软件为SPSS 13.0。
2 结果
2.1 金葡菌的标本分布
50 株金黄色葡萄球菌均来自于无菌部位。其中,血液标本27 株(54.0%),其次是穿刺液12 株(24.0%),腹水4 株(8.0%),脑脊液3 株(6.0%),骨髓2 株(4.0%),胸水和关节液各1 株(2.0%);住院患者43人(86.0%),门诊患者7人(14.0%)。
2.2 金葡菌对抗菌药物的敏感性检测结果
金葡菌对青霉素、红霉素的耐药率最高,分别达90.0%和62.0%,对氯霉素、利福平、左氧氟沙星的耐药率相对较低,分别为2.0%、16.0%、16.0%;对其余抗菌药物的耐药率在18.0%-30.0%之间(见表1)。50 株金葡菌中,甲氧西林敏感菌株(MSSA)为35 株(70.0%),MRSA 为15 株(30.0%),二者对青霉素的耐药率均很高,差异无统计学意义;除对万古霉素,替加环素,替考拉宁,利奈唑胺,达托霉素的敏感率均为100%外,对其余12 种药物的耐药率,MRSA 明显高于MSSA,差异有统计学意义(见表2)。
2.3 SCCmec 分型及PVL 基因检测结果
15 株 MRSA中,11 株 为 SCCmec Ⅲ型(73.3%),4 株为SCCmecⅣ型占26.7%,PVL 基因扩增均为阴性。
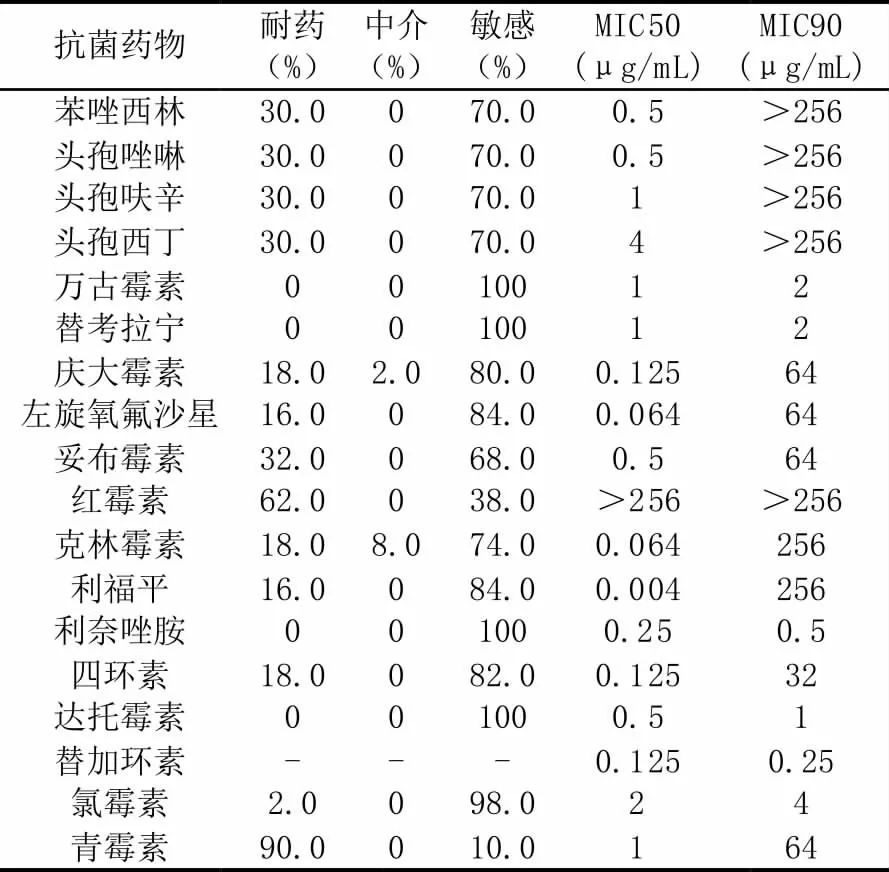
表1 50 株金黄色葡萄球菌对常用抗菌药物的药敏性
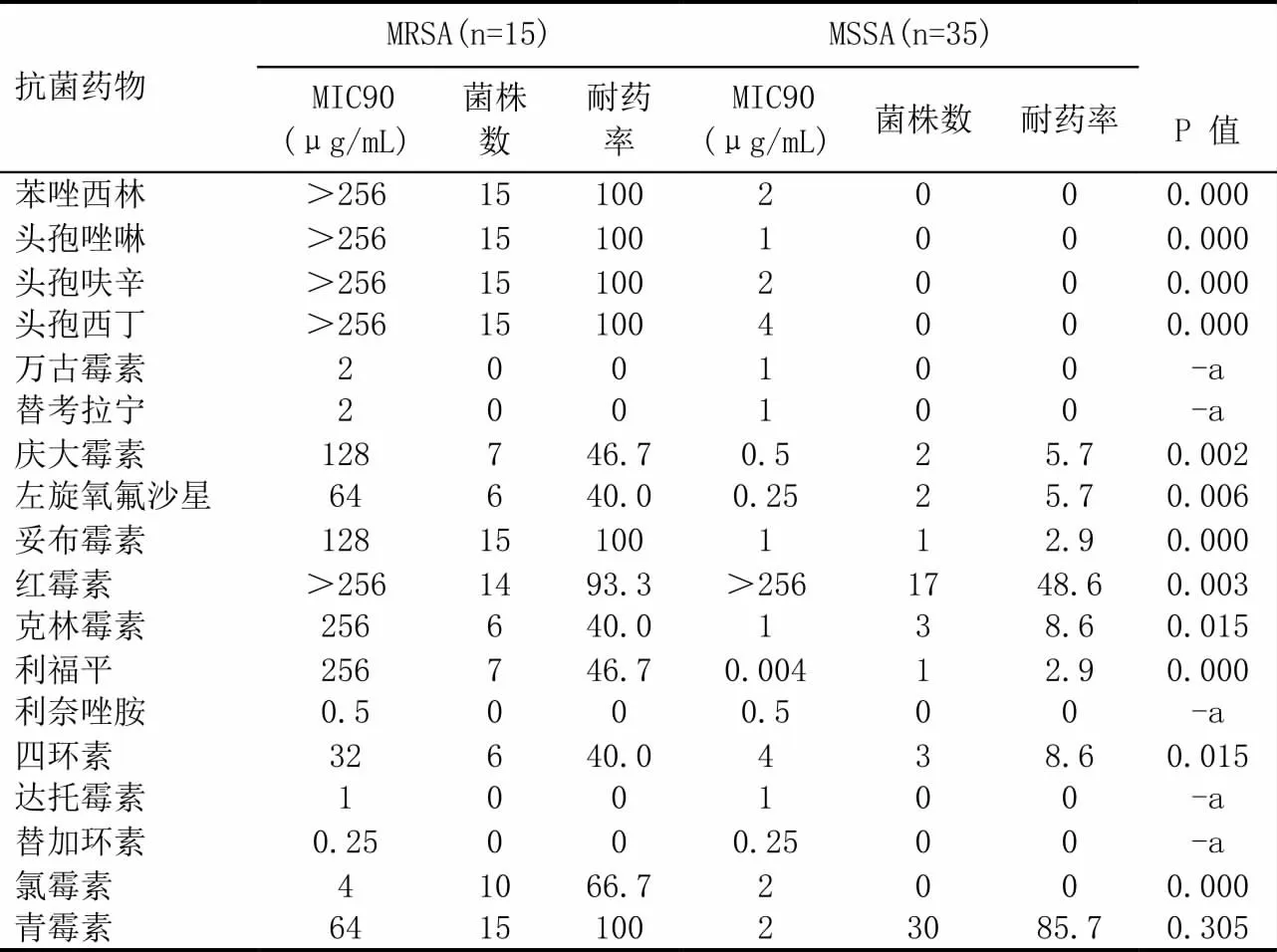
表2 MRSA 与MSSA 对常用抗菌药的耐药率比较
3 讨论
本研究中无菌部位标本共检出50 株金黄色葡萄球菌。其中,MRSA 为15 株,检出率为30.0%,明显低于卫生部全国细菌耐药监测网的50.5%[2]和本课题组前期研究的54.5%[3]。同时,50 株金葡菌对大多数抗菌药物的耐药率低于全国水平[2],推测可能与本研究标本仅来源于无菌部位有关。说明在细菌耐药监测中,应该重视感染部位的区分,以便临床掌握相关流行病学数据来经验选用抗菌药物。在被检测的18 种药物中,金葡菌对青霉素耐率最高,达90.0%,说明青霉素已不能用于金葡菌感染的经验治疗。与MSSA 相比,MRSA 对多种抗菌药物的耐药率均高于MSSA,说明临床实验室应常规开展MRSA 监测。万古霉素是治疗MRSA 感染的首选药物,但在临床应用中应注意异质性万古霉素耐药的金黄色葡萄球菌(hVISA)的出现,动态监测万古霉素耐药性。
MRSA 多重耐药的主要机制是产生低亲和力青霉素结合蛋白2a(PBP2a) 所致,其由位于葡萄球菌盒式染色体SCCmec 上的mecA 基因编码。采用SCCmec 分型方法对MRSA 进行分子生物学分型,是判断菌株亲缘关系和传播范围的重要手段。迄今为止,在全世界范围内共发现11 种不同的SCCmec型别,其中又以Ⅰ~Ⅴ为主[4]。Ⅱ和Ⅲ型常见于医院获得性MRSA,常整合一些其他类抗菌药物的耐药基因,表现为对多种抗菌药物耐药,对非β-内酰胺类药物的耐药率相对较高。Ⅳ、Ⅴ型多见于社区获得性MRSA,很少携带其他耐药基因,仅对β-内酰胺类和红霉素等少数抗菌药物耐药,对非β-内酰胺类药物的耐药率相对较低[5-6]。本研究中,MRSA分为SCCmecⅢ和Ⅳ2 种型别,分别占73.3%和26.7%,表明本院MRSA 以SCCmecⅢ型为主,与西安[7]和宁夏[8]地区报道的研究结果相近,而与大连[9]主要以SCCmecⅡ为主不同。说明MRSA的流行可能存在地域和时间特征。值得注意的是本研究从门诊患者中分离出2 株SCCmecⅢ型MRSA,提示多重耐药MRSA 可能向社区传播。
PVL 是一种能破坏白细胞、巨噬细胞导致中毒性炎症反应的膜钻孔毒素,能引起浅表皮肤软组织感染和深部组织及脏器感染。由于携带PVL基因的金葡菌毒力强,感染后与疾病的严重程度有关。因此,检测菌株是否产PVL 毒素对临床评估疾病的严重程度及预后具有十分重要的价值。本研究中所有MRSA 均未检测到PVL 基因,与文献报道的PVL 主要存在于社区获得性MRSA的结论一致[10]。
[1]Clinical and Laboratory Standards Institute (CLSI).Performance standards for antimicrobial susceptibility testing [S].M100-S20,2010.
[2]肖永红,沈萍,魏泽庆,等.Mohnarin 2011年度全国细菌耐药监测[J].中华医院感染学杂志,2012,22 (22):4946-4952.
[3]邹明祥,武文君,邬靖敏等.长沙地区临床分离金黄色葡萄球菌的耐药监测[J].中国微生态学杂志,2012,24(5):415-418
[4]Shore AC,Deasy EC,Slickers P,et al.Detection of staphylococcal cassette chromosome mec type XI carrying highly divergent mecA,mecI,mecR1,blaZ,and ccr genes in human clinical isolates of clonal complex 130 methicillin -resistant Staphylococcus aureus.Antimicrob Agents Chemother.2011.55(8):3765-3773.
[5]Song J H,Hsueh P R,Chung D R,et al.Spread of methicillin-resistant Staphylococcus aureus between the community and the hospitals in Asian countries:an ANSORP study [J].J Antimicrob Chemother,2011,66(5):1061-1069.
[6]马笑雪,孙丹丹,王斯,等.医院内流行社区型MRSA的分子生物学特点分析[J].中国病原生物学杂志,2010,5(10):725-728.
[7]王蕾,李武平,刘冰,等.西安地区耐甲氧西林金黄色葡萄球菌的SCCmec 基因分析 [J].中国卫生检验杂志,2012,22(3):504-508.
[8]崔学光,魏军,贾伟,等.烧伤科耐甲氧西林金黄色葡萄球菌杀白细胞素基因检测及SCCmec 分子流行病学调查[J].中华医院感染学杂志,2012,22(13):2721-2723.
[9]陈洁,李岩,王晶,等.耐甲氧西林金黄色葡萄球菌SCCmec 基因分型及耐药谱分析[J].中华医院感染学杂志,2012,22(5):894-897.
[10]Nichol K A,Adam H J,Hussain Z,et al.Comparison of community -associated and health care -associated methicillin -resistant Staphylococcus aureus in Canada:results of the CANWARD 2007-2009 study [J].Diagn Microbiol Infect Dis,2011,69(3):320-325.
