中国北方奶牛金葡菌乳房炎感染现状及耐药性和流行类型研究进展
2015-03-22王晓,俞英
王 晓,俞 英
(中国农业大学动物科技学院农业部畜禽遗传育种重点实验室&畜禽育种国家工程实验室,北京 100193)
中国北方奶牛金葡菌乳房炎感染现状及耐药性和流行类型研究进展
王 晓,俞 英*
(中国农业大学动物科技学院农业部畜禽遗传育种重点实验室&畜禽育种国家工程实验室,北京 100193)
奶牛乳房炎,尤其是由金黄色葡萄球菌(金葡菌)感染引起的隐性乳房炎是最难以防控的奶牛常见病。近五年来,本课题组对中国北方六个省市九个荷斯坦牛场的生产群高体细胞数(SCC)和低SCC奶牛以及临床乳房炎奶牛进行了十一批次采样,共采集奶样1 112头份,分离出191株金葡菌,所检测牛的平均金葡菌感染率达11.7%,其中生产群奶牛金葡菌感染率为12.4%,临床乳房炎牛为10.8%。对这些金葡菌进行药敏试验以及毒素基因检测,发现氯霉素和阿米卡星对金葡菌有较强抑制性,毒素基因检出率最高者是杀白细胞素基因PVL(70.2%)。依据金葡菌PFGE分型结果绘制中国北部及华东地区奶牛乳源金葡菌的流行图谱。结合国内外相关研究结果,对比分析了国内外奶牛金葡菌乳房炎的感染情况以及金葡菌的耐药性、毒素基因和流行类型,并提出了降低奶牛感染金葡菌乳房炎的相关策略。
奶牛乳房炎;金黄色葡萄球菌;耐药性;流行类型
奶牛乳房炎(mastitis)又称乳腺炎,是奶牛最常见、危害最大的疾病之一,目前全球每年因该病造成的损失约350亿美元[1-2]。奶牛乳房炎不仅影响奶牛的产奶量、降低原料奶的品质,还会影响奶牛正常生理功能,延长产后发情时间,严重的会造成奶牛过早淘汰而增加牛群更替成本。奶牛乳房炎以隐性乳房炎发病率最高、危害最大,此类患病牛没有明显肉眼可见的临床症状,但已然是牛群的乳房炎感染源。全球约三分之一以上的奶牛患有不同程度的隐性乳房炎,我国奶牛隐性乳房炎的发病率高达25%~68%[3]。金黄色葡萄球菌(Staphylococcusaureus,S.aureus,简称金葡菌)是导致奶牛隐性乳房炎的主要致病菌[4]。该菌具有较强的免疫抑制特征和耐药性,由其引起的奶牛乳房炎难以治愈,治愈后复发率高,因此一旦发现金葡菌感染牛,通常只能淘汰,造成较大经济损失。我国北方是中国奶牛的主要养殖区,对我国奶业发展具有举足轻重的地位。作者对我国北方六个省市的荷斯坦牛金葡菌乳房炎的感染现状,结合国内外其他相关研究对金葡菌的耐药性、毒力基因种类和流行类型等进行了综述,并对降低奶牛金葡菌乳房炎感染的策略和方法进行了总结和讨论。
1 金葡菌基本特性及奶牛金葡菌乳房炎
1.1 金葡菌的耐药性
金葡菌极易产生耐药性,对常用的多种抗菌药都不敏感[4]。近年来随着抗菌药的过度使用及滥用,金葡菌的多重耐药性问题也不断加剧。目前,多个国家报道了奶牛奶样中金葡菌多重耐药现象,因此金葡菌的多重耐药性已经成为公共关注的社会问题[5-7]。其中耐甲氧西林金黄色葡萄球菌(methicilin-resistantStaphylococcusaureus,MRSA)随着抗菌药的过度使用不断出现。MRSA具有多重耐药性是因其遗传决定子mecA基因编码青霉素结合蛋白2a,从而使金葡菌与β-内酰胺类抗菌药的亲和力降低,造成对β-内酰胺类抗菌药耐药[8]。因此,对奶牛金葡菌多重耐药性进行研究和防控已经非常必要。
1.2 金葡菌的毒素基因
金葡菌是一种环境型传染性致病菌,可产生多种毒素。其中肠毒素(enterotoxins,SEs)为超抗原家族成员,是引起食物中毒的主要因子[9],主要包括肠毒素A(SEA)、B(SEB)、C(SEC)、D(SED)、E(SEE)、G(SEG)、H(SEH)、I(SEI)和J(SEJ)等[10]。剥落毒素(exfoliative toxins,ETs)和休克综合征毒素-1(toxic shock syndrome toxin-1,TSST-1)同为超抗原家族成员,也是引起食物中毒的主要因子[11]。ETs包括剥落毒素A(ETA)和剥落毒素B(ETB),常引起表皮散热功能失调[12-13]。TSST-1是休克综合征毒素中最重要的一种,通常引起局部或者全身的中毒休克综合征[14]。杀白细胞素(panton-valentine leukocidin,PVL)可杀死白细胞和巨噬细胞或破坏其功能,使细菌被吞噬后仍可在细胞内生长繁殖,导致约40%的金葡菌乳房炎感染牛乳汁中体细胞数(somatic cell count,SCC)低于20万·mL-1[15]。
1.3 奶牛金葡菌乳房炎的致病机制
金葡菌通过奶牛的乳头导管或乳房皮肤外伤等因素进入奶牛的乳房组织,经过一系列宿主—病原互作反应引起乳腺发生炎症反应。金葡菌进入奶牛乳腺后,首先表达铁离子获得受体(如IsdB)和锰离子上调受体(如ABC转运蛋白),为其在宿主体内生长繁殖获得铁离子和锰离子等最基本的营养元素。其次,为了定居在宿主体内并进行繁殖,金葡菌黏附在宿主细胞膜表面。有黏附作用的金葡菌黏附素包括纤连蛋白结合蛋白A、B(FnBPA和FnBPB),凝集因子A、B(ClfA和ClfB),胶原蛋白结合蛋白(Cna)和表面蛋白A(SasA)等。为了在奶牛乳腺内定居繁殖,金葡菌还有一系列逃避宿主细胞吞噬的机制,如荚膜多糖可阻隔抗体和其表面蛋白的接触,从而阻止抗体介导的调理吞噬作用等[12-15]。因此,金葡菌具有较强的免疫抑制特征,常引起无明显外观变化而产奶量已显著降低的隐性乳房炎。
目前关于临床乳房炎牛的金葡菌感染情况及耐药性报道较多[16-18],但针对生产群泌乳牛的金葡菌研究报道较少[19]。
2 我国北方奶牛金葡菌乳房炎感染现状
在生产群泌乳牛中,未被发现的金葡菌乳房炎隐性感染牛极易通过挤奶工、挤奶设备、蚊蝇叮咬等感染其他奶牛,因此宜尽早发现金葡菌感染牛,并及时隔离切断金葡菌感染源,避免易感牛群的感染。
2.1 临床乳房炎牛与生产群泌乳牛的金葡菌感染率
2009年至2013年间,本课题组分别从中国北方陕西省、北京市、黑龙江省、天津市、山西省和辽宁省六个省市及地区的9个奶牛场进行11批次(A、B、C、D、E、F、G、H、I、J和K批次)的奶样采集,采用无菌法采集了新鲜奶样1 112头份[20-23]。依据GB/T 4789.10-2008国标方法对这些奶样进行金葡菌分离纯化及特异基因的分子鉴定[20-23],每份奶样分离到1~2株菌,一共检测出191株金葡菌,其中从A、B、C、D、E、F、G、H、I、J和K批次中分别分离出69、27、10、18、4、4、7、4、4、22和22株金葡菌(表1)。在这十一次采样中,共采集生产群泌乳牛奶样595头份,乳房炎牛奶样517头份,其中生产群泌乳牛奶样的平均金葡菌检出率为12.4%,而乳房炎牛奶样的平均金葡菌检出率低于生产群泌乳牛,为10.8%,其中A、C和D批次临床乳房炎牛奶样的金葡菌检出率均低于泌乳牛。分析其原因可能有两种,其一是所采集临床乳房炎牛已接受过抗菌药等治疗,其二是所检测临床乳房炎牛主要由其他类型病原感染所致。不同奶样来源间比较,金葡菌检出率最高者为北京地区某牛场的乳房炎牛奶样(50.0%),检出率最低的为天津地区某牛场采集的泌乳牛奶样(3.9%)。
表1 中国北方地区六省市荷斯坦牛奶样金葡菌检出率
Table 1 Detection rate ofS.aureusfrom Chinese Holstein milk samples in Northern China
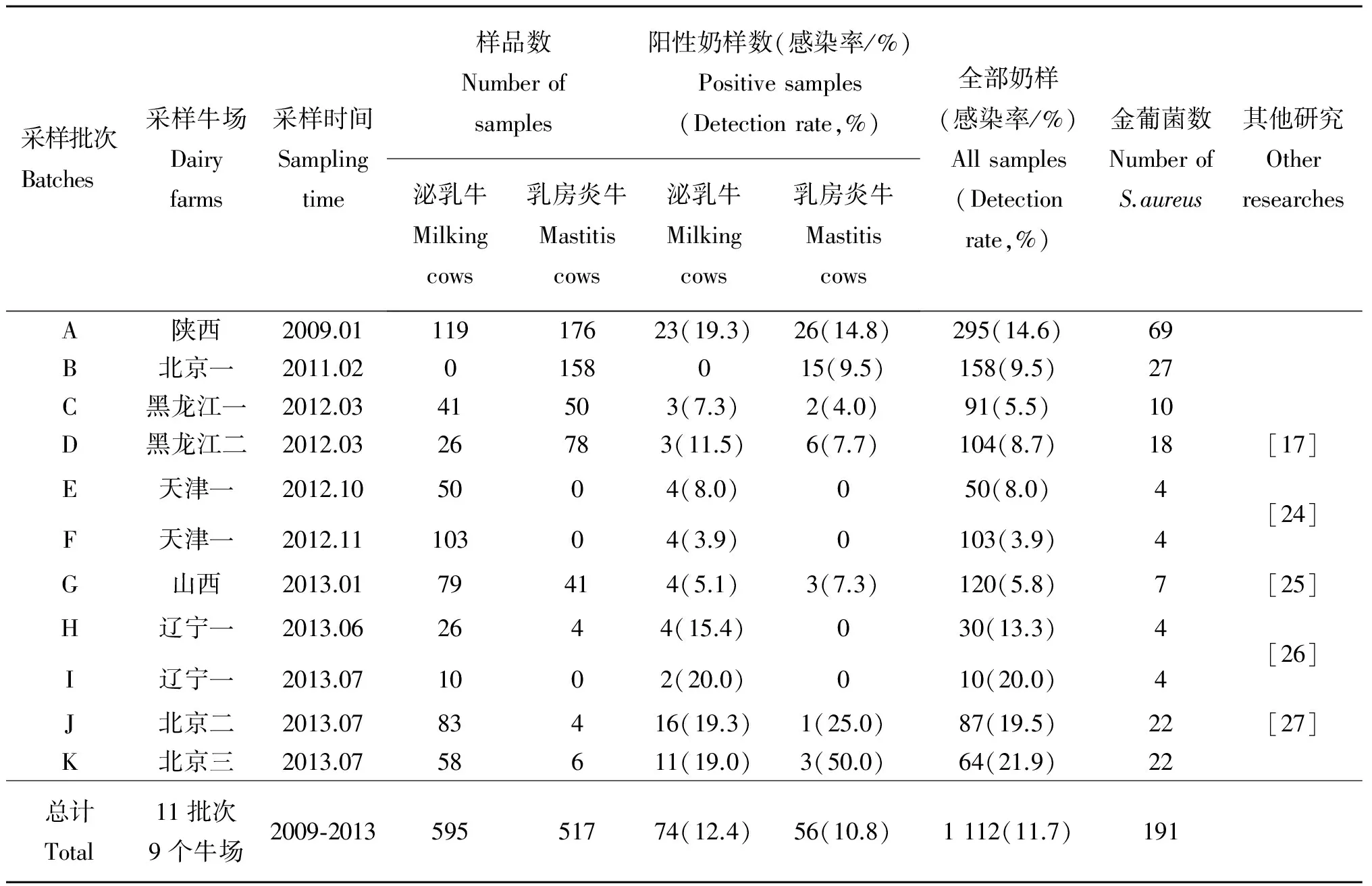
采样批次Batches采样牛场Dairyfarms采样时间Samplingtime样品数Numberofsamples阳性奶样数(感染率/%)Positivesamples(Detectionrate,%)泌乳牛Milkingcows乳房炎牛Mastitiscows泌乳牛Milkingcows乳房炎牛Mastitiscows全部奶样(感染率/%)Allsamples(Detectionrate,%)金葡菌数NumberofS.aureus其他研究OtherresearchesA陕西2009.0111917623(19.3)26(14.8)295(14.6)69B北京一2011.020158015(9.5)158(9.5)27C黑龙江一2012.0341503(7.3)2(4.0)91(5.5)10D黑龙江二2012.0326783(11.5)6(7.7)104(8.7)18[17]E天津一2012.105004(8.0)050(8.0)4F天津一2012.1110304(3.9)0103(3.9)4[24]G山西2013.0179414(5.1)3(7.3)120(5.8)7[25]H辽宁一2013.062644(15.4)030(13.3)4I辽宁一2013.071002(20.0)010(20.0)4[26]J北京二2013.0783416(19.3)1(25.0)87(19.5)22[27]K北京三2013.0758611(19.0)3(50.0)64(21.9)22总计Total11批次9个牛场2009⁃201359551774(12.4)56(10.8)1112(11.7)191
不同国家和地区奶牛的金葡菌检出率也有所变化。德国奶牛的金葡菌检出率相对较低,研究者对6 915头份无乳房炎的临产母牛奶样进行金葡菌分离鉴定,检出率为4.0%;1 325头份初产牛和乳房炎牛奶样的金葡菌检出率为7.3%~11.5%[24]。比利时奶牛的金葡菌检出率也不高,SCC大于25万的25 660份乳区奶样的金葡菌检出率为7.6%[25]。而埃塞俄比亚北部的奶牛金葡菌检出率较高,采用美国加利福尼亚乳房测试法(Californian mastitis test,CMT)鉴定出的乳房炎阳性牛的金葡菌检出率高达41.7%,临床乳房炎牛的金葡菌检出率为27.3%[26]。在爱尔兰,研究者发现SCC大于20万的285头份奶样的金葡菌检出率为21%[27]。我国南方浙江省地区,890头份奶牛的乳房炎阳性乳区的奶样金葡菌检出率为12.2%[17]。本课题组所检测的我国北方九个奶牛场荷斯坦牛的金葡菌感染率介于3.9%~21.9%,平均金葡菌感染率为11.7%,略低于浙江省检测牛群,与德国初产牛和乳房炎牛的金葡菌检出率相近。
2.2 高SCC与低SCC奶牛的金葡菌感染率
牛乳中体细胞数(somatic cell count,SCC)是指每毫升乳汁中体细胞的数量,健康牛乳汁中的SCC为乳腺正常脱落的上皮细胞,通常小于5万·mL-1。乳腺发生炎症后,牛乳中SCC通常会剧增,主要成分是来自血液的白细胞。许多国家将SCC作为奶牛乳房炎的重要监测指标,目前我国对于健康牛、隐性乳房炎牛及乳房炎阳性牛的SCC界定标准分别为低于10万·mL-1、20~50万·mL-1及高于50万·mL-1。
据报道,近40%的金葡菌乳房炎感染牛的乳汁SCC低于20万·mL-1[15],这些带菌牛易被误认为健康牛而成为整个牛群的金葡菌感染源。为分析我国北方生产群泌乳牛的金葡菌感染情况,结合乳房炎监测指标SCC,进一步对采样批次C、D、E、F、G、H、I、J和K的泌乳牛进行高SCC和低SCC牛的金葡菌感染率分析。其中高SCC和低SCC牛的划分标准是相邻两个测定日的SCC差值高低[22-23]:如果SCC2- SCC1≤μ且SCC2≤μ、SCC1≤μ,则该牛为低SCC牛;如果SCC2-SCC1>μ且SCC2>μ、SCC1≤μ,则为高SCC牛。其中,SCC1为采样日前一月的SCC测定日记录,SCC2为采样月的SCC值,μ为该牛场SCC的平均值。
采样批次E、F、G、J和K的高SCC牛奶样金葡菌检出率要高于低SCC牛奶样,可见多数牛场的高SCC牛比低SCC牛的金葡菌分离率高(图1)。D、H和I批次的低SCC牛奶样没有分离出金葡菌,D和I批次的高SCC牛奶样有较高的金葡菌检出率,分别为40%和50%(图1)。因此,依据SCC差值法所确定的高SCC牛比低SCC牛更可能是金葡菌感染的隐性乳房炎牛,对于这些高SCC牛应及时进行乳样的金葡菌检测,防止其从隐性乳房炎发展成临床乳房炎。值得注意到是,C、J和K三场(批次)的低SCC牛奶样的金葡菌分离率(20.8%~37.5%)要高于所检测牛的平均水平(11.7%),这些低SCC牛基于常规SCC指标不易发现是金葡菌隐性乳房炎感染牛,因此应特别关注分离出金葡菌的低SCC牛,避免其成为难以防控的金葡菌感染源。
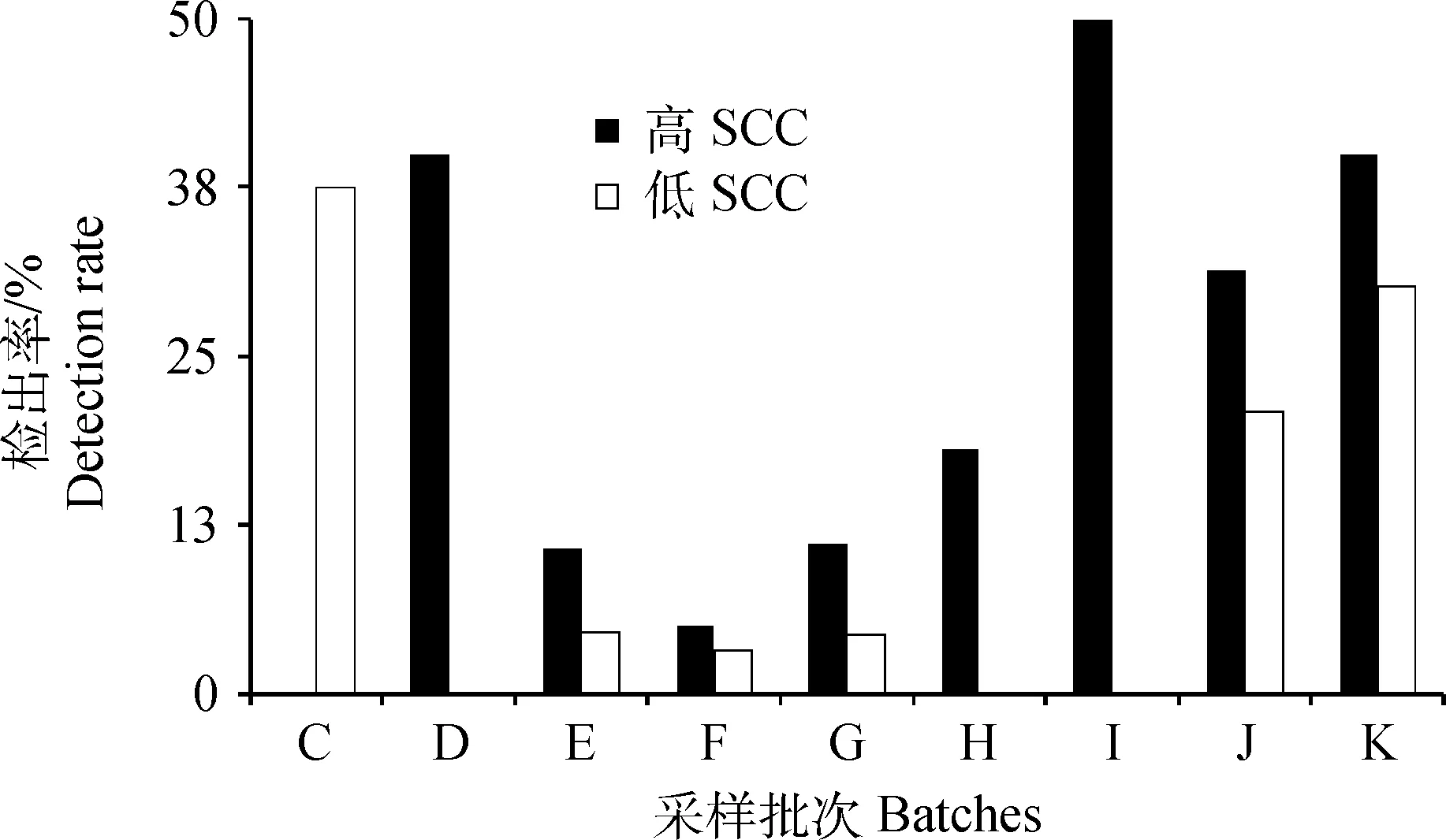
图1 C-K批次高SCC和低SCC牛奶样的金葡菌感染率Fig.1 Detection rate of S.aureus isolated from cow milk samples with high and low SCC from C to K sampling batches
3 奶牛乳源金葡菌的耐药性
目前金葡菌乳房炎牛的治疗效果不稳定,治愈后复发率高,分离纯化出的乳源金葡菌存在较强耐药性现象,作者通过药敏试验检测了乳源金葡菌的耐药性。根据CLSI(Clinical and Laboratory Standards Institute)标准,采用纸片扩散法和琼脂稀释法检测了B、C、D、I、J和K批次奶样的38种抗菌药的药敏性[20,23](表2)。在这些抗菌药中,21种为兽用临床抗菌药、17种为非兽用临床抗菌药(《中华人民共和国兽药典》(2010版)和《兽药手册》)[28-29]。
通过两种药敏试验方法发现,所检测的全部金葡菌对氯霉素和万古霉素敏感,对阿米卡星和头孢哌酮的敏感性也较高。但金葡菌的耐药性也相当突出,其中北京地区B、J和K批次奶样所分离出的金葡菌对复方新诺明有较高耐药性,耐药率分别为80%、100%和100%。J和K批次奶样的金葡菌对环丙沙星(100%和100%)和头孢西丁(90.9%和95.5%)的耐药率较高,而B批次奶样中的金葡菌对环丙沙星(16%)和头孢西丁(20%)的耐药率较低(表2)。黑龙江地区C、D批次奶样分离出的金葡菌对头孢类、大环内酯类、氟喹诺酮类和氨基糖苷类抗菌药都敏感,其耐药率明显低于B、J、K场。青霉素类和头孢类抗菌药同属β-内酰胺类抗菌药,对革兰阳性菌有明显的抗菌效果,其中头孢类抗菌药作为高效金葡菌抗菌药,有更好的杀菌效果。如表2所示,金葡菌对头孢类抗菌药的耐药率为0%~4.0%,明显低于青霉素类抗菌药(21.8%~33.7%),但头孢西丁的耐药率较高,达51.5%,这可能与该类抗菌药过度使用有关。


国内其他相关研究也发现浙江、河北等省市地区奶牛乳源金葡菌具有较强耐药性。其中,浙江省金华市和台州市泌乳牛奶样分离的金葡菌对氯霉素有较高耐药率(61.1%和62.5%),而杭州市和宁波市分离的金葡菌对氯霉素的耐药率较低(13.2%和20.0%)。金华、台州、杭州和宁波这四个地区分离的金葡菌对环丙沙星(22.2%、12.5%、5.3%和0%)和头孢西丁的耐药率较低(5.6%、0%、2.6%和0%),此结果与北京地区B批次奶样金葡菌的药敏试验结果类似[17]。对内蒙古、河北和黑龙江三省的835头份奶样分离的236株金葡菌进行药敏试验发现,环丙沙星和头孢西丁的耐药率分别为20.3%和22.0%[18]。张静等通过药敏试验发现,44株来自泌乳牛奶样的金葡菌和57株来自临床乳房炎牛奶样的金葡菌对氯霉素的耐药率分别为11.4%和28.1%,其中泌乳牛奶样金葡菌的耐药率均为0%,而乳房炎牛奶样金葡菌对环丙沙星和头孢西丁的耐药率分别为24.6%和19.3%[30]。
采样批次B、J和K是来自北京地区三个荷斯坦牛场的奶样,这些奶样的金葡菌感染率有较大差异、分离出的金葡菌对环丙沙星和头孢西丁的耐药率也各不相同,因此应针对不同牛场有效使用药物,避免抗菌药滥用。目前,氯霉素和阿米卡星对中国北方地区分离的金葡菌有较强的抑制性,因此推荐将这些抗菌药作为所检测牛场的金葡菌乳房炎牛治疗药物。
4 奶牛乳源金葡菌的毒素基因及流行类型
4.1 奶牛乳源金葡菌的毒素基因
检测乳源金葡菌的毒素基因有利于分析其毒素及毒性。对A、B、C和D四批次奶样分离到的124株乳源金葡菌进行了毒素基因检测[20-21],其中肠毒素基因检出率达44.4%;未检测出SEE、TSST-1、ETA和ETB基因;编码杀白细胞素的PVL基因检出率最高,平均为70.2%,其在C场奶样金葡菌的检出率达100%。值得注意的是,在A批次分离出的69株金葡菌中,有5株来自临床乳房炎牛奶样的金葡菌含有mecA基因(7.2%),为MRSA菌株,而其他奶样金葡菌未检测出mecA基因(表3)。
表3 A、B、C和D批次奶样金葡菌毒素基因检测结果
Table 3 Detection results of toxic genes ofS.aureusisolated from A,B,C and D milk samples

毒素基因Toxicgenes不同批次金葡菌数(检出率/%)No.ofS.aureus(Detectionrate,%)indifferentbatchA(n=69)B(n=27)C(n=10)D(n=18)总计(n=124)Total(n=124)其他研究OtherresearchesmecA5(7.2)0005(4.0)SEA4(5.8)001(5.6)5(4.0)SEB3(4.3)02(20)05(4.0)SEC02(7.4)04(22.2)6(4.8)SED5(7.2)3(11.1)06(33.3)14(11.3)SEE00000SEG002(20)2(11.1)4(3.2)SEH003(30)6(33.3)9(7.3)SEI001(10)01(0.8)SEJ2(2.9)6(22.2)03(16.7)11(8.9)TSST⁃100000ETA00000ETB00000PVL47(68.1)20(74.1)10(100)10(55.6)87(70.2)[19][30][37][38]
一些金葡菌含有多种毒素基因。其他研究文献用于对比分析本课题组研究结果
SomeS.aureusisolates contain various toxic genes.The other references from other research teams are used for comparing
mecA是葡萄球菌基因组上一段可移动DNA片段(Staphylococcalcassette chromosome mec,SCCmec)上的基因,SCCmec很容易整合到金葡菌基因组上。该SCCmec上的mecA基因在金葡菌中编码青霉素结合蛋白2a,对β-内酰胺类抗生素药产生耐药性[31-32],导致牛场出现较严重的耐甲氧西林金葡菌(methicillin-resistantStaphylococcusaureus,MRSA)。目前已经有大量研究报道了mecA阳性的MRSA菌株[5-7,33],对mecA阴性的MRSA菌也有相关研究报道[34],这些mecA阴性的MRSA主要是因为金葡菌中含有与mecA基因功能相似的mecC基因,从而导致对β-内酰胺类抗菌药的耐药性[35-36]。因此,所有检测到的金葡菌感染牛应及时隔离,尽早检测金葡菌的各类毒素基因和mecA及mecC基因,以确定金葡菌的毒性,避免MRSA感染同群其他牛。
张静等对44株泌乳牛奶样金葡菌和57株临床乳房炎奶样金葡菌进行mecA基因及毒素基因检测,其中6株来自临床乳房炎奶牛的金葡菌检测到mecA基因;此外肠毒素基因检出率达72.2%,高于本课题组的检出率(44.4%);PVL基因在泌乳牛奶样金葡菌中的检出率显著高于乳房炎牛,分别为84.0%和19.3%[30],其中泌乳牛的PVL基因检出率与本课题组结果相近(70.2%)。S.C.Wang等对内蒙古和上海地区的泌乳牛奶样金葡菌进行毒素基因检测,发现63.6%的金葡菌含有一种以上的肠毒素基因[19],高于本课题组的检出率。B.Günaydin等对土耳其牛场的研究发现其奶源金葡菌中存在SEC、SED、SEG、SEI、SEJ和TST基因,其中检出率最高的是SEG和SEI基因[37]。S.I.Salasia等研究发现,印度尼西亚瓜哇岛分离到的奶牛乳源金葡菌主要含有SEB、SEG、SEH和SEI基因,而在德国海赛地区主要含有SEC、SED、SEG、SHE、SEI、SEJ和TST基因,但这两个地区的金葡菌都不含有SEA和SEE基因[38]。
4.2 奶牛乳源金葡菌的流行类型
中国北方地区不同牛场间乳源金葡菌的耐药性和毒素基因种类有所不同,除治疗乳房炎时使用抗菌药种类及剂量不同外,另一个原因是各牛场的金葡菌流行类型有所不同。
脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)是金葡菌基因分型的“黄金标准“,具有较好的分型性、分辨力和重复性,能较好地反映金葡菌类型与流行病学的相关性,现广泛用于确定不同地区金葡菌流行类型,分析金葡菌传染源及不同牛场间的交叉传染可能性[20,22]。
图2显示了中国西北、东北、华北及华东四个地区奶牛乳源金葡菌的主要PFGE分型图谱。可以看出,四个地区金葡菌的PFGE分型有所差别,其中东北地区的黑龙江省和华北地区的北京市之间差异相对较小,西北地区山西省和华东地区的浙江省差异较大。C和D批次奶样来源于黑龙江省的两个牛场,其分离出的金葡菌PFGE分型结果相似性很高[20]。其中黑龙江一(C批次)分离的2株金葡菌和黑龙江二(D批次)分离的8株金葡菌都属于PFGE分型的P3类型[20],说明两场之间的金葡菌可能存在交叉感染现象,该类型金葡菌可能是黑龙江省金葡菌型奶牛乳房炎的流行株(10/28)[20]。今后将对分离出的其余金葡菌进行PFGE分型,以确定所测牛场金葡菌型乳房炎的流行类型,为中国北方地区荷斯坦牛金葡菌乳房炎的防控提供重要数据。
5 防控奶牛感染金葡菌乳房炎的方法展望
金葡菌为环境型传染性病原,为胞内菌,具有强耐药性,加强管理牛场环境及牛体卫生只能治标,防控奶牛感染金葡菌乳房炎的治本方法目前包括:1)研发奶牛金葡菌乳房炎免疫制剂、卵黄抗体、抗菌肽等生物制剂[39-41];2)挖掘和鉴定牛群中带有抗金葡菌乳房炎的主效基因的牛并加以有效利用。
5.1 抗金葡菌乳房炎的生物制剂
免疫制剂、抗菌肽等生物制剂对奶牛金葡菌乳房炎防治具有广阔的应用前景,但是生物制剂尚处于试验研究阶段,而且局限于金葡菌保护性抗原的筛选和鉴定。进一步研究应借助小鼠试验模型,确定金葡菌保护性抗原,进而研制出相应的疫苗[42]。
5.2 抗金葡菌乳房炎的细胞因子及主效基因
同一牛群不同个体的金葡菌乳房炎抗性存在差异,可用于挖掘和鉴定抗金葡菌乳房炎的候选主效基因。L.Jiang等研究发现,IL-6(interleukin 6)、IL-8等基因在炎症和免疫反应通路中富集,其编码的白介素与奶牛乳房炎有关[43]。本课题组前期研究发现,金葡菌阳性牛和阴性牛血清中的IL-17和干扰素γ(interferon-γ,IFN-γ)含量存在显著差异[44]。研究还发现,长期被金葡菌感染乳区的牛奶细胞中的IL-1β基因表达上调[45],IL-8基因的表达则明显减少甚至不表达[46-47]。因此编码这些细胞因子的基因可作为奶牛抗金葡菌乳房炎的候选基因。作者前期在中国荷斯坦牛乳房炎抗性性状的全基因组关联分析(genome-wide association study,GWAS)中发现,14号染色体上与体细胞评分(somatic cell score,SCS)育种值显著关联的SNP(P=1.24×10-10)位于TRAPPC9基因中,该基因AA基因型的SCS育种值极显著高于GG基因型(P<0.001)[48]。董易春在另一个奶牛群体中(n=314)发现相似结果[49],并初步进行了功能验证,该基因与金葡菌乳房炎抗性的关系还需进一步深入研究[44]。

图2 中国部分地区荷斯坦牛乳源金葡菌的PFGE分型结果Fig.2 PFGE patterns of S.aureus strains isolated from milk samples of Chinese Holstein in different regions of China
6 结 论
奶牛金葡菌感染引起的乳房炎具有不易发现,耐药性强,治愈率低,复发率高等特点,尤其以金葡菌隐性乳房炎最为棘手。我国北方地区生产群泌乳牛及临床乳房炎牛奶样的平均金葡菌感染率为11.7%,不同牛场间的金葡菌流行类型不同。鉴于12.8%的生产群泌乳牛也检测到金葡菌,因此应基于SCC测定日记录初步判定隐性乳房炎奶牛[50],再依据相邻两月SCC差值变化[21-23]进一步判断金葡菌感染的隐性乳房炎牛,然后通过金葡菌培养及鉴定,及早判断被金葡菌感染的低SCC隐性乳房炎牛。研制新型生物制剂以及通过分子抗病育种手段鉴定和利用抗金葡菌乳房炎的主效基因是今后提高奶牛乳房健康性状的重要措施[51]。
[1] HALASA T,HUIJPS K,ØSTERAS O,et al.Economic effects of bovine mastitis and mastitis management:a review[J].VetQ,2007,29(1):18-31.
[2] HOGEVEEN H,HUIJPS K,LAM T J.Economic aspects of mastitis:new developments[J].NZVetJ,2011,59(1):16-23.
[3] 张 沅,张 勤,孙东晓.奶牛分子育种技术研究[M].北京:中国农业大学出版社,2012. ZHANG Y,ZHANG Q,SUN D X.Researches on molecular breeding technology in dairy cattle[M].Beijing:China Agricultural University Press,2012.(in Chinese)
[4] GODDEN S M,JANSEN J T,LESLIE K E,et al.The effect of sampling time and sample handing on the detection ofStaphylococcusaureusin milk from quarters with subclinical mastitis[J].CanVetJ,2002,43(1):38-42.
[5] HOLMES M A,ZADOKS R N.Methicillin resistantS.aureusin human and bovine mastitis[J].JMammaryGlandBiolNeoplasia,2011,16(4):373-382.
[6] HARAN K P,GODDEN S M,BOXRUD D,et al.Prevalence and characterization ofStaphylococcusaureus,including methicillin-resistantStaphylococcusaureus,isolated from bulk tank milk from Minnesota dairy farms[J].JClinMicrobiol,2012,50(3):688-695.
[7] KREAUSUKON K,FETSCH A,KRAUSHAAR B,et al.Prevalence,antimicrobial resistance,and molecular characterization of methicillin-resistantStaphylococcusaureusfrom bulk tank milk of dairy herds[J].JDairySci,2012,95(8):4382-4388.
[8] HIRAMATSU K,CUI L,KURODA M,et al.The emergence and evolution of methicillin-resistantStaphylococcusaureus[J].TrendsMicrobiol,2001,9(10):486-493.
[9] DINGES M M,ORWIN P M,SCHLIEVERT P M.Exotoxins ofStaphylococcusaureus[J].ClinMicrobiolRev,2000,13(1):16-34.
[10] MARRACK P,KAPPLER J.The staphylococcal enterotoxins and their relatives[J].Science,1990,248(4956):705-711.
[11] JOHNSON W M,TYLER S D,EWAN E P,et al.Detection of genes for enterotoxins,exfoliative toxins,and toxic shock syndrome toxin1 inStaphylococcusaureusby the polymerase chain reaction[J].JClinMicrobiol,1991,29(3):426-430.
[13] LADHANI S,JOANNOU C L,LOCHRIE D P,et al.Clinical,microbial,and biochemical aspects of the exfoliative toxins causing staphylococcal scalded-skin syndrome[J].ClinMicrobiolRev,1999,12(2):224-242.
[14] SCHLIEVERT P M,SHANDS K N,DAN B B,et al.Identification and characterization of an exotoxin fromStaphylococcusaureusassociated with toxic-shock syndrome[J].JInfectDis,1981,143(4):509-516.
[15] GILLET Y,ISSARTEL B,VANHEMS P et al.Association betweenStaphylococcusaureusstrains carrying gene for Panton-Valentine leukocidin and highly lethal necrotising pneumonia in young immunocompetent patients[J].Lancet,2002,359(9308):753-759.
[16] CAO L T,WU J Q,XIE F,et al.Efficacy of nisin in treatment of clinical mastitis in lactating dairy cows[J].JDairySci,2007,90(8):3980-3985.
[17] LI J P,ZHOU H J,YUAN L,et al.Prevalence,genetic diversity,and antimicrobial susceptibility profiles ofStaphylococcusaureusisolated from bovine mastitis in Zhejiang Province,China[J].JZhejiangUnivSciB,2009,10(10):753-760.
[18] SHI D,HAO Y,ZHANG A,et al.Antimicrobial resistance ofStaphylococcusaureusisolated from bovine mastitis in China[J].TransboundEmergDis,2010,57(4):221-224.
[19] WANG S C,WU C M,XIA S C,et al.Distribution of superantigenic toxin genes inStaphylococcusaureusisolates from milk samples of bovine subclinical mastitis cases in two major diary production regions of China[J].VetMicrobiol,2009,137(3-4):276-281.
[20] 王 新,韦艺媛,张 静,等.乳房炎奶牛金黄色葡萄球菌毒素基因的检测及PFGE分型研究[J].畜牧兽医学报,2011,42(7):974-980. WANG X,WEI Y Y,ZHANG J,et al.Virulence genes and PFGE profiles ofStaphylococcusaureusisolated from cows with subclinical and clinical mastitis[J].ActaVeterinariaetZootechnicaSinica,2011,42(7):974-980.(in Chinese)
[21] WANG X,WANG X,WANG Y,et al.Antimicrobial resistance and toxin gene profiles ofStaphylococcusaureusstrains from Holstein milk[J].LettApplMicrobiol,2014,58(6):527-534.
[22] 王 晓,王 新,王雅春,等.生产群奶牛金黄色葡萄球菌毒素基因检测及PFGE分型研究[J].中国奶牛,2013(4):8-13. WANG X,WANG X,WANG Y C,et al.Toxin genes and PFGE profiles ofStaphylococcusaureusisolated from yielding cows[J].ChinaDairyCattle,2013(4):8-13.(in Chinese)
[23] 安 晶,王 晓,王 新,等.荷斯坦牛乳源金黄色葡萄球菌流行性及其与乳源与总菌群的耐药性分析[J].中国畜牧兽医,2014,41(10):213-218. AN J,WANG X,WANG X,et al.Prevalence and antimicrobial resistance ofStaphylococcusaureusand total coliforms isolated from Holstein milk[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(10):213-218.(in Chinese)
[24] TENHAGEN B A,HANSEN I,REINECKE A,et al.Prevalence of pathogens in milk samples of dairy cows with clinical mastitis and in heifers at first parturition[J].JDairyRes,2009,76(2):179-187.
[25] PIEPERS S,DE MEULEMEESTER L,DE KRUIF A,et al.Prevalence and distribution of mastitis pathogens in subclinically infected dairy cows in Flanders,Belgium[J].JDairyRes,2007,74(4):478-483.
[26] HAFTU R,TADDELE H,GUGSA G,et al.Prevalence,bacterial causes,and antimicrobial susceptibility profile of mastitis isolates from cows in large-scale dairy farms of Northern Ethiopia[J].TropAnimHealthProd,2012,44(7):1765-1771.
[27] BARRETT D J,HEALY A M,LEONARD F C,et al.Prevalence of pathogens causing subclinical mastitis in 15 dairy herds in the Republic of Ireland[J].IrVetJ,2005,58(6):333-337.
[28] Clinical and Laboratory Standards Institute(CLSI).Performance Standards for Antimicrobial Susceptibility Testing 2008[M].Eighteenth Informational Supplement,Document M100-S17.Pennsylvania,USA,2008.
[29] 中国兽药典委员会.中华人民共和国兽药典[M].北京:中国农业出版社,2011. Chinese Veterinary Drug Committee.Veterinary Pharmacopoeia of the People’s Republic of China[M].Beijing:China Agriculture Press,2011.(in Chinese)
[30] 张 静,于三科,王 新,等.原料乳和临床乳房炎金黄色葡萄球菌毒力基因检测及药敏分析[J].中国兽医学报,2012,32(5):759-764,770. ZHANG J,YU S K,WANG X,et al.Characterization of toxin genes and antimicrobial susceptibility ofStaphylococcusaureusisolated from raw milk and milk of clinical mastitis[J].ChineseJournalofVeterinaryScience,2012,32(5) :759-764,770.(in Chinese)
[31] ITO T,OKUMA K,MA X X,et al.Insights on antibiotic resistance ofStaphylococcusaureusfrom its whole genome:genomic island SCC[J].DrugResistUpdate,2003,6(1):41-52.
[32] KATAYAMA Y,ITO T,HIRAMATSU K.A new class of genetic element,Staphylococcuscassette chromosomemec,encodes methicillin resistance inStaphylococcusaureus[J].AntimicrobAgentsChemother,2000,44(6):1549-1555.
[33] FESSLER A T,OLDE RIEKERINK R G,ROTHKAMP A,et al.Characterization of methicillin-resistantStaphylococcusaureusCC398 obtained from humans and animals on dairy farms[J].VetMicrobiol,2012,160(1-2):77-84.
[34] KUMAR R,YADAV B R,SINGH R S.Genetic determinants of antibiotic resistance inStaphylococcusaureusisolates from milk of mastitic crossbred cattle[J].CurrMicrobiol,2010,60(5):379-386.
[36] PETERSEN A,STEGGER M,HELTBERG O,et al.Epidemiology of methicillin-resistantStaphylococcusaureuscarrying the novelmecCgene in Denmark corroborates a zoonotic reservoir with transmission to humans[J].ClinMicrobiolInfect,2013,19(1):E16-E22.
[37] GÜNAYDIN B,ASLANTAS Ö,DEMIR C.Detection of superantigenic toxin genes inStaphylococcusaureusstrains from subclinical bovine mastitis[J].TropAnimHealthProd,2011,43(8):1633-1637.
[38] SALASIA S I,KHUSNAN Z,LAMMLER C,et al.Comparative studies on pheno- and genotypic properties ofStaphylococcusaureusisolated from bovine subclinical mastitis in central Java in Indonesia and Hesse in Germany[J].JVetSci,2004,5(2):103-109.
[39] NOUR E A,SHKRETA L,TALBOT B G,et al.DNA immunization of dairy cows with the clumping factor A ofStaphylococcusaureus[J].Vaccine,2006,24(12):1997-2006.
[40] ZHEN Y H,JIN L J,GUO J,et al.Characterization of specific egg yolk immunoglobulin(IgY) against mastitis-causingEscherichiacoli[J].VetMicrobiol,2008,130(1-2):126-133.
[41] SCHONWETTER B S,STOLZENBERG E D,ZASLOFF M A.Epithelial antibiotics induced at sites of inflammation[J].Science,1995,267(5204):1645-1648.
[42] 樊利军,张梦泽,韦艺媛,等.奶牛金黄色葡萄球菌乳腺炎小鼠模型的建立[J].实验动物科学,2011,28(6):1-6.
FAN L J,ZHANG M Z,WEI Y Y,et al.Establishment of mice models ofStaphylococcusaureusof dairy cows mastitis[J].LaboratoryAnimalScience,2011,28(6):1-6.(in Chinese)
[43] JIANG L,SØRENSEN P,THOMSEN B,et al.Gene prioritization for livestock diseases by data integration[J].PhysiolGenomics,2012,44(5):305-317.
[44] 冯 文.TRAPPC9基因对奶牛金葡菌乳房炎抗性性状的遗传效应分析[D].北京:中国农业大学,2014.
FENG W.Genetic Effect Analysis ofTRAPPC9 toStaphylococcusaureusMastitis Resistance Trait of Dairy Cattle[D].Beijing:China Agricultural University,2014.(in Chinese)
[45] BANNERMAN D D.Pathogen-dependent induction of cytokines and other soluble inflammatory mediators during intramammary infection of dairy cows[J].JAnimSci,2009,87(13 Suppl):10-25.
[46] LEE J W,BANNERMAN D D,PAAPE M J,et al.Characterization of cytokine expression in milk somatic cells during intramammary infections withEscherichiacoliorStaphylococcusaureusby real-time PCR[J].VetRes,2006,37(2):219-229.
[47] TAO W,MALLARD B.Differentially expressed genes associated withStaphylococcusaureusmastitis of Canadian Holstein cows[J].VetImmunolImmunopathol,2007,120(3-4):201-211.
[48] 王 晓.中国荷斯坦牛乳房炎抗性性状的全基因组关联分析[D].北京:中国农业大学,2014.
WANG X.Genome-wide association with mastitis resistance traits in Chinese Holstein cows[D].Beijing:China Agricultural University,2014.(in Chinese)
[49] 董易春.奶牛乳房抗性相关基因TRAPPC9遗传效应分析及功能验证[D].北京:中国农业大学,2014.
DONG Y C.Genetic effect analysis and preliminary function confirmation of anti-mastitis related geneTRAPPC9[D].Beijing:China Agricultural University,2014.(in Chinese)
[50] 马裴裴,俞 英,张 沅,等.中国荷斯坦牛SCC变化规律及其与产奶性状之间的关系[J].畜牧兽医学报,2010,41(12):1529-1535.
MA P P,YU Y,ZHANG Y,et al.The distribution of SCC and its correlation with milk production traits in Chinese Holsteins[J].ActaVeterinariaetZootechnicaSinica,2010,41(12):1529-1535.(in Chinese)
[51] GRIESBECK-ZILCH B,OSMAN M,KÜHN C H,et al.Analysis of key molecules of the innate immune system in mammary epithelial cells isolated from marker-assisted and conventionally selected cattle[J].JDairySci,2009,92(9):4621-4633.
(编辑 白永平)
Infectious Status of Mastitis in Dairy Cattle Induced byStaphylococcusaureusand Its Advances on Epidemiological Patterns and Antimicrobial Resistance in Northern China
WANG Xiao,YU Ying*
(KeyLaboratoryofAnimalGenetics,BreedingandReproduction,MinistryofAgriculture&NationalEngineeringLaboratoryforAnimalBreeding,CollegeofAnimalScienceandTechnology,ChinaAgriculturalUniversity,Beijing100193,China)
Bovine mastitis,especially subclinical mastitis that induced byStaphylococcusaureus(S.aureus),is the most common disease,which is very difficult to prevent and control in dairy industries.In recent five years,our research group has collected 1 112 milk samples from nine dairy farms in Northern China,which included lactating cows with high and low somatic cell counts(SCC) as well as clinical mastitis cows within eleven sampling batches.A total of 191 strains ofS.aureuswere isolated and identified in the detected Northern dairy cattle and the average infectious ratio of mastitis infected byS.aureuswas 11.7%(the lactating cattle was 12.4% and the clinical mastitis cattle was 10.8%).Antimicrobial susceptibility test and toxic genes detection revealed that Chloramphenicol,Amikacin and Cefoperazone had strong inhibitory effects onS.aureusmastitis, the highest detection rate of the toxic genes was panton-valentine leukocidin gene(70.2%).Pulsed-field gel electrophoresis (PFGE) analysis revealed the epidemical patterns ofS.aureusin mastitis cattle in Northern and Eastern China.Combined with the related studies from domestic and foreign countries,the review systematically compared and analyzed the infectious ratio,the antibiotic resistance,the main toxic genes,the epidemical patterns ofS.aureusmastitis.The strategies to prevent and control the incidence ofS.aureusmastitis in dairy cattle were also discussed.
mastitis of dairy cattle;Staphylococcusaureus;antimicrobial resistance;epidemiological pattern
10.11843/j.issn.0366-6964.2015.09.001
2015-01-09
国家自然科学基金(31272420);农业部奶业体系项目(CARS-37-04B);十二五国家科技支持项目(2011BAD28B02);“863”重大项目(2008AA101002);教育部基本科研项目(2011JS006;Z109021306);长江学者与创新团队发展计划(IRT1191)
王 晓(1988-),男,山东即墨人,硕士生,主要从事动物分子数量遗传学研究,E-mail:wangxiao880923@gmail.com
*通信作者:俞 英(1972-),女,云南陆良人,副教授,博导,主要从事动物分子抗病育种及表观遗传调控研究,E-mail:yuying@cau.edu.cn
S857.26;S852.611
A
0366-6964(2015)09-1477-12
