臭氧应激引发气道高反应机理的初步探讨
2013-09-11李喜兵陈秋霞张坚松
李喜兵,陈秋霞,张坚松
(湖南师范大学医学院,湖南 长沙 410006)
近年来由于大气污染加重,慢性阻塞性肺疾病(COPD)、支气管哮喘(哮喘)、支气管扩张、囊性纤维化等慢性炎症性气道疾病在疾病谱中的比重逐渐增高,已经成为全球关注的公共卫生问题。慢性炎症性气道疾病发病时往往会发生AHR,表现为气道对正常不引起或仅引起轻度应答反应的非抗原性刺激物出现过度的气道收缩反应。支气管哮喘是导致AHR 最常见的疾病,哮喘以外的其他呼吸道疾病也可以呈现气道高反应性[1]。
本实验从气道失稳态机制出发,采用O3应激大鼠,建立变异性AHR 大鼠模型,根据O3应激下EOS、IgE、IL-13、IFN-γ 等参数的变化初步探讨臭氧应激引发AHR的机理。
1 材料和方法
1.1 实验动物
健康SPF 级SD 大鼠20 只,全部为雄性,体重为150±10g,购自湖南斯莱克景达实验动物有限公司。
1.2 实验主要试剂
大鼠IFN-γ 检测试剂盒(ADL),IL-13 检测试剂盒(ADL),淋巴细胞分离液(Sigma),RPMI1640培养基(Sigma),生物素化的小鼠抗大鼠IgE 单克隆抗体(Sigma),氯化乙酰胆碱(Ach,Sigma),其他试剂均为国产分析纯级。
1.3 实验主要仪器
动物呼吸机(北京鑫奥成科技有限公司),臭氧发生器(石家庄市蓝电科技开发有限公司),图像采集系统(美国Motic 公司),酶标仪(芬兰雷勃公司),CO2培养箱(美国Thenmo 公司)。
1.4 实验动物分组
20 只SD 大鼠随机分为2组:正常对照组,O3应激组,每组10 只,分笼饲养在清洁、安静、温湿度稳定的环境中,给予充足的饲料和饮水,避免接触其他有害致敏源。正常对照组不做特殊处理。O3应激组大鼠每天上午定时吸入2.0ppm 臭氧与新鲜空气混合气1h,观察并记录O3应激期间实验大鼠的各项生理反应。两组共计饲养4d。
1.5 气道反应性测定
正常对照组和O3应激组饲养第4d 后间隔24h,参照文献[2]介绍方法分别测定各组实验动物的气道反应性。称重后按4mL/kg的剂量腹腔注射25%乌拉坦,麻醉实验动物,仰面平卧固定大鼠,消毒后分离出颈静脉和气管,用静脉留置针行颈静脉穿刺并固定,于第3、4 环状软骨间以V 形剪开气管,行气管插管,接动物呼吸机,呼吸频率为75 次/min,吸呼比为1:1,潮气量为8mL/kg,待实验大鼠呼吸基本平稳后通过颈静脉先后间歇推注生理盐水0.5mL 以 及10~160μg/kg 浓 度 梯 度的Ach 0.5mL,每次间隔大约3min,用动物肺功能分析软件检测基础和用药后的Re,当Re 超过基础值的2倍以上时,就可以停止Ach 推注,通过Re的变化来代表气道反应性的改变[3]。
1.6 血浆IgE 水平检测
测定完气道反应性后,以股动脉放血的方式处死实验大鼠,消毒胸腔部皮肤,在前正中线沿胸骨柄自下而上打开胸腔,无菌条件下从心脏穿刺采血2mL,放入肝素抗凝管,离心后吸取血浆100μL,以酶联免疫吸附-双抗夹心法测定血浆IgE 水平,450nm 波长下以全自动酶标仪测定OD 值,以各自OD 值进行统计学分析。
1.7 BALF中细胞计数、分类
气管插管缓缓插入左肺,固定好后用37℃无菌生理盐水3mL 缓慢注入左肺内,轻轻按摩膨大的左肺,然后缓慢回抽BALF,再将所得液体重新缓慢注入左肺内,反复3 次,最后一次注入后回收BALF,置于冰浴保存的离心管中。然后重复4 次上述操作。准确计量回收的BALF 体积,在4℃下以1500r/min 离心20min,上清液-20℃冷冻保存用于检测总蛋白水平。细胞沉淀用溶红细胞液悬浮,4℃下以1500r/min 离心10min,弃上清,再次用生理盐水悬浮细胞沉淀,光学显微镜下进行细胞计数。将细胞悬浮液涂片后进行Wright-Giemsa 染色,镜下细胞计数并分类。
1.8 支气管肺泡灌洗液总蛋白水平测量
冷冻保存的支气管肺泡灌洗液解冻后作为待测样品,加入考马斯亮蓝G-250 试剂5mL,静置5min 后,在可见光分光光度计上比色,测定波长为595nm,参考标准曲线得出样品蛋白质含量[4],每个待测样品均进行3 次重复测量,取其平均值作为此实验大鼠BALF的总蛋白含量。
1.9 肺组织病理变化
在无菌条件下取部分未经肺泡灌洗的肺组织,按以下顺序进行病理切片染色:4%多聚甲醛溶液固定24h,梯度乙醇常规脱水,石蜡包埋,切片,厚度为4μm。脱蜡后在室温下常规HE 染色,于普通光学显微镜下观察肺组织形态结构。
1.10 PBMC 制备培养及培养上清IL-13、IFN-γ水平测定
取100μL 血浆测定IgE 后剩余部分以等量Hank's 液稀释,离心管中加入淋巴细胞分层液后,小心沿着管壁加入稀释血清,2000r/min 密度梯度离心20min,用毛细吸管小心吸出分层液上方呈现白膜状的PBMC,经多次洗涤悬浮后用含10%小牛血清的RPMI 1640 培养基调细胞浓度到1×106/mL,置37℃、5%CO2孵箱饱和湿度条件下培养48h,以1000r/min 离心15 分钟收集上清液,以酶联免疫吸附法(ELISA)检测培养上清中的细胞因子IFN-γ和IL-13。加入终止反应液后的30 分钟内在全自动酶标仪上以450nm 波长读取各孔的OD值。以各自OD 值作统计学分析。
1.11 统计学分析
实验结果以均数±标准差表示,用SPSS 11.0统计分析软件进行两样本t 检验,P<0.05 判定为有统计学意义。
2 结果
2.1 气道反应性改变
两组实验大鼠的基础Re 差别不大,给与生理盐水激发后的Re 也相差不大,都没有统计学意义(P>0.05);而给与10~40μg/kg 梯度的Ach 激发后,O3应激组Re 与正常对照组比较O3应激组Re 普遍升高,有统计学意义(P<0.05);给与80~160μg/kg梯度的Ach 激发后,O3应激组Re 与正常对照组比较存在显著差别(P<0.01),O3应激组Re 明显升高。结果见表1。
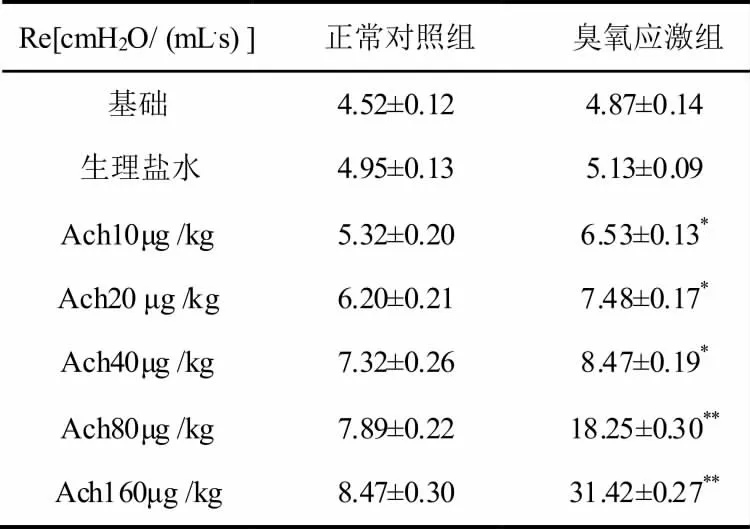
表1 各组大鼠Re的比较(n=10)
2.2 肺泡灌洗液中细胞计数、分类,总蛋白含量改变
2.2.1 肺泡灌洗液中总蛋白含量变化
O3应激组与正常对照组比较,O3应激组肺泡灌洗液中总蛋白含量明显增加(P<0.01),结果见表2。
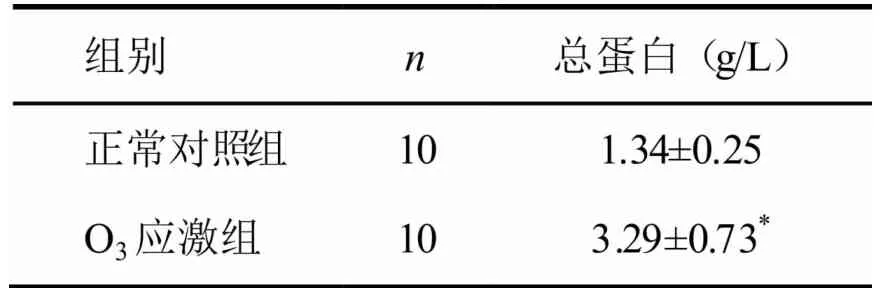
表2 BALF中总蛋白含量的比较(n=10)
2.2.2 肺泡灌洗液中细胞总数及分类计数的变化
O3应激组与正常对照组比较,O3应激组肺泡灌洗液中细胞总数明显增加(P<0.01)。光学显微镜下计数200 个细胞,进行细胞分类。O3应激组和正常对照组比较:淋巴细胞、嗜酸性粒细胞、中性粒细胞、单核细胞均可见O3应激组明显高于正常对照组(P<0.01);嗜碱性粒细胞升高不明显,无统计学意义(P>0.05)。实验结果见表3。
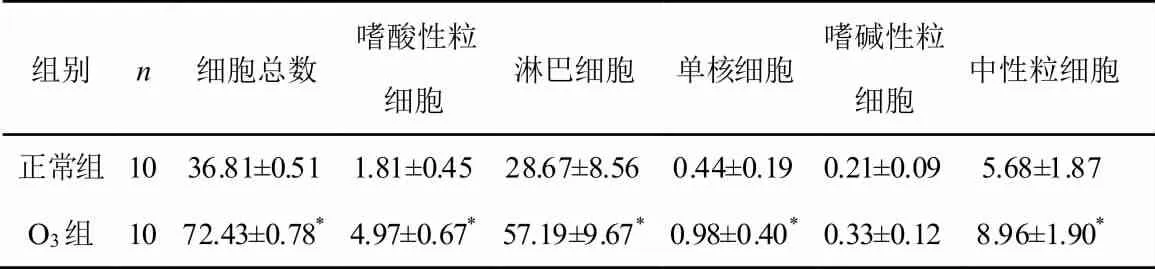
表3 各组肺泡灌洗液中细胞计数、分类
2.3 肺组织病理变化
正常对照组肺间质结构正常,肺泡形态大小正常,未发现炎性细胞浸润现象。细支气管壁形状规则,管腔无狭窄;O3应激组肺间质明显增生,正常形态肺泡减少,常见到多个肺泡融合成肺大泡现象,炎性细胞浸润明显。HE 染色镜下结果见图1。
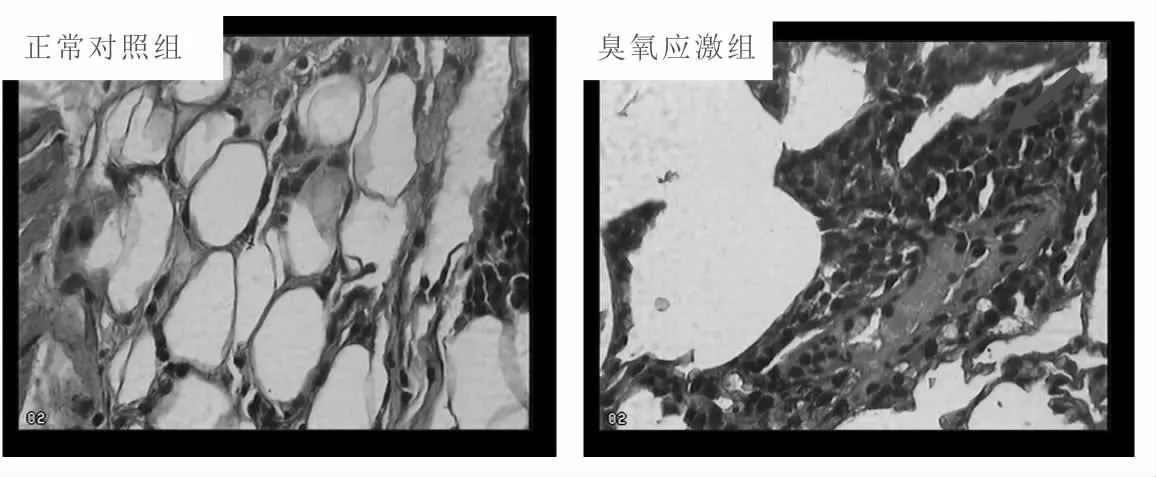
图1 各组肺组织石蜡切片HE 染色(HE×400)
正常对照组:肺泡形态大小正常,肺间质无炎细胞浸润及粘液渗出,细支气管管壁形态规则,管腔无狭窄;O3应激组:肺间质明显增生,正常形态肺泡减少,常见到多个肺泡融合成肺大泡现象,炎性细胞浸润明显。
2.4 PBMC 培养上清中IL-13、IFN-γ 及血浆IgE抗体水平变化
O3应激组与正常对照组比较O3应激组IL-13、IFN-γ 及血浆Ig E 水平均明显增加(P<0.01),结果见表4。
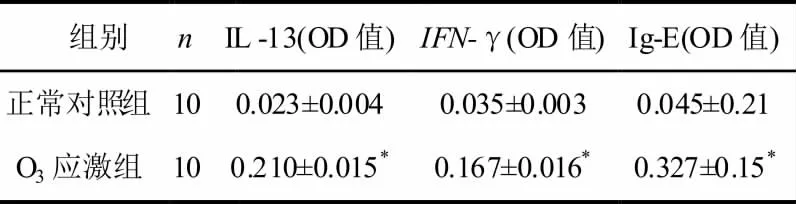
表4 PBMC 培养上清IL-13、IFN-γ 及血浆Ig E 水平的比较(n=10)
3 讨论
AHR 相关疾病的病因复杂,直接进行人体实验困难很大,因此动物实验成为了研究相关疾病发病机制、查找病因、对治疗方法和治疗药物进行评价等方面的首选。然而动物模型品种繁多,使用AHR 动物模型进行实验时应该根据实验的目的选择相对应的动物模型,使其尽量接近人类疾病。SD大鼠具有品系纯、繁殖快、价格低、来源广、标本收集量大等特点,而且人的生物学特点与其有很多的相似性[5],所以SD 大鼠成为了本研究建立AHR 动物模型的首选。
传统的AHR 大鼠模型的建立一般是采取OVA 致敏建立哮喘大鼠模型的方法[6],这种方法存在建模周期长的缺点,而且一般更多的是针对哮喘而言的,在AHR 方面的研究,气道粘膜本身的防护作用容易被人所忽视[7]。有研究表明AHR 疾病是由多种细胞(如嗜酸性粒细胞、肥大细胞、T 细胞、中性粒细胞、气道上皮细胞等)和细胞组分参与的气道慢性炎症性疾病。气道高反应性和气道慢性炎症是支气管哮喘重要的病理生理学特点[8]。呼吸道上皮细胞代谢和分泌功能都很活跃,能够和周边的组织细胞实现相互的细胞间信息传递;一方面可以调节周边组织细胞及局部微环境,同时也可以因局部微环境的各种信号改变而发生适应性改变[9-10]。有理由认为:呼吸道上皮的结构破坏及功能失调,有可能是AHR的原发原因。
本研究建立的模型采用O3应激大鼠,同正常对照组大鼠模型进行比较发现,气道反应性,BLAF中细胞计数、分类,血浆IgE 水平等各项指标均升高;肺组织病理切片显示肺间质明显增生,正常形态肺泡减少,常见到多个肺泡融合成肺大泡现象,炎性细胞浸润明显。以上指标均证实了AHR的存在,建模成功。通过O3应激建立AHR 模型,时间短,成本低,操作简单可靠,相关实验试剂多,参考价值高,为AHR 疾病的研究提供了新的思路。
有文献[11-12]报道大多数传统的通过OVA 致敏建造的AHR 大鼠模型会有呼吸急促;呼吸节律不规则;口唇发绀;行动迟缓;四肢瘫痪;大小便失禁等表现,单纯以这样主观认知的生理现象来判断造模是否成功不太可取,没有反应AHR的实质性数据。本实验通过臭氧应激建造的AHR 大鼠模型有呼吸加快、烦躁不安、立毛等症状,但上述报道的其它症状很少出现,同既往报道比较存在差异。
传统OVA 致敏引发哮喘的研究认为:体液免疫途径是引发AHR 发生的关键原因。在哮喘发生前CD4+T 细胞可分化为Thl和Th2 类细胞且保持平衡,随着哮喘的发生发展,Th1/Th2的平衡会被打破,Th2 细胞会逐渐占据主要地位,细胞功能亢进,释放Th2 类细胞因子,引起体液免疫的发生。但也有研究发表了不同的观点:如RomyFischer 等人在2007年发表文章指出IFN-γ/IL-18和IFN-γ 诱导蛋白参与了过敏性哮喘的发病,而诱导Thl 类免疫反应的IL-12 可能促进而非抑制IgE的生成及Th2类免疫反应,所以他们认为,Thl 类和Th2 类细胞因子可能同时参与了嗜酸粒细胞炎症及噬中性粒细胞炎症的产生[13]。IFN-γ 是Th l 类细胞典型的细胞因子,本实验O3应激组大鼠IFN-γ 较正常对照组明显升高,提示Th1 类细胞因子参与了AHR 发生的相关病理过程,激活和促进了细胞免疫途径;IL-13 是一类由Th2 类细胞产生的能广泛参与抗原提呈及炎性反应的细胞因子,可促进B 细胞成熟和分化,从而释放出针对特异致敏原的IgE,促进体液免疫途径。本实验结果表明,O3应激组大鼠IL -13和血清IgE 均较正常对照组明显升高,提示了Th2细胞功能亢进,大量释放Th2 类细胞因子,促进B细胞成熟分泌IgE。同时本实验BALF 细胞计数、分类以及肺组织切片均显示嗜酸性粒细胞(EOS)明显升高,提示O3应激可导致以EOS 浸润为主的炎症反应。综合以上分析,可以认为O3应激引发气道高反应,其机制可能与Th1 及Th2 类免疫反应同时激活EOS 炎症反应有关。
[1]张健刚,何小林,金辉.气道高反应性疾病的病因分布及气道反应特征比较 [J].现代实用医学,2009,21(10):1091-1092.
[2]Sagai M,Furuyama A,Ichinose T.Biological effects of diesel exhaust particles (DEP) [J].Free Radic Biol Med,1996,21(2):199-209.
[3]Makela MJ,Kanehiro A,Borish L,et al.IL-10 is necessary for the expression of airway hyperresponsiveness but not pulmonary inflammation after allergic sensitization [J].Proc Acad Sci USA,2000,97(11):6007-6012.
[4]Yoon JH,Kim KS,Kim HU,et al.Effects of TNF-alpha and IL-1 beta on mucin,lysozyme [J].Acta Otolaryngol,1999,119(8):905-910.
[5]Karol MH.Animal modeis of occupational asthma [J].Eur Respir J,1994,7(3):555.
[6]Takeyama,K.,K.Dabbagh,H.M.Lee,et al.Epidermal growth factor system reg -ulates mucin production in airways [J].Proc Natl Acad Sci USA,1999,96 (6):3081-3086.
[7]李翔,王笑梅,张坚松.两种气道高反应大鼠膜型的建立与比较[J].湖南师范大学学报(医学版),2009,6(1):17-22.
[8]Sugita M,uribayashi K,Nakagomi T,et al.Allergic bronchial asthma:airway inflammation and hyperresponsiveness [J].Intern Med,2003,42 (8):636-643.
[9]熊本强,李翔,李喜兵,等.水通道蛋白1 对气道高反应大鼠粘液高分泌的影响[J].湖南师范大学学报(医学版),2012,9(1):6-10.
[10]Li Y,Martin LD,Spizz G,et al.MARCKS protein is a key molecule regulating mucin secretion by human airway epithelial cells in vitro [J].Biol Chem,2001,276(44):40982-40990.
[11]殷晓峰,冯玉麟,刘春涛.过敏性哮喘大鼠大脑和肺组织c-fos 蛋白的表达[J].中华结核和呼吸杂志,2001,24(8):469-471.
[12]樊卫文,杨志军,孙 滨,等.大鼠支气管哮喘模型气道重构的研究[J].四川医学,2002,23(5) :498-498.
[13]Fiseher R,Tome D,MeGhee JR,et al.Thl and Th2 cells are required for both eosinoPhiland neutrophil-assoeiated airway inflammatory responses in mice [J].Biochemical and BioPhysical Researeh Communications,2007,357:44-49.
