云南省狂犬病毒G基因和G-L间隔区基因序列差异性分析
2013-08-30万国辉赵焕云张文东蒲晓琼胡挺松胡媛媛张应国范泉水张富强
万国辉,赵焕云,张文东,蒲晓琼,胡挺松,胡媛媛,邱 薇,郑 颖,张应国,范泉水*,张富强*
(1.云南省动物疫病预防控制中心,云南昆明 650051;2.成都军区疾病预防控制中心,云南昆明 650032;3.云南农业大学,云南昆明 650201;4.云南农业职业技术学院,云南昆明 650031)
狂犬病毒(Rabies virus,RV)属于弹状病毒科(Rhabdoviridae)狂犬病毒属(Lyssavirus)成员,病毒基因组为不分节段的单股负链RNA,长约12 kb,包含3'端引导序列,5种结构蛋白基因编码序列,依次为核蛋白(N)、磷蛋白(P或M 1)、基质蛋白(M或M 2)、糖蛋白(G)、依赖RNA的RNA聚合酶或大蛋白(L)基因,及G-L间隔区或伪基因(ψ)和5'末端序列。糖蛋白、尾随序列(Trailer sequence)、聚合酶、G-L间隔区决定了RV的神经侵袭力[1]。G是一种跨膜蛋白,其镶嵌于病毒粒子表面形成棘状突起,既是诱导保护性免疫应答的主要抗原,又介导了病毒吸附、侵入及装配、释放过程。G蛋白承受宿主免疫选择压力,呈现高变异性[2-3]。G-L间隔区或ψ基因为非编码区,不受病毒蛋白结构与功能的限制及宿主免疫压力选择,呈现随机突变,是病毒自然进化过程中的中性标志区。G基因和G-L间隔区携带了病毒遗传差异性信息[2-4]。本研究对云南省2006年~2011年期间不同地州RV G基因和G-L间隔区核酸序列进行比对和系统发育分析,为了解RV的遗传相关性和差异性提供了依据。
1 材料和方法
1.1 样品、菌种与质粒 野外样品为2006年~2011年期间在云南省采集的疑似狂犬病犬脑组织或唾液棉拭子样品,经本实验室建立的RV特异性RT-PCR和套式PCR检测为阳性[5],野外样品采集时间、地点、种类见表1;大肠杆菌DH5α感受态细胞,由本实验室制备、保存;pMD18-T Vector购自宝生物工程(大连)有限公司。
1.2 主要试剂 病毒RNA/DNA提取试剂盒(Body Fluid Viral DNA/RNA miniprep Kit)购自 Axygen公司;RNA酶抑制剂、DL2000 Marker、TaKaRa One Step RNA PCR Kit(AMV)、Prem ixTaqDNA聚合酶、DH5α感受态快速制备试剂盒购自宝生物工程(大连)有限公司;DNA凝胶胶回收试剂盒、小量柱式质粒纯化试剂盒购自上海华舜生物工程有限公司。
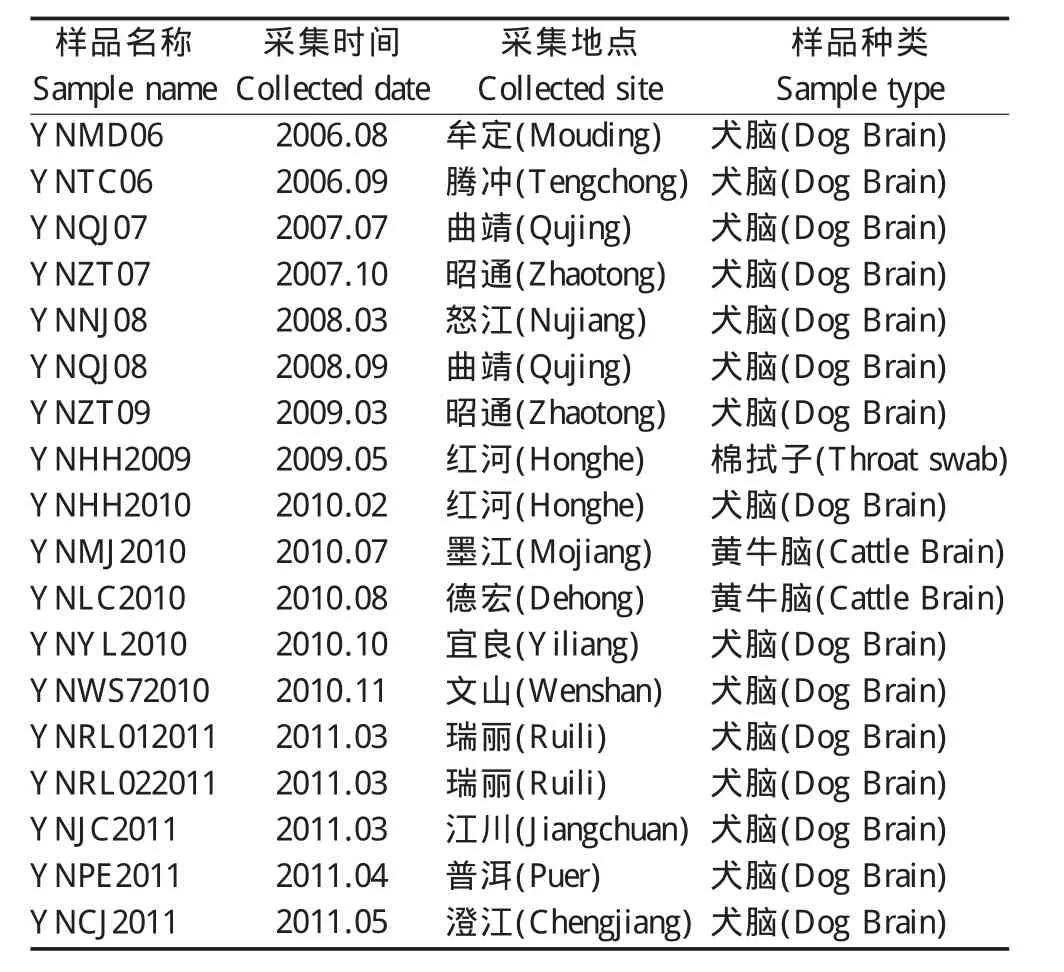
表1 野外阳性样品一览表Table 1 List of positive field samples
1.3 核酸提取 采用病毒RNA/DNA提取试剂盒,参照操作手册,提取阳性组织样品、棉拭子样品中的总RNA,加RNA酶抑制剂后进行RT-PCR反应或-80℃保存备用。
1.4 G基因和G-L间隔区的扩增、纯化、克隆、测序 采用本课题组已建立的方法和参照文献[6-8],从阳性样品总RNA中扩增病毒G基因和G-L间隔区,PCR产物经凝胶纯化后克隆至pMD18-T载体,鉴定后提取阳性重组质粒,由北京三博科技有限公司测序。
1.5 序列比对、同源性及系统发育分析 采用DNAMAN Version 5.2.2软分子生物学软件进行序列比对、同源性及系统发育分析(参考毒株见表2)。
2 结 果
2.1 病毒G基因系统发育分析 病毒基因序列比对及系统发育分析中引用的参考病毒株见表2。除2006年腾冲(YNTC06)、2011年瑞丽(YNRL022011)属于Thailand遗传谱系,与泰国毒株遗传关系密切外,其余云南病毒样品均属于ChinaⅠ。ChinaⅠ可以进一步划分为3个遗传亚谱系(ChinaⅠ-1~ChinaⅠ-3),其中ChinaⅠ-1包含部分2007年(YNZT07)及所有2010、2011年病毒阳性样品,涉及普洱、玉溪、临沧、红河、德宏、文山、昭通、昆明共8个地州,与2004年安徽株(AHFY1)遗传关系密切;ChinaⅠ-2包含部分2007年(YNQJ07)及所有2008、2009年病毒阳性样品,涉及红河、怒江、昭通、普洱、曲靖4个地州,与2004年贵州(GZQx5)、2007年广西(GXY166)株遗传关系密切;ChinaⅠ-3中云南仅有2006年牟定(YNMD06)病毒样品,与2006年上海(SH06),2008年浙江(D02)、福建(FJ008)株遗传关系密切(图1)。
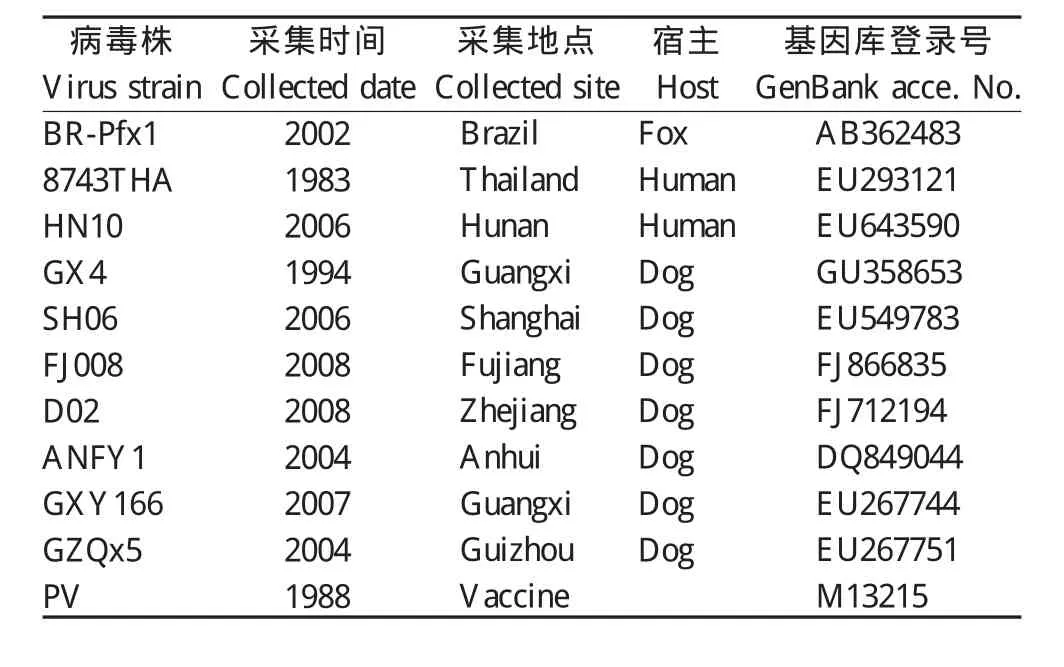
表2 RN参考病毒株Table 2 List of reference strains of rabies virus used in this study

图1 RV G基因系统发育分析Fig.1 Phylogenetic analysis of the G gene of rabies virus
2.2 病毒G-L间隔区系统发育分析 除2010年宜良(YNYL2010)、2007年曲靖(YNQJ07)、2011年瑞丽(YNRL022011)3个样品外,其余云南样品及参考病毒株G基因和G-L间隔区系统发育分析结果一致。在G基因系统发育分析中YNYL2010、YNQJ07、YNRL022011分别属于遗传亚谱系ChinaⅠ-1、ChinaⅠ-2、Thailand,而在G-L间隔区分析中,则分别位于ChinaⅠ-2、ChinaⅠ-3、ChinaⅠ-1(图2)。
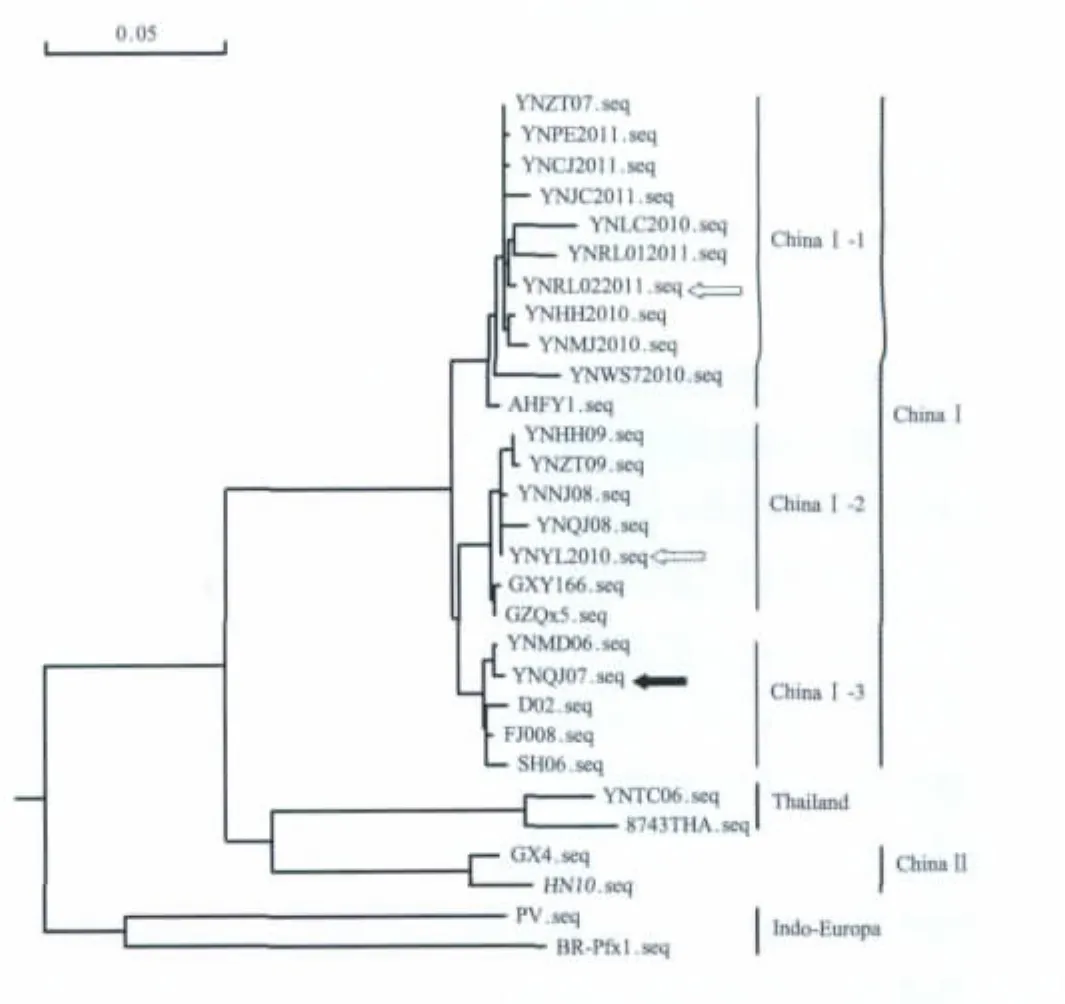
图2 RV G-L间隔区系统发育分析Fig.2 Phylogenetic analysis of the G-L intergenic region of rabies virus
2.3 病毒G基因和G-L间隔区核苷酸序列比对及同源性分析 G基因核苷酸序列比对表明,同一遗传谱系病毒株核苷酸同源性介于94.3%~99.4%,不同遗传谱系间病毒株同源性介于83.4%~88.3%。除YNYL2010、YNQJ07、YNRL022011外,同一遗传谱系病毒株G-L间隔区核苷酸同源性介于95.6%~99.6%,不同遗传谱系间病毒株同源性介于71.8%~85.5%。YNYL2010与ChinaⅠ-1、ChinaⅠ-2 G基因和G-L间隔区同源性分别介于98.7%~99.0%、97.9%~98.6%及95.7%~97.7%、97.3%~99.4%;YNQJ07与ChinaⅠ-2、ChinaⅠ-3 G基因和G-L间隔区同源性分别介于98.9%~99.6%、98.3%及96.5%~97.3%、98.6%~99.6%;YNRL022011与Thailand、ChinaⅠ-1 G基因和G-L间隔区同源性分别介于94.3%~97.8%、86.2%~86.8%及80.7%~81.2%、96.7%~99.4%。序列同源性比对结果与系统发育分析结果吻合。
3 讨 论
RV血清Ⅰ型和基因Ⅰ型病毒株存在两个主要进化分支(欧亚分支和美洲分支),其中欧亚分支可以划分为两个亚分支(中国-泰国亚分支和欧洲-印度亚分支),中国-泰国亚分支进一步划分为3个遗传谱系(ChinaⅠ、ChinaⅡ、Thailand)[2-4]。基于病毒G基因和G-L间隔区系统发育分析结果,云南RV属于欧亚分支中国-泰国亚分支ChinaⅠ和Thailand遗传谱系,分别与国内及东南亚RV遗传关系密切,结果提示云南省RV存在国内和国外(东南亚)两个来源或流向。
研究表明云南省RV的分布无明显的地域性,如在德宏瑞丽存在ChinaⅠ-1、Thailand(基于G基因分析结果)或ChinaⅠ-1、ChinaⅠ-2(基于G-L间隔区分析结果)两个遗传(亚)谱系,昭通存在ChinaⅠ-1、ChinaⅠ-2两个遗传亚谱系,曲靖存在ChinaⅠ-2、ChinaⅠ-3(基于G-L间隔区分析结果) 两个遗传亚谱系。但其分布与时间具有一定相关性,2006年 ChinaⅠ-3,2006年~2009年 ChinaⅠ-2,2007年、2010年~2011年ChinaⅠ-1。ChinaⅠ-1已成为云南省当前RV流行的优势遗传亚谱系。
通常基于N基因、G基因系统发育树进行RV进化分析[9-12],而采用G-L间隔区序列的文献较少[2,13]。G-L间隔区与G基因一样,是决定病毒神经侵袭力的主要组份,并且其不受宿主免疫压力选择,属于病毒进化过程中的中性标志区,推测其应该携带与G基因不同的病毒遗传信息。而据目前所查阅的文献,G基因与G-L间隔区系统发育分析结果一致[2,13-14],本研究表明 3个样品(YNYL2010、YNQJ07、YNRL022011)G基因与G-L间隔区系统发育分析结果存在明显差异,结果提示RV基因组不同阶段存在基因重组,其所引起病毒生物学特性的改变有待进一步研究。
本文通过开展云南省RV G基因和G-L间隔区分子流行病学研究,不仅在了解RV的流行规律和分布特点以及揭示病毒毒力和抗原变异的分子基础方面具有重要意义,而且也将为云南省狂犬病的有效预防控制提供科学依据。
[1]Faber M,Pulmanausahakul R,Nagao K,et al.Identification of viral genom ic elements responsible for rabies virus neuroinvasiveness[J].PNAS,2004,46(101):16328-16332.
[2]M ing P G,Du J,Tang Q,et al.Molecular characterization of the complete genome of a street rabies virus isolated in China[J].Virus Res,2009,143:6-14.
[3]Carnieli P Jr,Castilho JG,FahlW de O,et al.Molecular characterization of rabies virus isolates from dogs and crab-eating foxes in Northeastern Brazil[J].Virus Res,2009,141:81-89.
[4]Meng Sheng-li,Xu Ge-lin,Yan Jia-xin,et al.Molecular epidem iology and sequencing of the G-L intergenic region of rabies viruses isolated in China[J].Virol Sin,2007,22(1):26-33.
[5]赵焕云,张文东,金卫华,等.云南牟定狂犬病诊断及病毒部分N基因测序[J].畜牧与兽医,2007,39(11):56-59.
[6]张文东,赵焕云,吕粤,等.云南省2006-2010年狂犬病病毒N和G基因分子结构特征分析[J].中国人兽共患病学报,2011,27(10):871-876.
[7]赵焕云,张文东,金卫华,等.云南4株狂犬病毒N和G基因的克隆及测序[J].中国卫生检验杂志,2008,03:413-419.
[8]赵焕云,金卫华,张文东,等.云南牟定狂犬病病毒株N基因和G基因序列分析[J].中国预防兽医学报,2008,30(04):318-325.
[9]熊毅,罗廷荣,刘棋,等.广西狂犬病野毒株N基因的测序与分析[J].中国传染病杂志,2007,25(3):147-151.
[10]熊毅,罗廷荣,刘棋,等.广西12株狂犬病野毒株的G基因序列测定与分析[J].中国病毒学,2006,21(2):131-135.
[11]徐葛林,Li ku,吴杰,等.中国19个狂犬病病毒街毒分离株N基因的序列分析[J].病毒学报,2002,18(1):48-51.
[12]Meng Sheng-li,Jia Xin-yan,Xu Ge-lin,et al.A molecular epidemiological study targeting the glycoprotein gene of rabies virus isolates from China[J].Virus Res,2007,124:125-138.
[13]Carnieli P Jr,Fahl W deO,Brandao P E,et al.Comparative an alysis of rabies virus isolates from Brazilian canids and bats based on the G gene and G-L intergenic region[J].Arch Virol,2010,155:941-948.
[14]Matsumoto T,Ahmed K,W imalaratne O,et al.Whole-genome analysis of a human rabies virus from Sri Lanka[J].Arch Virol,2011,156:659-669.
