紫外线与N+注入复合诱变选育曲酸高产菌株
2013-08-07姚建铭
凌 帅,刘 咏,*,姚建铭,李 俊
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.中国科学院合肥物质科学研究院,安徽 合肥 230031)
曲酸是一种重要的有机酸,广泛应用于化妆品[1]、食品加工、医药、农业[2]等领域。特别是在食品加工领域,由于其安全无毒,作为理想的多酚氧化酶抑制剂[3],最具应用前景。据统计,曲酸国际市场需求量在500~600t/a,国内市场估计在2a内需求可达40~50t。国内外需求量的增加,势必给曲酸的研究带来更大的动力。目前曲酸的生产以微生物的发酵为主,为了能够满足国内外的需求,提高发酵菌种的产酸量将会是研究的重点,很多学者致力于提高曲酸产量的研究已经取得了不少成果。例如李凤玲等[4]采用单因子的紫外诱变对米曲霉NKS-145进行诱变,曲酸产量最高为8g/L;李一婧等[5]采用紫外线对米曲霉2337进行多次的重复诱变,曲酸最终产量最高为18.13g/L。可以看出传统的诱变方法不能达到理想的效果。
离子注入技术是集化学诱变、物理诱变为一体的综合诱变方法,可使遗传物质在基因水平或分子水平上发生改变或缺失,显著提高生物的变异率,获得损伤轻、突变率高、突变谱广、遗传稳定的诱变效果[6-7]。已被广泛地应用于农作物、微生物育种和转基因[8-10],在微生物育种方面,已经应用于枯草杆菌[11]、α-淀粉酶生产菌[12]、柠檬酸[13]生产菌等诸多菌种的诱变,并且均获得了理想的诱变效果。本实验以安徽科聚环保新能源有限公司实验室原有米曲霉菌株为出发菌株,以紫外诱变和氮离子注入诱变的复合诱变选育,筛选出产曲酸水平高的菌种。
1 材料与方法
1.1 菌种
沪酿3.042、渝3.811、AS3.866、CICC-2336、CICC-2337共5种米曲霉菌种,由安徽科聚环保新能源有限公司实验室提供。
1.2 培养基与培养方法
斜面PDA培养基(g/L):马铃薯200、蔗糖20、琼脂20,pH值自然;30℃恒温培养72h。
种子培养基(g/L):葡萄糖100、玉米粉20、酵母膏10、KH2PO45、MgSO4·7H2O 2.5,pH值自然;250mL三角瓶装种子培养基50mL,接一环菌种孢子于培养基中,30℃恒温,摇床180r/min培养24h,作为一级种子。
发酵培养基(g/L):葡萄糖100、酵母膏2.5、K2HPO41、KCl 0.5、MgSO4·7H2O 0.5,pH值自然;500mL三角瓶装发酵培养基85mL,吸取15mL一级种子液,即接种量为15%,30℃恒温,摇床180r/min培养7d。
筛选培养基:发酵培养基+20g/L琼脂+0.5g/L曲拉通+10g/L FeCl3-HCl显色剂,pH值自然;30℃恒温培养72h。
1.3 出发菌株的筛选
选择本实验室现有产曲酸的5个菌种:沪酿3.042、渝3.811、AS3.866、CICC-2336、CICC-2337,利用Fe3+与曲酸络合反应可生成红色物质的特性,摇瓶发酵,取发酵上清液采用三氯化铁比色法选出曲酸产量最高的菌株,作为实验的出发菌株。
1.4 菌种诱变
1.4.1 诱变的流程

1.4.2 孢子悬浮液的制备[14]
取新鲜的斜面菌种,用加入0.5g/L曲拉通的无菌水洗下,经过玻璃珠打散,制备成含孢子1×106个/mL悬浮液。放入培养箱中30℃萌发12h。
1.4.3 UV诱变[15-16]
各取5mL萌发12h后的米曲霉2336孢子悬浮液于6块无菌培养皿中,将其中5块放入带有磁力搅拌器的暗箱中,15W、30cm振荡进行紫外照射,分别照射20、40、60、80、100s,未经过紫外照射的培养皿作为对照。照射完后将所有培养皿放入黑暗处2h。
1.4.4 亚硝酸盐诱变
分别取萌发12h的UV7孢子悬浮液1mL、pH4.5醋酸缓冲液2mL以及0.1mol/L亚硝酸钠溶液1mL于4支无菌试管中,于25~26℃分别保温5、10、15、20min,再加入0.07mol/L pH8.6的磷酸氢二钠溶液20mL终止反应。以加入UV7孢子悬浮液1mL和23mL无菌水的试管为对照。
1.4.5 氮离子注入诱变[17-18]
各取0.1mL萌发12h后的UV7孢子悬浮液,均匀涂布于6块无菌培养皿中,培养皿置于超净工作台上,待无菌风将平板表面的水迹吹干后对其中5块板进行注入。离子注入机是由中国科学研究院离子束生物工程重点实验室研究制备的。在注入机上,以10keV的注入能量分别对孢子液进行5×1014、10×1014、15×1014、20×1014、25×1014ions/(cm2·s)不同剂量的注入;注入靶室的真空度为10-3Pa。将以同样方法涂布吹干后但未经过离子注入的样品作为对照。注入完成后立即在超净工作台上用新鲜无菌水洗脱所有培养皿上的孢子。
1.4.6 高产菌株的筛选
初筛:取经过诱变处理后的孢子液,适当稀释后涂布于筛选显色板上,放入培养箱中30℃黑暗培养,3d后进行观察,挑选出最先出现红色与红色较深的单菌落,保存于斜面培养基上;复筛:取经过初筛选出的斜面菌种,接入发酵培养基中,30℃、摇床180r/min发酵培养7d后,采用三氯化铁比色法测定发酵上清液曲酸含量,与对照菌株的曲酸产量相比,进行复筛。
1.5 菌种生长曲线的测定
从发酵第2天开始,每天取发酵液100mL,4500r/min离心,上清液采用三氯化铁比色法测定曲酸含量,菌丝体105℃烘干至质量恒定,测定生物量。连续取样至发酵第10天。
1.6 突变菌株传代实验
为了确定经过复合诱变而得到的高产菌株产酸能力是否稳定。对经过不同复合诱变得到的菌种进行传代产酸性能实验。经过一级种子液,接入发酵培养基,按照15%接种量,30℃恒温,摇床180r/min的发酵条件培养7d后测定发酵上清液中曲酸含量。每次传代发酵都做平行实验。
1.7 指标测定
曲酸含量的测定:三氯化铁比色法[19]。
2 结果与分析
2.1 出发菌株的筛选
对沪酿3.042、渝3.811、AS3.866、CICC-2336、CICC-2337这5株菌种进行筛选,结果显示CICC-2336与Fe3+反应产生的颜色最深,并且采用三氯化铁比色法测出的曲酸含量也是最高。最终选择出CICC-2336为实验出发菌株,原始产酸量为12g/L,结果见图1。

图 1 出发菌株选育结果Fig.1 Screening of starting strain for mutation breeding
2.2 诱变结果与分析
2.2.1 显色筛选板
根据曲酸与Fe3+发生螯合反应,产生红色物质的原理。由图2可知,3d后对筛选板上的单菌落进行筛选,挑选出最先出现红色与红色较深的单菌落保存于斜面培养基上。
图 2 培养3d后的显色板Fig.2 Colony formation after 3 days of culture on chromogenic medium
2.2.2 紫外(UV)诱变存活率及选育结果

图 3 UV诱变存活率曲线Fig.3 Survival rate of Aspergillus oryzae CICC-2336 after exposure to UV
由图3可知,随着照射时间的增加,菌株的存活率逐渐下降,照射时间为100s时,菌株几乎无存活,这样将很难选育到优良的菌株。一般采用存活率在20%左右的诱变剂量。因此,最适的诱变剂量为距离15W紫外灯30cm处照射40s,此时的存活率为21.02%。图4显示,经过摇瓶复筛选育出一株编号UV7的突变菌株,其产酸量为18.50g/L。与原始菌株2336相比产酸量提高54.17%。
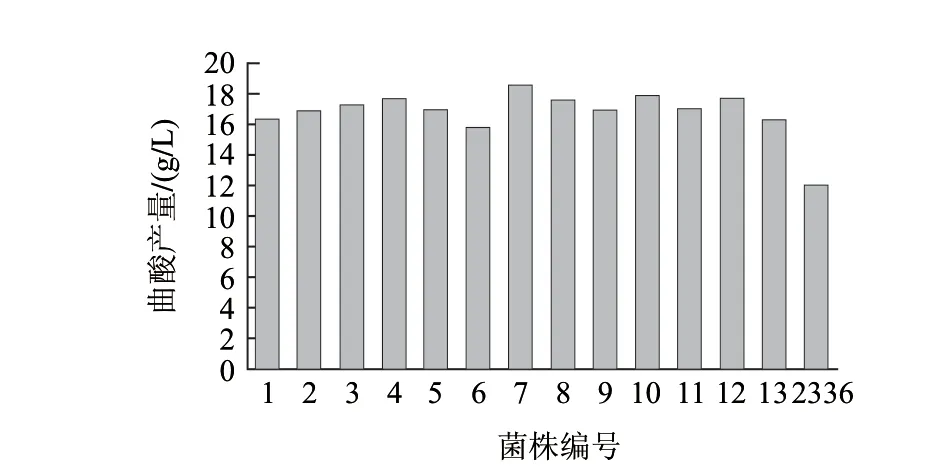
图 4 UV诱变选育结果Fig.4 Kojic acid production of UV-induced mutant strains
2.2.3 亚硝酸盐(NV)诱变的存活率及选育结果
由图5可知,随着诱变时间的增加,菌株的存活率逐渐下降,诱变时间为15min时,菌株几乎已无存活,这样将很难选育到优良的菌株。一般采用存活率在20%左右的诱变剂量。因此,最适的诱变时间为5min,此时的存活率为24.23%。图6显示,经过摇瓶复筛选育出一株编号NV3的突变菌株,其产酸量为23.58g/L。与原始菌株2336相比产酸量12g/L提高96.50%,与UV7菌株产酸量18.50g/L相比,提高27.46%。

图 5 亚硝酸盐诱变存活率曲线Fig.5 Survival rate of Aspergillus oryzae CICC-2336 after nitrite treatment

图 6 亚硝酸盐(NV)诱变选育结果Fig.6 Kojic acid production of nitrite-induced mutant strains
2.2.4 N+注入诱变存活率及选育结果

图 7 注入能量为10 keV N+注入存活率曲线Fig.7 Survival rate of Aspergillus oryzae CICC-2336 after N+implantation (10 keV)
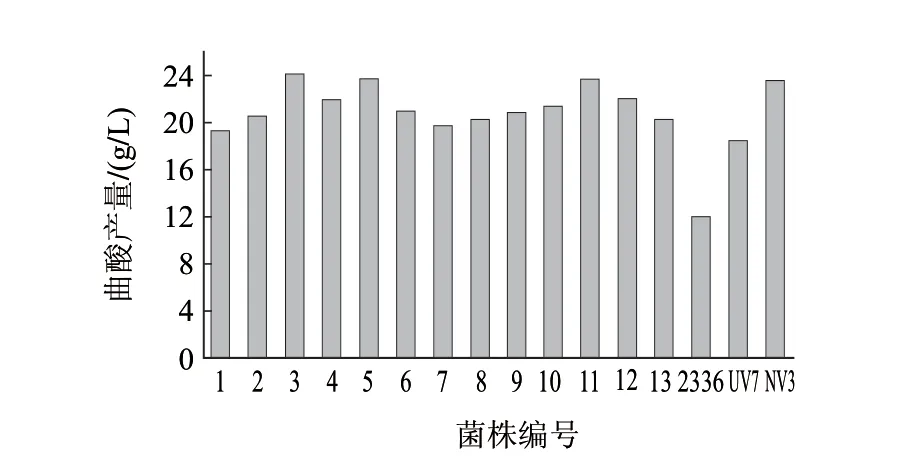
图 8 N+诱变选育结果Fig.8 Kojic acid production of N+ implantation-induced mutant strains
由图7可知,随氮离子注入剂量的增加,菌株存活率曲线呈现较明显的先降后升再降的“马鞍型”变化。在注入剂量为5×1014ions/(cm2·s)时,菌株的存活率为
42.12%,当注入剂量为10×1014ions/(cm2·s)时,存活率下降到22.87%,但是注入剂量达到15×1014ions/(cm2·s)时,菌株存活率反而提高到29.12%,接着增大注入剂量到20×1014ions/(cm2·s)时,存活率又降低到12.43%。出现这种现象的主要原因是低剂量注入时,离子对细胞表面进行损伤和刻蚀,因而存活率较高。随着剂量的增加,细胞表面刻蚀严重,离子损及细胞内部并产生大量自由基和软射线等,致使存活率急剧下降;继续加大剂量,细胞某种修复机制和修复酶被激活,存活率又有所回升。本实验选用10×1014ions/(cm2·s)的注入剂量为诱变的最适剂量,其存活率为22.87%。由图8筛选结果可以看出,经过7d摇瓶筛选后,获得1株高产菌株N11,其产酸量为24.12g/L。与UV7菌株产酸量18.50g/L相比,提高30.38%,与NV3相比,产酸量提高2.29%,与原始菌株2336产酸量12g/L相比,更是提高101%。
2.3 菌种的生长曲线

图 9 米曲霉2336生长曲线Fig.9 Time courses of cell growth and kojic acid production of the parent strain 2336

图 10 米曲霉N11生长曲线Fig.10 Time courses of cell growth and kojic acid production of the mutant strain N11
由图9可知,米曲霉2336发酵产曲酸量第7天达到最大值;生物量在第5天达到最大。所以,米曲霉2336的发酵周期为7d。图10可以看出,诱变菌种N11发酵产酸量也是在第7天达到最大值;生物量在第6天达到最大。所以,米曲霉N11的发酵周期也为7d。
2.4 突变菌株的遗传稳定性
诱变菌种N11经过6次传代实验,每次传代1号瓶与2号瓶两个平行瓶之间的曲酸产量相差不大,整体产酸量均保持在23.65g/L左右,菌株性能稳定,结果见图11。而诱变菌种NV3传代到第2代时,产酸量就由原来的23.58g/L降到了17.45g/L(结果未显示),出现了明显的下降。经过紫外、N+注入复合诱变选育出1株高产菌株N11,该菌株的产酸量达到24.12g/L,比出发菌株提高101%。比以往的传统单因素诱变提高显著,虽然结果与采用紫外、亚硝酸盐的复合诱变获得的菌株NV3相比,产量只提高2.29%,但是经过传代实验后,NV3在传代到第2代就出现产量明显下降的情况,而N11经过传代6次后,产量基本保持在23.65g/L左右,说明采用N+注入这种化学诱变、物理诱变为一体的综合诱变方法能够得到遗传稳定性更好的高产菌株,再加上离子注入诱变除了引起微生物能量沉淀造成机体损伤外,还可以产生动量传递和遗传物质原子移位、重排,它本身就相当于一种复合诱变,比单一诱变更有效。因此证明本复合诱变是一种更有效的诱变方法,对提高菌种产酸水平有非常好的效果。
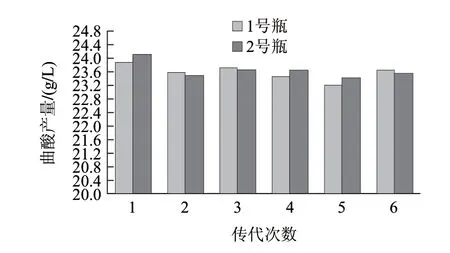
图 11 米曲霉N11传代结果Fig.11 Genetic stability of the mutant strain N11 for kojic acid production
3 结 论
3.1 从5种可产曲酸的实验菌株中筛选出1株出发菌株CICC-2336,并且测定出其原始产酸量为12g/L。
3.2 经过N+注入诱变的菌种,发生了较理想的正突变,随着氮离子注入剂量的增加,菌株存活率曲线呈现较明显的先降后升的“马鞍型”变化。理想的注入条件为:注入能量10keV,注入剂量10×1014ions/(cm2·s)。
3.3 比较CICC-2336进行紫外、N+注入的复合诱变和紫外、亚硝酸盐的复合诱变的实验结果,最终确定紫外、N+注入的复合诱变为较有效的诱变方法;经过该复合诱变,菌株的产酸水平提高到24.12g/L,比原始菌株提高101%。
3.4 经紫外、N+注入的复合诱变获得的曲酸高产菌株经过6次传代实验,产酸量基本维持在23.65g/L左右的水平,菌株性状稳定。
[1] 朱秀容, 康建平. 曲酸的生产现状及其在食品与日化工业的应用[J].四川食品与发酵, 2002, 38(1): 26-29.
[2] 古丽孜拉. 曲酸的特性与应用[J]. 杭州食品科技, 2006(2): 6-9.
[3] LEE Y S, PARK J H, KIM M H, et al. Synthesis of tyrosinase inhibitory kojic acid derivative[J]. Archiv der Pharmazie, 2006,339(3): 111-114.
[4] 李凤林, 谢晓松. 曲酸菌的选育及发酵工艺条件研究[J]. 发酵科技通讯, 2009, 38(3): 15-19.
[5] 李一婧, 马伟超. 曲酸生产菌种的筛选和发酵工艺条件的优化[J].中国酿造, 2006(6): 42-44.
[6] FENG Huiyun, YU Zengliang, CHU P K. Ion implantation of organisms[J]. Materials Science and Engineering, 2006, 54(3/4):49-120.
[7] SONG Yun, ZHANG Huaiyu, CHANG Zhijian. Progress of mutation breeding with ion beam implantation[J]. Molecular Plant Breeding,2004, 2(2): 301-305.
[8] LI Shichang, WU Min, YAO Jianming, et al. Mutation screening in xylanase-producting strains by ion implantation[J]. Plasma Science &Technology, 2005, 7(1): 2697-2700.
[9] LIU J, LIU M, WANG J, et al. Enhancement of the gibberella zeae growth inhibitory lipopeptides from a Bacillus subtilis mutant by ion beam implantation[J]. Appl Microbiol Biotechnol, 2005, 69: 223-228.[10] WU Yuejin, ZHANG Ying, WU Jingde, et al. Study on the variation of the distant crossing rice by ion beam implantation[J]. Plasma Science& Technology, 2005, 7(2): 2785-2788.
[11] LI Dequan, NIE Fengya, WEI Lihui, et al. Screening of high-yielding biocontrol Bacterium Bs-916 mutant by ion implantation[J]. Appl Microbiol Biotechnol, 2007, 75: 1401-1408.
[12] 蔡兴旺, 杜连祥, 路福平. N+离子注入诱变选育耐酸性α-淀粉酶高产菌株[J]. 原子能科学技术, 2011, 45(4): 467-473.
[13] 潘涛, 周剑, 虞龙. 离子注入诱变技术在柠檬酸高产菌选育中的应用[J]. 化学与生物工程, 2005(3): 123-126.
[14] 林健辉, 黄曼曼, 陈雪香, 等. 曲霉T3-5-1产单宁酶培养条件优化[J].食品科学, 2010, 31(19): 245-249.
[15] 张春玲. 紫外线与亚硝基胍复合诱变选育高产海藻糖菌株的研究[J]. 食品科学, 2009, 30(21): 188-191.
[16] 赵凯, 孙立新, 王旋, 等. 高产紫杉醇菌株的诱变选育及其差异表达基因消减cDNA文库的构建[J]. 微生物学报, 2011, 51(7): 923-933.
[17] 庞锐, 潘丽军, 姜绍通, 等. N+注入诱变选育混合糖发酵L-乳酸高产菌株[J]. 食品科学, 2010, 31(21): 248-253.
[18] 张宁, 虞龙. 低能N+诱变B.trispora(-)菌存活率-注量效应模型的构建[J]. 辐射研究与辐射工艺学报, 2010, 28(2): 83-86.
[19] 张理珉, 程立忠, 陆和生. 三氯化铁比色法测定曲酸含量方法的改进[J]. 生物技术, 2000, 10(3): 2-3.
