茶树菇多糖提取的复合酶制剂筛选及工艺研究
2013-07-13周瑶毛淑红孙祺华伯元王娜胡晓杰刘莎路福平
周瑶,毛淑红,孙祺,华伯元,王娜,胡晓杰,刘莎,路福平,*
(1.工业发酵微生物教育部重点实验室(天津科技大学),天津 300457;2.天津科技大学生物工程学院,天津 300457;3.工业酶国家工程实验室,天津 300457;4.天津市工业微生物重点实验室,天津科技大学,天津 300457)
食用菌是一类营养丰富并有很高食用和药用价值的大型真菌总称[1],它作为一类高蛋白、低脂肪、营养价值很高的绿色食品日益受到全世界的重视,并成为保健食品的重要功能因子[2-4],因此社会对食用菌的研究也越来越深入。食用菌富含多糖、维生素、氨基酸等天然活性成分,其中多糖是一类具有某种特殊生物活性的化合物,具有免疫调节功能[5]、抗肿瘤[6]、延缓衰老、降血糖[7]、抗血栓作用等。
茶树菇(Agrocybe aegerita)又叫茶薪菇,杨树菇,柱状田头菇,柳松茸等,属于真菌界、担子菌门、层菌纲、伞菌目、粪锈伞科、田蘑属,民间晒干后用于头晕、头痛、呕吐及小儿低烧、老人气喘等症状的治疗,因此被人们称为“菇中珍品”,享有“中华神菇”,“神仙菇”之称。现代医学研究证明,其可滋阴壮阳,对肾虚、尿频、水肿、癌症、高血压、早衰及小儿低热、尿床等都有较理想的辅助治疗功能[8]。茶树菇是一种富含多糖的高蛋白﹑低脂肪,矿物质含量相对较高,营养价值很高的食用菌。茶树菇多糖的提取方法主要包括热水提取法、超声波提取法、微波提取法和酶法,水提法虽然简单经济,但是多糖的得率较低,超声波提取法和微波提取法在传统的方法上多糖提取率有所提升,但是增幅不大,而且对多糖结构也有一定破坏,酶法技术具有高效、无毒、反应条件温和等优点[9-10]。本实验采用两种复合酶分步酶解法获得营养物质,为茶树菇的深加工提供了理论参考。
1 材料与方法
1.1 仪器与试剂
紫外可见分光光度计,离心分离机,pH 酸度计,电热恒温水浴锅,恒温干燥箱,微量滴定管,电子分析天平,循环水式多用真空泵,高速组织粉碎机等。
硫酸为国产分析纯;纤维素酶,木聚糖酶,β-葡聚糖酶,木瓜蛋白酶,果胶酶(天津滨海诺奥酶工程技术有限公司,酶活性:≥80 U/mg);干茶树菇子实体(购于市场,制成80 目粉末)。
标准溶液的配制:精确称取干燥恒重葡萄糖100mg,置于100mL容量瓶中用蒸馏水定容,得浓度为1 mg/mL。葡萄糖贮备溶液,再准确移取20 mL,用蒸馏水定容至100 mL,得0.2 mg/mL 的葡萄糖使用液。
苯酚溶液的配制:苯酚(纯苯酚为针状无色结晶),水浴加热后称取100 g,加铝片0.10 g、加入氢氧化钠0.05 g,蒸馏收集178 ℃~182 ℃的馏分,取馏出液10.0 g,加入水190 mL,得5%的苯酚溶液,置于棕色瓶中备用。
1.2 实验方法
1.2.1 标准曲线的绘制
吸取标准溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL 于10 mL 比色管中,分别加入蒸馏水0.9、0.8、0.7、0.6、0.5、0.4、0.3 mL,各加5%的苯酚溶液1 mL 后,再加入浓硫酸5 mL,摇匀放置冷却,补加蒸馏水到刻度。另取10 mL比色管加入蒸馏水1 mL,加5%的苯酚溶液1 mL,然后加入浓硫酸5mL,按上述方法制得空白溶液,在490nm处测定吸光度。以糖的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。经计算回归方程为Y=0.0061x-0.006 6,相关系数R=0.998 8。
1.2.2 茶树菇多糖的提取及含量测定
称取10 g 茶树菇粉末,置于100 mL 三角烧瓶中,加入蒸馏水10 mL,分别加入各种浓度的酶,并调节初始pH、温度、反应时间,得到茶树菇提取液。加入3 倍体积的乙醇,静置于4 ℃冰箱24 h;离心(6 000 r/min、10 min),取沉淀,加10 mL 蒸馏水溶解;Sevag 法[11]除蛋白,取上清液,加水稀释取样用苯酚硫酸法[12]测量茶树菇多糖的含量。
1.2.3 利用复合生物酶制剂分步制取茶树菇水解液的工艺

2 结果与分析
2.1 一次酶解过程中水解茶树菇条件的确定
2.1.1 单因素实验
采用单因素试验确定酶浓度,水解时间,初始pH,水解温度以及料液比对茶树菇的水解程度,并测定其水解液中多糖的含量,以此选择复合酶水解试验的条件依据。
2.1.1.1 酶添加量对茶树菇水解影响
每组称取茶树菇子实体粉末10 g,料液比1∶10(g/mL),温度50 ℃,在初始pH 为4.5 时分别加入不同的酶,纤维素酶、木聚糖酶、β-葡聚糖酶,添加量分别0.05%,0.10%,0.15%,0.20%,0.25%,酶解2 h,升温灭酶,检测水解液中多糖含量,酶添加量对茶树菇水解液中多糖含量的影响如图1 所示。

图1 酶添加量对茶树菇水解液中多糖含量的影响Fig.1 Enzyme concentration for influence of polysaccharide amount in A.aegirit hydrolysate
如图1 所示,随着酶添加量的增加茶树菇水解液中的多糖含量也随着增加,当酶添加量增加到0.15%时茶树菇水解液中的多糖含量也达到峰值,再增加酶添加量茶树菇水解液中的含量也没有明显增加。
2.1.1.2 初始pH 对茶树菇水解液的影响
每组称取茶树菇子实体粉末10 g,料液比1∶10(g/mL),温度50 ℃,在初始pH 为4.0、4.5、5.0、5.5、6.0 时分别加入纤维素0.15%,木聚糖酶0.15%,β-葡聚糖酶0.20%,进行酶解,酶解2 h,升温灭酶,检测水解液中多糖含量,pH 对茶树菇水解液中多糖含量的影响如图2 所示。
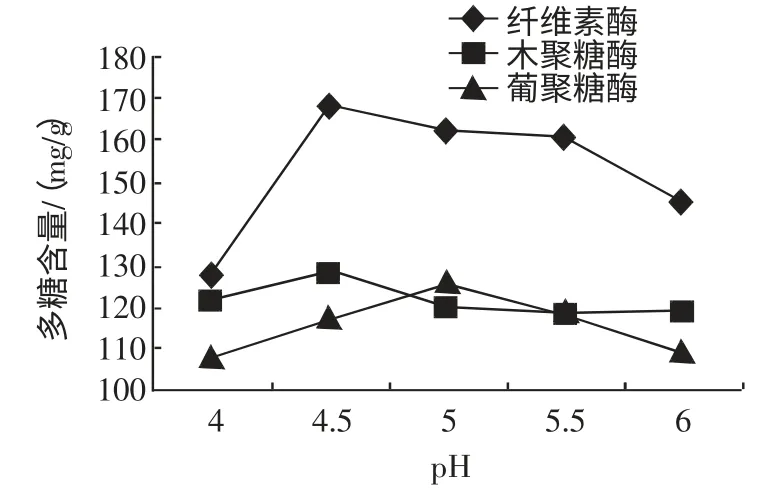
图2 pH 对茶树菇水解液中多糖含量的影响Fig.2 pH for influence of polysaccharide amount in A.aegirit hydrolysate
如图2 所示,随着pH 变大茶树菇水解液中的多糖含量也随着增加,当pH 达到4.5~5 时茶树菇水解液中的多糖含量也达到峰值,之后再增大pH 茶树菇水解液中的多糖含量逐渐降低。
2.1.1.3 酶解时间对茶树菇水解液的影响
每组称取茶树菇子实体粉末10 g,料液比1∶10(g/mL),在温度50 ℃时分别加入纤维素酶0.15%,木聚糖酶0.15%,β-葡聚糖酶0.20%,进行酶解,在初始pH 为4.5 时,分别酶解1、2、3、4、5 h,升温灭酶,检测水解液中多糖含量,酶解时间对茶树菇水解液中多糖含量的影响如图3 所示。
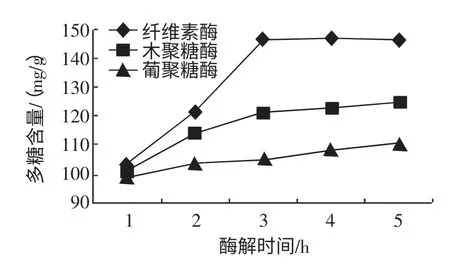
图3 酶解时间对茶树菇水解液中多糖含量的影响Fig.3 Time for influence of polysaccharide amount in A.aegirit hydrolysate
如图3 所示,随着酶解时间的增长茶树菇水解液中的多糖含量也随着增加,当酶解时间达到3 h 时茶树菇水解液中的多糖含量也达到峰值,再延长酶解时间茶树菇水解液中的含量也没有明显增加。
2.1.1.4 酶解温度对茶树菇水解液的影响
每组称取茶树菇子实体粉末10 g,料液比1∶10(g/mL),在40、45、50、55、60 ℃不同温度时,分别加入纤维素酶0.15%,木聚糖酶0.15%,β-葡聚糖酶0.20%,进行酶解,在初始pH 为4.5 时酶解2 h,升温灭酶,检测水解液中多糖含量,酶解温度对茶树菇水解液中多糖含量的影响如图4 所示。
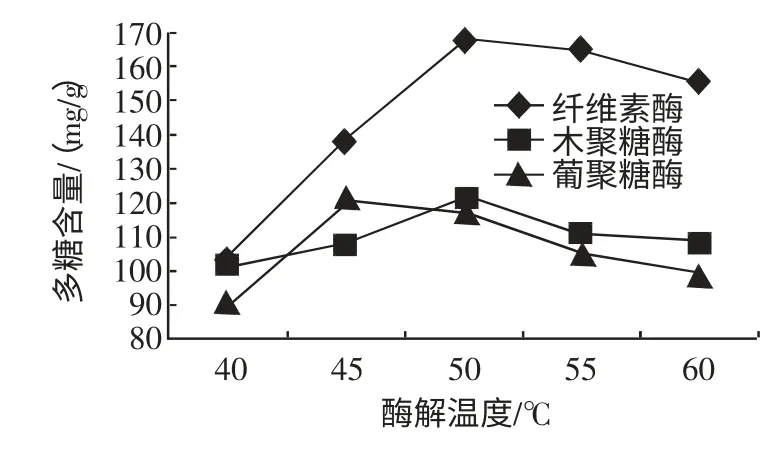
图4 酶解温度对茶树菇水解液中多糖含量的影响Fig.4 Temperature for influence of polysaccharide amount in A.aegirit hydrolysate
如图4 所示,随着酶解温度增加茶树菇水解液中的多糖含量也随着增加,当酶解温度达到45 ℃~50 ℃时茶树菇水解液中的多糖含量也达到峰值,之后再增加酶解温度茶树菇水解液中的多糖含量逐渐降低。
2.1.1.5 料液比对茶树菇水解液的影响
每组称取茶树菇子实体粉末10 g,在温度50 ℃时分别加入纤维素酶0.15%,木聚糖酶0.15%,β-葡聚糖酶0.20%,在初始pH 为4.5 时,酶解2 h,分别选择料液比1∶10,1∶20,1∶30,1∶40,1∶50(g/mL),升温灭酶,检测水解液中多糖含量,料液比对茶树菇水解液中多糖含量的影响如图5 所示。
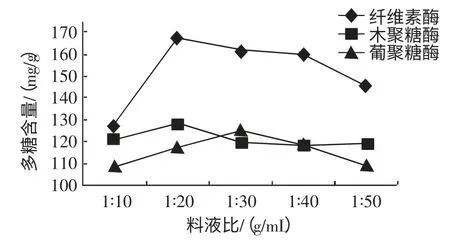
图5 料液比对茶树菇水解液中多糖含量的影响Fig.5 Material/liquid ratio for influence of polysaccharide amount in A.aegirit hydrolysate
如图5 所示,随着料液比增加茶树菇水解液中的多糖含量也随着增加,当料液比达到1∶20(g/mL)时茶树菇水解液中的多糖含量也达到峰值,之后再增大料液比值茶树菇水解液中的多糖含量逐渐降低。
2.1.2 复合酶I 的正交试验
由于茶树菇的细胞壁是由蛋白质、几丁质、纤维素组成,较坚固,为了更好地使是蛋白质和多糖等溶出,又不使成本过高,采用纤维素酶,β-葡聚糖酶和木聚糖酶共同作用,以提高茶树菇细胞壁的破碎率。
在使用纤维素酶,木聚糖酶,β-葡聚糖酶共同作用时,由于通过单因素试验可知纤维素酶,木聚糖酶,β-葡聚糖酶的最佳作用浓度分别为0.15%,0.15%及0.20%,我们以前两者用量为0.15%作为基准,后者分别以0.15%,0.20%,0.25%,0.30%与之进行复配,在单酶试验的基础上,同时又考虑了复合酶I 的水解初始pH,水解时间和水解温度的影响,选用L16(54)进行正交试验,正交试验因素水平如表1。以水解液中多糖含量为考察指标,分析试验结果,确定复合酶I 水解茶树菇的最适条件。
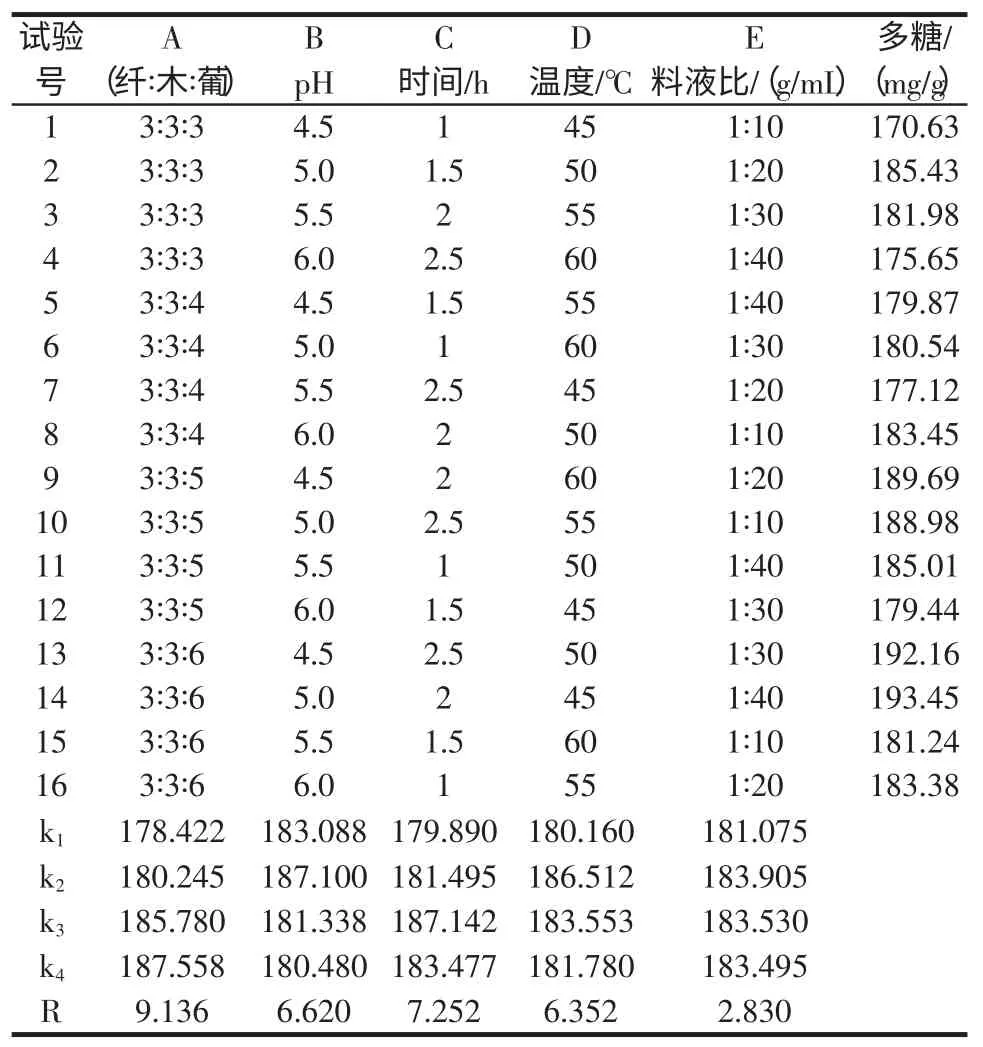
表1 复合酶I 正交试验L16(54)因素与水平Table 1 the orthogonal experiments of Composite enzyme I factors and level
由表1 可知,各因素的主次顺序依次是A、C、B、D、E,最佳的水平条件组合为A4B2C3D2E2。通过正交试验得到复合酶I 提取茶树菇多糖的最佳工艺条件为:纤维素酶∶木聚糖酶∶β-葡聚糖酶=3∶3∶6,pH 为5.0,酶解时间2 h,酶解温度50 ℃,料液比为1∶20(g/mL)。在此条件下茶树菇水解液中的多糖含量为197.65 mg/g。
2.2 二次酶解水解茶树菇条件的确定
在使用木瓜蛋白酶,果胶酶共同作用时,以前者用量为0.20%作为基准,后者分别以0.15%、0.20%、0.25%、0.30%的添加量与之合用,在单酶实验的基础上,同时又考虑了复合酶II 的水解初始pH,水解时间和水解温度的影响。以水解液中多糖含量为考察指标,分析试验结果,确定复合酶II 水解茶树菇提取多糖的最适条件。
通过正交试验得到复合酶II 提取茶树菇多糖的最佳工艺条件为:木瓜蛋白酶∶果胶酶=4∶6,酶解温度55 ℃,酶解时间2 h,pH 为4.0,料液比为1∶40(g/mL)。在此条件下茶树菇水解液中的多糖含量为201.86mg/g。
3 结论
采用两种复合酶制剂进行茶树菇多糖的提取,通过正交试验筛选出了复合酶制剂的最佳组合:一次酶解的最优条件为纤维素酶:木聚糖酶:β-葡聚糖酶=3∶3∶6,pH 为5.0,酶解时间2 h,酶解温度50 ℃,料液比为1∶20(g/mL)。二次酶解的最优条件为木瓜蛋白酶∶果胶酶=4∶6,酶解温度55 ℃,酶解时间2 h,pH 为4.0,料液比为1∶40。此次实验,我们采用的复合酶制剂分步水解的方法与其它实验相比,可以明显提高多糖的提取率,多糖含量较其它也有显著升高。比较一二次酶解效果,经过二次酶解后多糖含量比一次酶解后的多糖含量没有明显的增加,说明二次酶解并没有使多糖物质更多的释放,但是经过二次酶解后其它的生物活性物质(如:α-氨基氮等)较一次酶解后都有大幅度的提升。从经济利益方面考虑,最终确定茶树菇提取多糖的复合酶制剂配方为一次酶解的最优条件,即纤维素酶:木聚糖酶:β-葡聚糖酶=3∶3∶6,pH 为5.0,酶解时间2 h,酶解温度50℃,料液比为1∶20(g/mL)。
[1]郑毅,余望.茶薪菇人工栽培及营养分析[J].中国食用菌,1999,18(5):13-14
[2]孔繁祚.糖化学[M].北京:科学出版社,2005:633-648
[3]王小东,毛慧玲,王顺启.真菌多糖的研究进展[J].江西科学,2005,23(3):243-246
[4]李小定,荣建华,吴谋成.真菌多糖生物活性研究进展[J].食用菌学报,2002,9(4):50-58
[5]欧阳天贽,李小定,荣建华.真菌多糖抗肿瘤及免疫调节作用研究进展[J].天然产物研究与开发,2006,18(3):524-528
[6]刘栋,钱建亚,卜敏,等.香菇多糖抗肿瘤作用研究现状[J].中国食用菌,2003,22(2):6-7
[7]方积年,丁侃.天然药物-多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-347
[8]Tytler,Alexander Fraser.Essay on the Principles of Translation [M].London:Oxford University Press,1986:212-215
[9]赵前程,滕钊,汪秋宽.复合酶法提取海带多糖的研究[J].沈阳农业大学学报,2007,38(2):220-223
[10]Figoli,A,Tagarelli,A,Mecchia,A,et al.Enzyme-assisted pervaporative recovery of concentrated bergamot peel oils[J].Desalination,2006,199:111-112
[11]齐慧玲,魏绍云,王继伦,等.Sevag 法去除白及多糖中蛋白的研究[J].天津化工,2000(3):20-22
[12]傅明辉,叶秀仪,郭秀萍,等.茶薪菇子实体多糖的分离纯化和抗氧化活性的测定[J].药物生物技术,2004,11(5):321-323
