高效液相色谱法测定α-乳白蛋白和β-乳球蛋白
2013-07-12王莹屈玉霄刘春红冯志彪
王莹,屈玉霄,刘春红,冯志彪,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.东北农业大学理学院应用化学系,黑龙江 哈尔滨 150030)
乳清蛋白是牛奶中的一种主要蛋白质,β-乳球蛋白(β-l g)和α-乳白蛋白(α-la)是其主要成分,分别占其总量的40%~50%和10%~20%。β-牛乳球蛋白包括β-Lg A 和β-Lg B 两个遗传变异体[1-2]。随着人们生活水平的提高,奶制品在中国的消费量增加迅速。但婴幼儿中牛乳蛋白过敏症(cow′milk allergy,CMA)的发生较为普遍,并且呈逐年上升趋势[3],婴幼儿主要是对β-乳球蛋白和α-乳白蛋白过敏,而酪蛋白则在成人持续性过敏中占主导地位[4],因此,建立牛乳β-乳球蛋白和α-乳白蛋白高特异性、高灵敏度、快速、准确的检测方法,将对维护CMA 患儿的健康起到积极的作用。
目前,实验室中经常用检测α-la 和β-lg 的方法主要有:聚丙烯凝胶电泳[5-6]、色谱和电泳法[7]、毛细管电泳[8-10]、酶联免疫吸附试验(ELISA)[11]等。但以上各种方法在测定α-乳白蛋白时都有一定的局限性,液相色谱法是分析乳清蛋白成分的有效方法之一,具有分辨率和回收率高、重复性好、操作简便等优势。目前,反相高效液相色谱分析乳清蛋白在国内外已经进行了一定的研究[12-16]。但是国内对市售α-乳白蛋白样品的分析罕见报道。
采用C8色谱柱,优化了α-乳白蛋白和β-乳球蛋白的分析条件,与现有的方法相比缩短了分析时间、简化了洗脱条件,而且鉴别出β-Lg A 和β-Lg B 两种异构体,将建立的定量测定两种蛋白质的方法为监测目前市场中各类乳清蛋白粉保健品及低过敏乳制品的质量提供了有效的方法。
1 材料与方法
1.1 材料与仪器
α-乳白蛋白标准品、β-乳球蛋白标准品:美国Sigma 公司;乙腈:色谱纯;三氟乙酸(TFA):色谱纯,美国TEDIA 公司;高效液相色谱仪(Waters1525 型)、二级管阵列检测器(Waters 2998)、自动进样器(Waters 2707):美国Waters 公司;色谱柱(4.6 mm×150 mm,5 μm):Agilent-C8,美国安捷伦公司。
1.2 实验方法
1.2.1 色谱条件
流动相:流动相(A)为乙腈+三氟乙酸(1 000∶0.5),流动相(B)为含0.1%三氟乙酸的超纯水;梯度洗脱程序:流动相A 在15 min 内从30%上升到50%,然后用2 min 从50%降到30%,流速1 mL/min,柱温25 ℃;检测波长:280 nm;进样量:10 μL。
1.2.2 对照品溶液的制备
精确称取α-乳白蛋白及β-乳球蛋白标准品10 mg,用超纯水配制成2 mg/mL 的原液,上述溶液均作为标准储备液,保存于4 ℃冰箱中备用。
1.2.3 样品溶液的制备
5 种样品标注信息见表1。

表1 5 种样品信息Table 1 The information of samples used
采用凯氏定氮法测定各样品中的蛋白质含量。
分别精确称取5 种样品各40 mg,用去离子水定容至10 mL 备用。
样品在上样前均用孔径为0.22 μm 的针式滤器过滤。
2 结果与讨论
2.1 流动相的选择
α-乳白蛋白属于溶菌酶家族的蛋白,含有123 个氨基酸残基,分子量为14.2 ku。α-乳白蛋白有N 型构象(天然构象)和A 型构象(酸构象),在乳的正常pH(pH6.6~6.8)时,呈N 型构象;当pH<5 时,N 型构象向A 型构象转移。此外,升高温度、碱性pH、添加低浓度变性剂、Ca2+的去除和一定金属离子如Zn2+的添加会引起构象的此类转化[17]。β-乳球蛋白属于lipocalin 蛋白家族,其单体由162 个氨基酸残基组成[18],分子量18.3 ku,等电点5.3。其存在形式与pH 有关,在鲜牛乳中pH(6.6~6.8),它是以二聚体的形式存在,当pH 低于3.5 时,二聚体离解成单体,pH 在3.5~5.2 之间时,二聚体四聚化形成八聚体,pH 高于7.5 时,二聚体解离且构象发生变化形成膨胀的单体[19]。根据α-乳白蛋白和β-乳球蛋白结构,本实验选用了上述Agilent C8色谱柱。本文采用C8柱分离,目标物出峰时间短,峰形尖锐而且对称,分离度较好,可以满足β-乳球蛋白和α-乳白蛋白的分析要求。
采用反相高效液相色谱方法分析蛋白的流动相系统基本为三氟乙酸的水溶液和乙腈溶液,采用梯度洗脱,但随着样品的不同及色谱柱的不同,梯度洗脱条件也随之改变。在蛋白质的反相液相色谱分离中,初始洗脱条件下流动相中有机溶剂的浓度较低,蛋白质与固定相间的疏水作用较强,蛋白质几乎完全被固定相吸附。而一旦流动相中的有机溶剂达到特定的浓度,使蛋白质与固定相的作用小于与流动相的作用时,蛋白质就会完全从固定相上洗脱下来,几乎不再与固定相发生作用。本试验尝试了以不同比例的三氟乙酸的水溶液和乙腈溶液作流动相。当以高比例的水进行梯度洗脱时,蛋白质的出峰时间延迟;而以高比例的乙腈进行梯度洗脱时,多肽及蛋白质的出峰时间缩短,但α-乳白蛋白和β-乳球蛋白不能分开。在兼顾保留时间和分离度的前提下,最终选择用于测定α-乳白蛋白的流动相及梯度洗脱条件如“1.2.1”节所述。标准品和样品的分离结果分别见图1、图2 和图3。

图1 α-乳白蛋白和β-乳球蛋白标样的色谱图Fig.1 HPLC chromatogram of standard protein reference
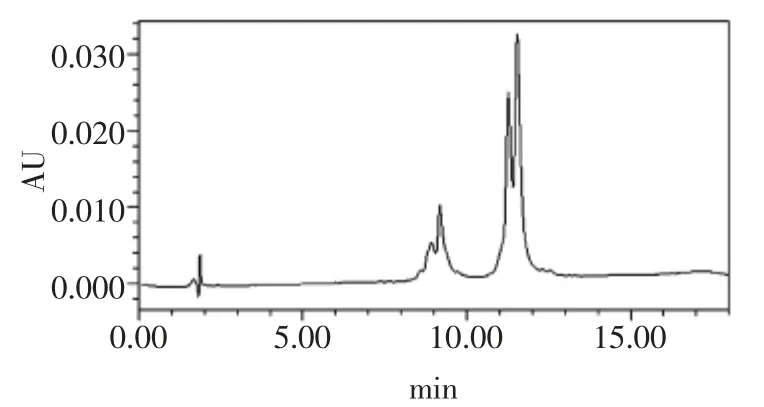
图2 WPI 的高效液相色谱图Fig.2 HPLC chromatogram of WPI
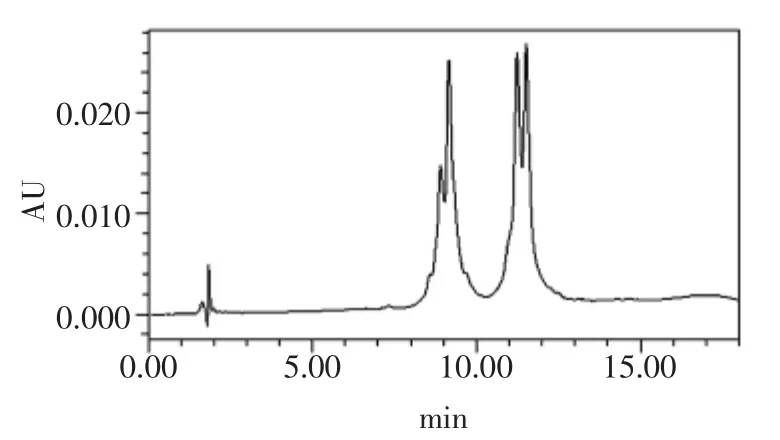
图3 市售α-乳白蛋白的高效液相色谱图Fig.3 HPLC chromatogram of commercial available α-la
由图2、图3 可以看出,WPI 中β-乳球蛋白占主要部分,而α-乳白蛋白含量相对较少,市售α-乳白蛋白样品中,α-乳白蛋白的含量相对较高,国内对这种市售α-乳白蛋白研究较少,如进一步对其研究将具有十分重要的意义。
2.2 线性相关性及检出限
按1.2.1 所述色谱条件进行测定,以峰面积为纵坐标,浓度为横坐标做标准曲线,以信噪比S/N=3 测定α-乳白蛋白和β-乳球蛋白最小检出限,结果见表2。

表2 两种乳清蛋白的线性方程、相关系数及检测限Table 2 Linear equations,correlation coefficients and detection limit of α-la and β-lg
由表2 还可看出,两组分在测定的浓度范围内线性关系良好。
2.3 方法的稳定性及重现性
将配制好的α-乳白蛋白和β-乳球蛋白标准溶液在室温下保存24 h 后,按1.2.1 所述色谱条件,每样平行测定5 次,测定α-乳白蛋白和β-乳球蛋白含量的相对标准偏差(RSD)分别为1.7%和2.3%。表明24 h内对上述两种标准品的检测符合要求。
精密称取待测样品1 各3 份,溶解定容后用针式滤器过滤处理,分别进样10 μL,按照外标法测定其中的α-乳白蛋白和β-乳球蛋白的含量,并计算其RSD分别为2.1%和3.1%表明该法重现性良好。
2.4 加样回收率实验
取样品2 和样品3 各3 份,分别加入一定量的标准品混合溶液,用0.22 μm 的针式滤器过滤后进样测定,结果见表3。
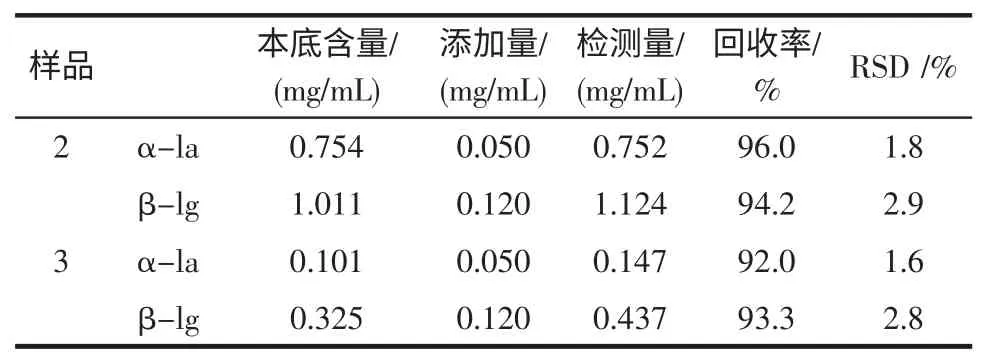
表3 回收率测定结果(n=3)Table 3 Determination results of recovery(n=3)
由表3 可以看出,两种样品回收率均大于92.0%,测定标准偏差均小于5%,符合实验要求。
2.5 样品的测定结果
取一定量的样品按1.2.3 样品处理方法及1.2.1 色谱条件进行测定,样品色谱图见图2 和图3。由图2、图3 可知,样品中α-乳白蛋白和β-乳球蛋白的出峰时间与其标准品的出峰时间一致,色谱分离效果很好。由于α-乳白蛋白有N 型构象(天然构象)和A 型构象(酸构象),所以α-乳白蛋白的样品具有两个峰。说明该方法能有效的检测出的α-乳白蛋白和β-乳球蛋白。通过外标法测得样品中α-乳白蛋白和β-乳球蛋白的含量及在样品蛋白质中所占的比例,结果见表4。
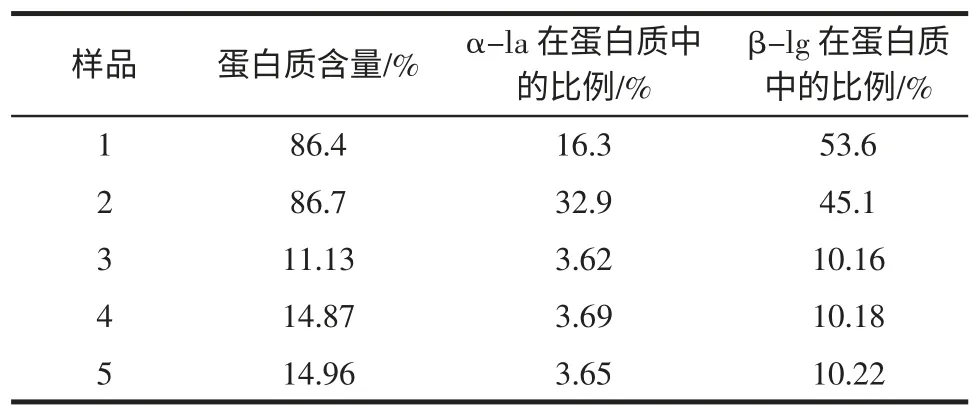
表4 样品测定结果Table 4 Determination results of sample
根据表4 可以看出,该方法可以用于检测奶粉样品中两种蛋白的含量,能够快速检测婴幼儿配方食品中α-乳白蛋白及β-乳球蛋白含量。
3 结论
利用C8色谱柱,采用HPLC 法测定牛乳中主要过敏蛋白α-乳白蛋白及β-乳球蛋白的含量,其测定条件为:Agilent-C8(4.6 mm×150 mm,5 μm)色谱柱,流动相A 为含0.5%三氟乙酸的乙腈,流动相B 为含0.1%三氟乙酸的超纯水,采用梯度洗脱方法,柱温25 ℃,流速1 mL/min,进样量10 μL,检测波长280 nm,外标法定量。在该条件下样品中的α-乳白蛋白和β-乳球蛋白分离度较好,出峰时间适中。
用本法测定牛乳中的主要过敏蛋白α-乳白蛋白和β-乳球蛋白,简便易行、准确灵敏,可为乳制品的质量评价及生产工艺控制提供依据。
[1]管斌,林洪,王广策.食品蛋白质化学[M].北京:化学工业出版社,2005:303
[2]Kinghorn N M,Norris C S,Paterson G R,et al.Comparison of capillary electrophoresis with traditional methods to analysis bovine whey proteins[J].Chromatogr A,1995,700:111-123
[3]Gareia-Ara M C,Boyano-Martínez MT,Díaz-Pena J M,et al.Cow′s milk-specific immunoglobulin E levels as predictors of clinical reactivity in the follow-up of the cow′s milk allergy infants[J].Clin Ex P Allergy,2004,34(6):866-87
[4]DelaReguera C.Systematie review and modelling of the investigation of aeute and chronie cow′s milk allergy [J].Arch Inst Cardiol,1978,48(5):979-994
[5]Alban A,David S O,Bjorkesten L,et al.A novel experimental design for comparative two-dimensional gel analysis:two-dimensional difference gel electrophoresis incorporating a pooled internal standard[J].Proteomics,2003(3):36-44
[6]Rehder-Silinski MA,McGown LB.Capillary electrochromatographic separation of bovine milk proteins using a G-quartet DNA stationary phase[J].J Chromatogr A,2003,1008:233-245
[7]Strange E D,Malin E L,Van Hekken D L,et al.Chromatographic and electrophoretic methods used for analysis of milk proteins[J].Journal of Chromatography A,1992,624:81-102
[8]De Jong N,Visser S,Olieman C.Determination of milk proteins by capillary electrophoresis[J].J Chromatogr A,1993(652):207-213
[9]Visser S,Slangen CJ,Rollema HS.Phenotyping of bovine milk proteins by reversed-phase high-performance liquid chromatography[J].J Chromatogr A,1991,548:361-370
[10]Xiao jing Ding etal.Analysis of α-lactalbumin,β-lactoglobulin A and B in whey protein powder,colostrum,raw milk,and infant formula by CE and LC[J].Dairy Sci&Technol,2011,91:213-225
[11]张中华.牛乳α-乳白蛋白和β-乳球蛋白间接竞争ELISA 检测方法的建立[D].昆明医学院,2009
[12]李慧,陈敏,李赫,等.反相高效液相色谱法测定乳清蛋白中的α-乳白蛋白和β-乳球蛋白[J].色谱,2007,125(1):116-117
[13]Mercier A,Gauthier S F,Fliss I.Immunomodulating effects of whey proteins and their enzymatic digests [J].Int Dairy J,2004,14(3):175-183
[14]Mota M,Ferreira I,O liveira M,et al.Enzymatic hydrolysis of whey protein concentrate:peptide HPLC profile [J].Journal of Liquid Chromatography&Related Technologies,2004,27(16):2625-2639
[15]M iddleton N,Reid J R,Coolbear T,et al.Proliferation and intracellular glutathione in Jurkat T cells with concentrated whey protein products[J].Int Dairy J,2003,13(7):565-573
[16]Sharma R,Zakora M,Qvist K.Susceptibility of an industrial alpha lactalbumin concentrate to cross linking by microbial transglutaminase[J].Int Dairy J,2002,12(12):1005-1012
[17]赵维新,于国萍,张永忠,等.乳品化学[M].科学出版社,2007:88-118
[18]Braunitzer G,Chen R,Schrank B,et al.The sequence of beta-lactoglobulin (author's transl)[J].HoPPe Seylers Z PHysiol Chem,1973,354(8):867-878
[19]Brownlow S,Morais Cabral JH,Cooper R,et al.Bovine beta-lactoglobulin at 1.8 A resolution-still an enigmatic lipocalin[J].Structure,1997,5(4):481-495
